乳腺癌骨转移研究的新进展及展望
——从机制到临床
王家辉,蒋林兰,沈 赞
上海交通大学附属第六人民医院肿瘤内科,上海 200233
乳腺癌是女性最常见的恶性肿瘤,2020年全球乳腺癌新发病例高达226万,且发生率在女性新发恶性肿瘤中居首(24.5%)[1]。乳腺癌骨转移是晚期乳腺癌常见的并发症之一,约70%的患者会发生骨转移[2],特别是激素受体阳性的乳腺癌患者。骨转移会导致骨代谢紊乱从而引发骨相关事件(skeletal-related events,SRE),严重影响患者的生命及生活质量[2]。研究表明,骨转移是影响乳腺癌预后的重要因素,当患者为早期乳腺癌且无转移时,其5年生存率高达90%,一旦出现转移,其5年生存率将降至10%[3]。因此,深入研究乳腺癌骨转移的分子机制,寻找有效的治疗靶点并进行早期有效的治疗具有十分重要的意义。本文就乳腺癌骨转移的最新研究进展进行综述。
1 乳腺癌骨转移可能的机制
乳腺癌骨转移的发生是一个复杂的过程。近年来研究表明,多种机制参与乳腺癌骨转移的发生、发展。在转移的早期,肿瘤通过影响骨微环境,形成转移前的龛位为“播种”准备“土壤”[4]。例如,肿瘤细胞分泌的外泌体能够特异性地与靶器官融合,诱导转移前微环境的形成[5]。此外,在转移形成前,原发性肿瘤能够诱导周细胞(血管旁细胞)形成转移前的龛[6]。乳腺癌细胞在骨中定殖过程中,不仅能够分泌赖氨酰氧化酶(lysyl oxidase,LOX),增加骨细胞外基质的硬度,而且能够分泌结缔组织生长因子(connective tissue growth factor,CTGF)刺激血管生成,从而有利于促进肿瘤细胞定植[7-8]。在乳腺癌细胞定植后,肿瘤细胞的存活和转移依赖于其与骨微环境之间的相互作用,包括骨溶解、血管和基质信号的重编程、免疫调节和免疫逃逸等[8]。肿瘤细胞可以向骨微环境中分泌多种细胞因子,包括白细胞介素(interleukin,IL)-6、Jagged、IL-11、细胞外钙敏感受体(calcium-sensing receptor,CaSR)和甲状旁腺激素相关蛋白(parathyroid hormonerelated protein,PTHrP)等,进而刺激骨细胞和成骨细胞合成核因子-κB(nuclear factor κB,NF-κB)活化因子配体(receptor activator of NFκB ligand,RANKL)[8-9]。RANKL与破骨细胞表面的NF-κB受体活化因子(receptor activator of NF-κB,RANK)结合诱导破骨细胞分化成熟,从而启动骨吸收。而骨基质释放促进修复的生长因子[如转化生长因子β(transforming growth factor-β,TGF-β)]正反馈地促进肿瘤细胞生长,进而形成恶性循环。此外,肿瘤细胞还能够诱导硬化蛋白和其他成骨信号的拮抗剂,如Dickkopf相关蛋白1(DKK1),抑制新生骨的形成从而促进肿瘤进展[10]。
在骨微环境中,肿瘤细胞能够利用多种免疫细胞产生免疫逃逸,并促进癌细胞在骨中扩散和生长,例如肿瘤细胞通过分泌TGF-β和前列腺素E2(prostaglandin E2,PGE2)以诱导树突状细胞(dendritic cell,DC)分化为免疫耐受性DC,进而抑制T细胞的免疫应答;肿瘤细胞表达的血管细胞黏附分子1(vascular cell adhesion molecule 1,VCAM-1)与单核细胞中的α4整联蛋白结合,触发肿瘤细胞中Ezrin/PI3K/Akt抗凋亡信号转导;肿瘤细胞产生的粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)和IL-6促进了髓样来源的抑制细胞(myeloid-derived suppressor cells,MDSC)的生成,而MDSC产生的精氨酸酶Ⅰ则抑制T细胞的免疫应答并将诱导Treg的扩增[11]。此外,骨微环境中其他免疫细胞(中性粒细胞、Th17、NK细胞等)也可与肿瘤细胞相互作用,协同促进肿瘤的进展和转移(图1)。
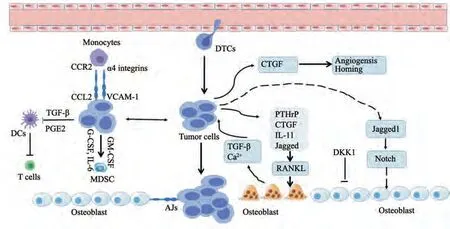
图1 乳腺癌骨转移机制示意图[12]Fig.1 Schematic diagram of the mechanism of breast cancer bone metastasis[12]
2 乳腺癌骨转移的治疗
鉴于乳腺癌骨转移的高倾向性及发生骨转移后的不良预后,因而抗骨转移治疗具有十分重要的意义。目前的治疗方式有以下四类。
2.1 免疫治疗
在过去的10年中,免疫治疗[尤其是抗程序性死亡[蛋白]-1(programmed death-1,PD-1)或抗程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)疗法]在黑色素瘤、肺癌、乳腺癌、肾细胞癌和头颈部肿瘤等癌症治疗中取得了突破性的进展,但在骨转移领域,却鲜有临床报道。Ji等[13]的动物实验研究表明,PD-1免疫疗法能够抑制破骨细胞的生成,从而在预防骨破坏和减轻骨癌疼痛方面产生长期益处。此外,目前有多种免疫细胞被认为是治疗癌症转移的靶标,例如,DC由于其专业的抗原提呈能力而能够有效地预防和治疗转移[14];靶向肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)释放的CC族趋化因子配体18(CC chemokine ligand 18,CCL18),能够有效地抑制乳腺癌转移[15]。此外,抑制MDSC的功能活性或去除Treg均能有效地减少肿瘤负荷和癌症转移的风险。尽管免疫治疗在肿瘤转移方面取得了非常显著的进展,但骨转移本身是一种独特的疾病,因而仍需要进一步研究。
2.2 针对破骨细胞的治疗
2.2.1 双膦酸盐
有研究表明,双膦酸盐能够有效地治疗骨破坏,预防或延缓SRE的发生[16]。此外,Sun等[17]研究表明,包裹唑来膦酸的纳米金颗粒联合光热疗法(photothermal therapy,PTT)能够有效地抑制癌细胞的生长并诱导其凋亡进而改善骨骼微环境,缓解骨痛。这种利用纳米颗粒递送唑来膦酸并结合PTT的疗法,为治疗乳腺癌骨转移提供了新的策略。
2.2.2 地诺单抗(denosumab)
地诺单抗是靶向RANKL的特异性单克隆抗体,能够有效地抑制破骨细胞介导的骨吸收,并在2010年被批准用于实体瘤引起的SRE。然而,在早期乳腺癌中,由于两项大队列、安慰剂对照研究相互矛盾的数据,地诺单抗是否能降低骨转移的风险目前尚未确定。在ABCSG-18研究中,使用地诺单抗(60 mg/6个月)联合芳香化酶抑制剂治疗绝经后激素受体阳性的早期乳腺癌患者后,其5年及8年无疾病进展生存率(progressionfree survival,PFS)明显高于安慰剂联合内分泌治疗[18]。相比之下,D-CARE试验的结果表明,无论绝经与激素受体状态如何,高剂量地诺单抗(每3~4周120 mg)并没有改善乳腺癌早期患者的预后,相反,其颌骨骨坏死的发生率明显高于安慰剂[19]。但由于这两项研究在患者特征、设计和地诺单抗给药方面存在根本差异,因而地诺单抗是否能降低骨转移风险仍需进一步验证。
2.2.3 依维莫司(everolimus)
mTOR在破骨细胞分化、存活中至关重要,抑制mTOR会增加成骨细胞中骨保护素(osteoprotegerin,OPG)的表达,进而诱导破骨细胞凋亡。对于绝经前激素受体阳性并伴有内脏转移的晚期乳腺癌患者来说,LEO试验表明,依维莫司联合来曲唑和亮丙瑞林治疗,能够延长患者无进展生存期并降低SRE发生,但是并不能提高患者的总生存率[20]。
2.2.4 卡博替尼(cabozantinib)
卡博替尼是酪氨酸激酶抑制剂,能够抑制肿瘤中MET和VEGFR2的表达,从而降低肿瘤负荷和骨转移的发生。在一项单臂多中心Ⅱ期临床研究中,卡博替尼能够改善人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性的乳腺癌骨转移患者的骨病变,并能够延长患者的总生存期[21]。但是,由于该研究存在较大的局限性(样本量少、单臂研究),仍需进一步的研究。
2.2.5 其他
其他抗骨吸收的创新药有组织蛋白酶K抑制剂和15D11等。组织蛋白酶K抑制剂奥达那卡能够在乳腺癌骨转移患者中有效地抑制骨吸收,但是奥达那卡的Ⅲ期临床试验由于其心血管不良反应而终止研究[11];15D11是抗Jagged1的单克隆抗体,能够抑制肿瘤细胞中Jagged的表达从而抑制破骨细胞的过度激活,进而抑制肿瘤生长,但是目前尚处于临床前研究阶段[22]。
2.3 针对成骨细胞的治疗
研究表明,Wnt/β-连环蛋白以及Wnt信号的内源性抑制剂(例如DKK-1和硬化蛋白)是成骨细胞重要的调节因子。罗莫昔单抗(romosozumab)是一种抗硬化蛋白抗体,能够在绝经后女性中增加骨质,降低骨吸收[23]。Hesse等[24]的动物实验研究表明,抗硬化蛋白抗体能够减少乳腺癌骨转移和肌肉无力症状,有望成为乳腺癌新的治疗靶点,但目前尚未应用于临床中。
2.4 放射治疗
放射治疗能有效地缓解骨转移引起的疼痛,减少病理性骨折的发生及肿瘤对脊髓的压迫。包括体外放射治疗和内放射治疗。
体外照射放疗(external beam radiation therapy,EBRT)广泛用于预期寿命较短或因骨痛恶化需要再次放疗的患者。此外,EBRT联合骨靶向治疗有利于肿瘤的控制,能够防止骨折的发生。相较于EBRT,立体定向放疗(stereotactic body radiation therapy,SBRT)的优点是其能够精准地作用于肿瘤灶,能够最大程度地减少对健康组织的损害。对于骨转移患者,SBRT比传统的EBRT有更好的临床疗效,接受SBRT治疗的患者疼痛缓解更快且更持久[25]。但是,在接受SBRT治疗后,患者病理性骨折发生率略高,可能与局部高剂量辐射有关[26]。
镭-223(radium-223,233Ra)可用于内放射治疗,233Ra是一种α粒子的放射性同位素,其能够模拟钙,优先吸收到骨形成增加的区域,由于其高能、短程的辐射,因而能够在对局部肿瘤产生强效的细胞毒效应的同时限制对周围正常组织的损伤,2013年被美国食品药品管理局(Food and Drug Administration,FDA)批准用于前列腺癌骨转移的治疗[27]。为了评估233Ra治疗乳腺癌骨转移患者的疗效,在一项多中心、随机、对照试验(NCT02258464)中,纳入了99例HER2阴性、激素受体阳性的转移性乳腺癌患者,在单一内分泌治疗的背景下,每4周静脉注射233Ra(50 kBq/kg),最多6个周期,结果显示,233Ra不仅可显著地延长患者的中位生存期(相较于安慰剂,中位数为43.0个月vs32.4个月)和无症状性骨骼事件生存期(symptomatic skeletal eventfree survival,SSE-FS)(相较于安慰剂,中位数为30.1个月vs18.4个月),同时还能改善患者的疼痛,而不良反应的发生率与安慰剂组(37.50%vs36.83%)相近[28]。此外,在一项单臂、单中心的Ⅱ期临床试验中,在内分泌药物治疗和地诺单抗治疗的基础上,添加223Ra可以在激素受体阳性并伴有骨转移的患者达到较好的疾病控制效果,并且能够很好地控制骨转移[27]。
3 总结与展望
近年来,随着对乳腺癌骨转移机制研究的不断深入,乳腺癌骨转移的治疗取得了快速的进展。许多可以延缓患者骨转移时间、延长总生存期和改善生活质量的骨靶向药物陆续被应用于临床。许多新药也正处于临床前研究或临床试验阶段,其中进入临床试验的包括正在进行的一项Ⅱ期临床试验(NCT04090398)用于评估223Ra联合常规化疗(紫杉醇)对晚期乳腺癌骨转移患者的治疗效果[29]。进入临床前研究的有SM-164、5-氮杂胞苷和恩替司他等。小分子抑制剂SM-164能够通过降解凋亡蛋白抑制剂(inhibitor of apoptosis protein,IAP)来抑制乳腺癌细胞的早期转移[30];低剂量的DNA甲基转移酶抑制剂和组蛋白脱乙酰基酶抑制剂能够下调CC族趋化因子受体2(CC chemokine receptor 2,CCR2)和CXC族趋化因子受体2(CXC chemokine receptor 2,CXCR2)的表达,进而抑制MDSC运输并促进MDSC分化为巨噬细胞样表型,从而破坏骨转移前的龛位[31]。尽管取得了上述进展,但从根本上防治乳腺癌骨转移仍存在相当大的困难。因而,探索新的治疗方案,靶向性、特异性地开发出新型有效的药物将成为该领域的研究重点。
利益冲突声明:所有作者均不存在利益冲突。

