有机化学机理解题思路与方法*
李海浪,彭跃颜,毕丽伟,秦 飞,叶廷秀,罗红元
(厦门医学院药学系,福建 厦门 361023)
有机化学反应类型多,反应条件复杂。多年的教学实践发现,很多学生把有机化学学习简单理解成机械式的记忆反应,结果大量的、“杂乱无章”的反应越记头越乱,跟英语单词没什么两样。其实,这完全是学生对有机化学的误解,即使是英语单词的记忆也还是有规律可循的。表面上看起来杂乱无章的反应,同样也还是有规可循的,那就是反应机理。如果我们把各种各样的反应比作英语“句子”,那么有机化学的反应机理就是英语的“语法”。由此可见,唯有对基础理论以及基本机理过程的深刻理解,才能将表面上互不相干的现象以及过程联系成为一个整体,从而达到对有机化学本质的认识和掌握[1]。多年教学实践发现,学生对有机反应普遍采用死记硬背的学习方法。这种学习方法用于少数几个反应还能凑效,随着反应类型与数量增加,这种“知其然而不知其所以然”的有机化学学习方法使得有机化学越学越无章法,尤其是将其用于有机反应机理的学习上更是如此。因为,有机化学反应是宏观表现出来的总反应,它是反应过程多步基元反应的集成。由此可见,提出一个具有相对普遍意义的思维模式来指导有机反应机理学习具有重要意义。
1 有机化合物是酸-碱复合体
有机化学反应的实质就是分子中旧键的断裂和新键的形成,根据共价键断裂方式有机化学反应可分为自由基型反应和离子型反应[2]。
1.1 均裂和自由基型反应
共价键的均裂是指组成共价键的一对电子,在共价键断裂后均分到共价键连接的两个原子或基团上:

图1 共价键的均裂
自由基孤电子所在的轨道只有一个电子而一个轨道可容纳两个自旋方向相反的电子,因此,自由基可以给出一个电子变成正离子,也可以再接受一个电子变成负离子。根据路易斯酸碱理论,能给出电子的物质是路易斯碱,能接受电子的物质是路易斯酸[3]。可见,我们可以把自由基看作路易斯酸或路易斯碱,图1.的逆过程就是酸碱反应形成酸-碱复合体X-Y(路易斯酸碱理论没有盐的概念,这里姑且定义一个新概念“酸-碱复合体”)。
1.2 异裂和离子型反应
共价键的异裂是指共价键断裂后,成键的一对电子完全归成键的一个原子或原子团所有:

图2 共价键的异裂
显然,图2的逆过程就是典型的路易斯酸碱反应,形成酸-碱复合体X-Y。离子型反应通常在酸、碱或极性条件下进行。基础有机化学涉及到的反应绝大多数是离子型反应,因此,本文将焦点集中在离子型反应机理的探讨上。
2 极性反应三要素
我们把极性条件下进行的反应称为极性反应:
由图3可见,极性反应涉及三个物种:路易斯碱OH-、路易斯酸Cδ+和路易斯碱Clδ-。根据路易斯酸碱理论,带负电的、富电子的以及可以给出电子的都是碱;与碱相对应,带正电的、缺电子的以及可以接纳电子的都是酸。路易斯碱为亲核试剂(位点),路易斯酸为亲电试剂(位点)。为了描述方便,我们把极性反应涉及的三个物种路易斯碱OH-、路易斯酸Cδ+和路易斯碱Clδ-推广并分别称之为亲核试剂(位点)、亲电试剂(位点)以及离去基团,统称极性反应三要素[4]。一个反应体系、分子或中间体,只要同时存在亲核试剂(位点)、亲电试剂(位点)以及离去基团极性反应三要素,则该分子或中间体即无法稳定存在,必将进行后续反应。

图3 极性反应过程Fig.3 The process of polar reaction
3 应用极性反应三要素寻找有机反应机理突破口并导航后续反应路径
有机反应机理第一道难关是如何寻找解题突破口,即:从何入手? 首先,分析该机理是酸性条件还是碱性条件,如反应机理是酸性条件,则寻找反应物的亲核位点。亲核位点常见的有孤对电子、π电子以及σ电子(常发生在C+重排)。反之,则寻找亲电位点。常见的亲电位点为Cδ+。不管是酸性条件或是碱性条件,有机极性反应机理的第一步都是酸碱反应形成酸-碱复合体。有机极性反应机理的第二个、第三个,……难题是后续反应如何进行?后续反应路径的导航针:在酸-碱复合体中寻找亲核位点、亲电位点以及离去基团,其本质就是进行一系列极性反应。下面由简到难,应用极性反应三要素对三例极性反应机理的突破口以及后续反应路径进行具体分析。
3.1 推测下列反应产物并提出合理的理由

本例题实际上就是Perkin反应的机理问题[5],具体分析如下:

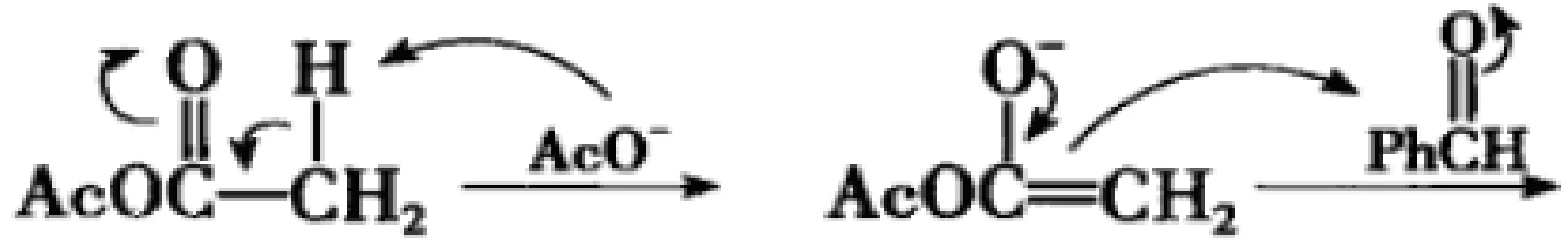
(2)第二步,Cα-作为碱亲核位点进攻酸亲电位点苯甲醛的羰基碳,形成碱醇氧负离子。
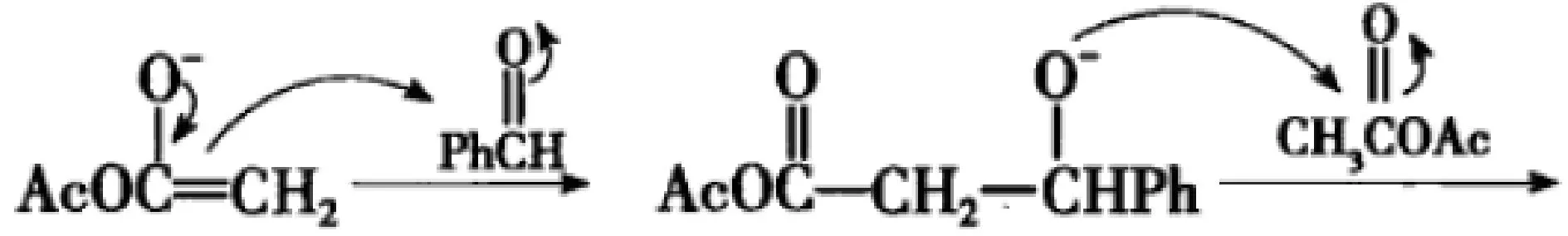
(3)第三步,醇氧负离子作为碱亲核试剂,进攻酸性亲电位点乙酸酐的羰基碳,形成新的醇氧负离子。

(4)第四步,醇氧负离子作为亲核试剂,氧、乙酰氧基所连接的Cδ+带部分正电荷为亲电进攻位点,乙酰氧基为离去基团(醋酸根离子氧原子上的负电荷可与羰基共振形成两个等同的共振式特别稳定,是好的离去基团),因此,该中间体发生分子内的SN2反应。
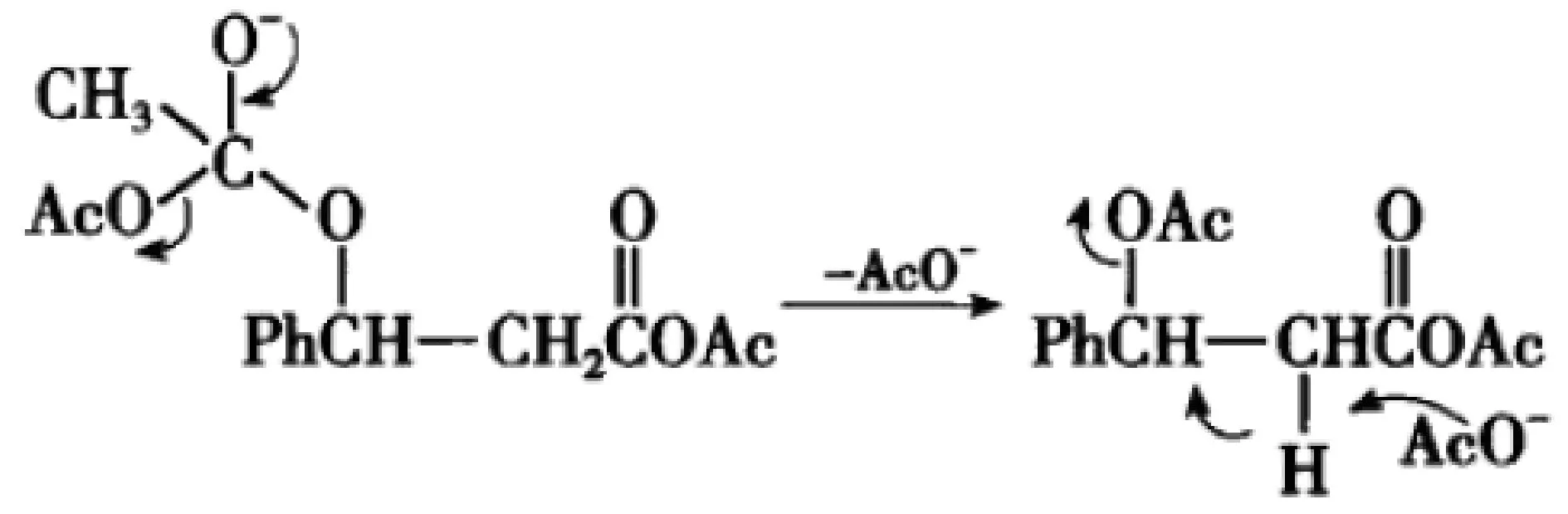
(5)第五步,醋酸根离子作为碱进攻酸性的α-H,形成α-C-亲核位点,与乙酰氧基相连接的Cδ+带部分正电荷为亲电部位,乙酰氧基为离去基团,教科书上称之为反式E2消除反应。正如庐山“横看成岭侧成峰”,该中间体同时具备亲核试剂、亲电位点、离去基团(醋酸根离子是好的离去基团),我们完全可以从另一个角度看,认为该中间体发生发生分子内SN2反应,形成C=C双键。

(6)第六步,OH-作为碱、亲核试剂进攻酸、亲电部位酸酐羰基碳,通过加成-消除机理失去一分子醋酸根。
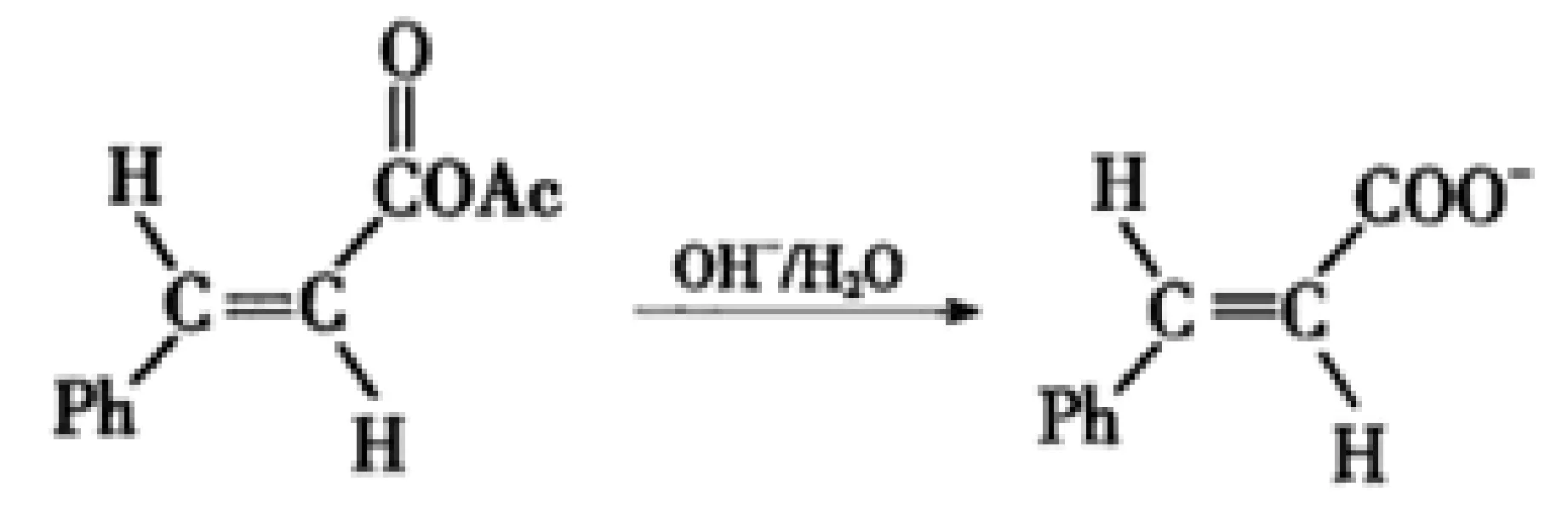
(7)最后一步为简单的酸碱中和反应。

3.2 给下列反应提出合理的机理[6]

(1)第一步,如何寻找突破口是解本题反应机理的关键!在碱性条件下,目标很明确就是寻找酸性氢或亲电位点。本反应物有三个α-H,其中一个α-H有一个体积较大的氯原子,难以受到碱的进攻。因此,OH-进攻羰基右边的α-H形成α-C-离子与羰基形成共振体。

(2)第二步,本中间体烯醇负离子的碳为亲核试剂,氯原子所连接的碳原子为亲电位点,氯原子为离去基团,发生分子内SN2反应,形成环丙酮结构。

(3)第三步,羰基碳为酸、亲电位点,OH-为碱、亲核试剂,二者发生酸-碱加成反应,形成醇氧负离子。

(4)第四步、在本中间体中,OH氧原子所连接的碳原子为酸亲电位点,醇氧负离子为亲核试剂,碳负离子为离去基团,发生分子内SN2反应。碳负离子碱性极强,容易从水分子截获质子。本步骤进行的动力为三元环极大的张力,开环后张力解除,体系能量降低。

(5)由于第四步水失去质子变成OH-,第五步为羧酸在碱性条件下简单的酸碱反应。
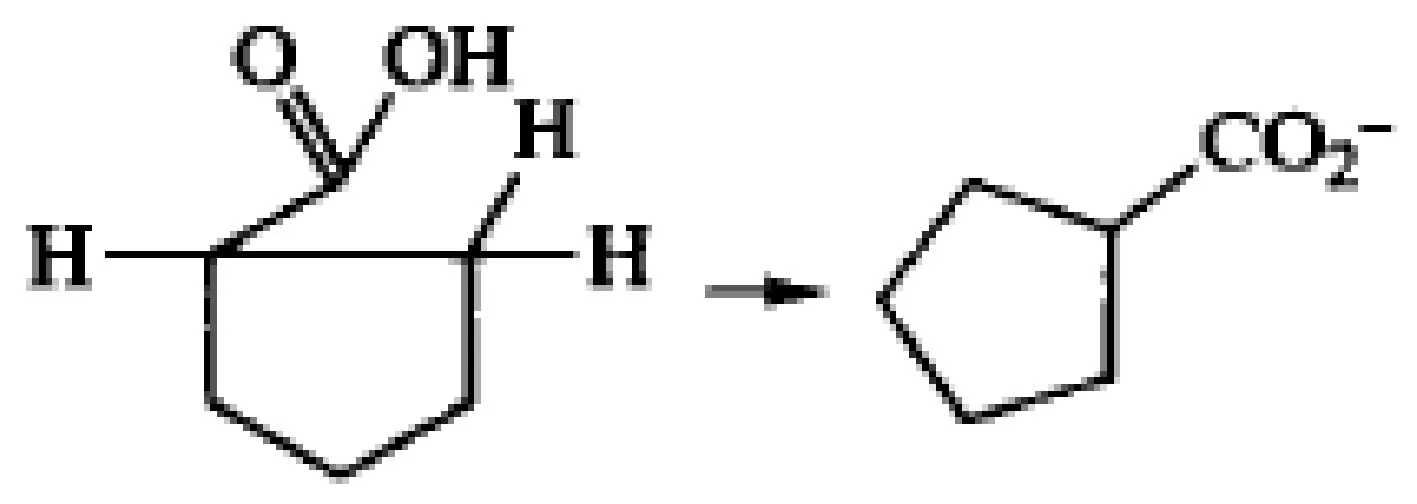
3.3 请为下列反应提出合理的反应机理[7]
初看本例机理较为复杂,但不管如何复杂,我们还是可以“极性反应三要素”为指导原则,寻找解题突破口。

(1)硫叶立德为亲核试剂,羰基碳为亲电位点,氧为离去基团(C=O等同于一个C连接两个O),发生分子间SN2反应(实际上就是羰基的亲核加成),形成醇氧负离子。
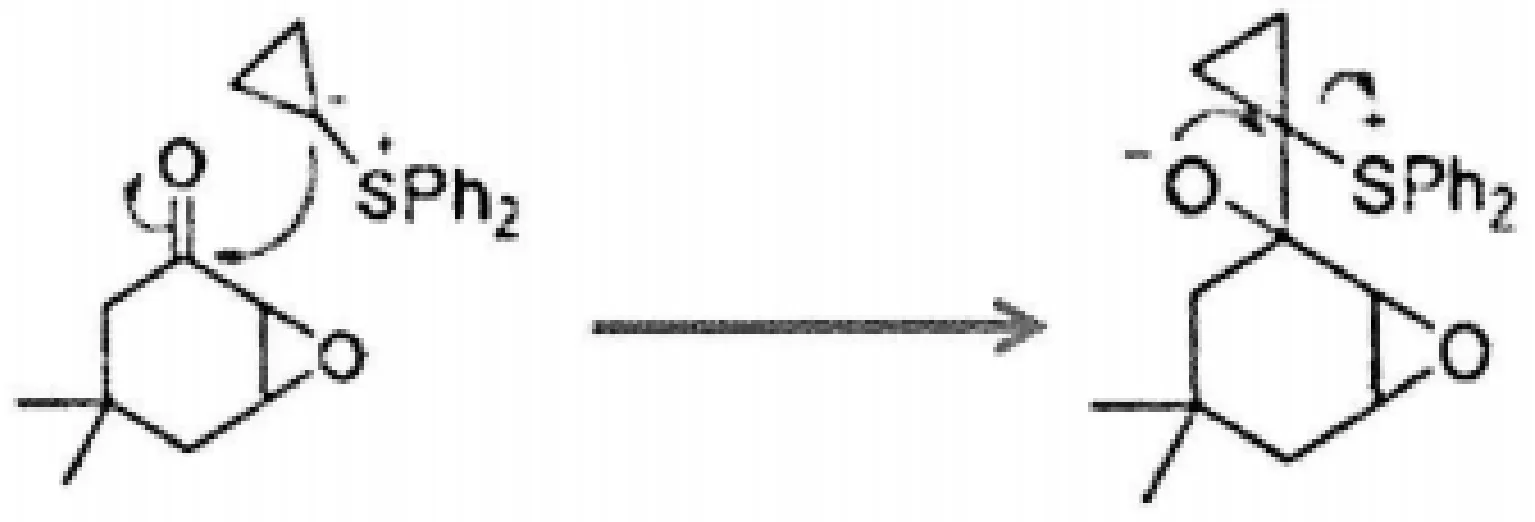
(2)醇氧负离子为亲核试剂,硫鎓离子所连接的C为亲电位点,SPh2为离去基团发生分子内SN2反应,形成大张力的“环氧结构”。

(3)理论上讲,两个环氧上的孤对电子都可以作为碱与H+发生质子化,考虑到产物保留六元环结构,排除与六元环姘合的环氧质子化,质子化发生在螺环氧原子。质子化后,OH正离子为离去基团,OH正离子所连接的碳原子为亲电位点,σ电子为亲核试剂,发生分子内SN2反应,形成碳正离子。张力较大的三元环转化为张力较小的四元环,使中间体能量降低是反应的动力。

(4)碳正离子是酸,OH氧原子上的孤对电子是碱,发生分子内的酸碱反应,形成羰基。

(5)MeO-是亲核试剂,羰基碳原子是亲电位点,氧原子O是离去基团(C=O等同于一个碳原子连接两个氧原子),发生分子间SN2反应(实际上就是羰基的亲核加成),形成O-离子。接着,O-离子为亲核试剂,MeO-连接的碳原子为亲电位点,螺碳原子为离去基团,发生分子内SN2反应形成碳负离子。张力环四元环的开环,是此步转化的动力。最后,碳负离子为亲核试剂,环氧原子为离去基团,环氧所连接的碳原子为亲电位点,发生分子内SN2反应,形成C=C和强碱醇氧负离子O-。
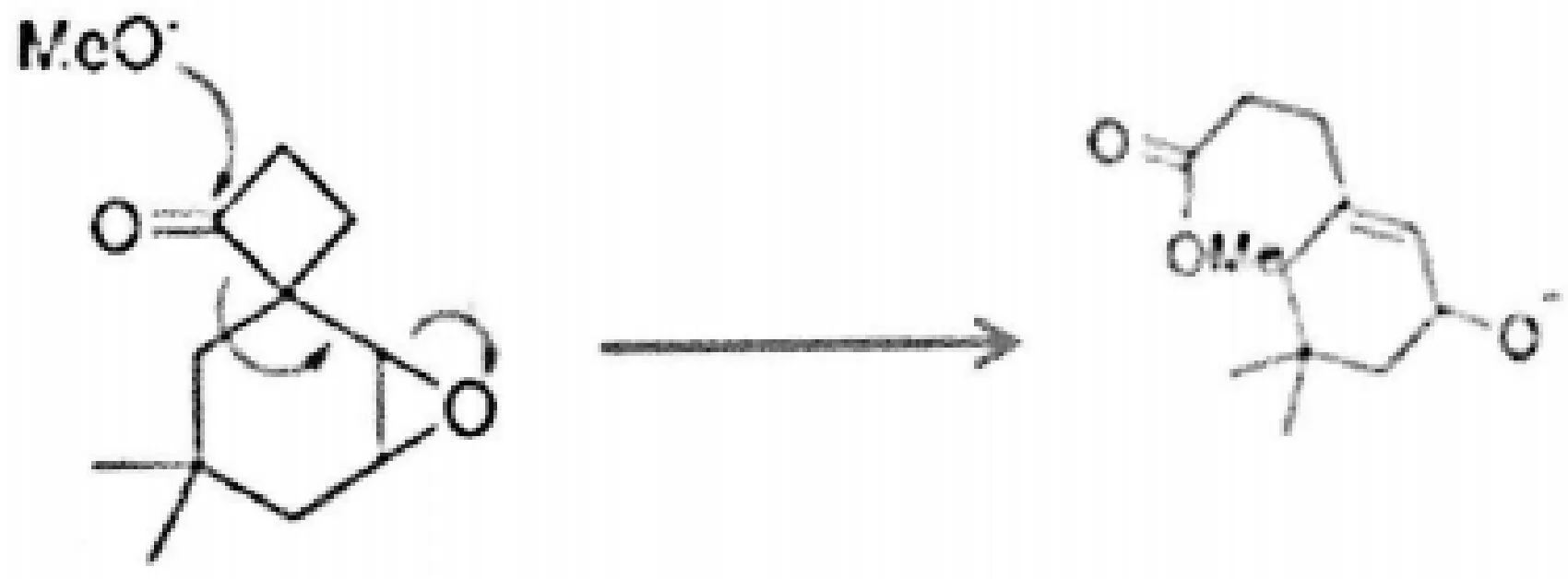
(6)强碱醇氧负离子从溶液中的甲醇截获质子,形成动态平衡。

4 结 语
有机化学反应机理是教学的重点、难点。教无定法,学也无定法。同样一个知识点,不同的人学完后用自己的语言进行概括转化为自己的东西、自己的心得也不完全一样,但这并不影响知识的学习,正如老中医把“肝、脾、肾”念成“肝、脾、贤”并不影响看病一样的道理。所谓“横看成岭侧成峰,远近高低各不同”,这也是允许的。作者认为,科学意味着不断探索。我们可以不断接近科学真理,但我们谁也不拥有真理。昨天的大哲先贤们不拥有真理,今天的大牌学者们也不拥有真理,明天科学先驱们也同样不能自称“因为我拥有真理,所以我是权威”[8]。本文的出发点是放飞想象的翅膀,大胆创新,不为条条框框所约束,只要教学中有利于学生把复杂的有机反应机理学清楚、学明白,“不管黑猫白毛,能抓到老鼠的就是好猫”。因此,本文带有明显的探索与开放味道。

