N-苄氧羰基甘氨酰-L-脯氨酸-鬼臼毒素衍生物的合成及其抗肿瘤活性
梁光平,杨 俊*,吴云秋,万路平,阮丽君,宋志军
(1遵义医药高等专科学校药学系,遵义 563006;2广西壮族自治区药用植物园西南濒危药材资源开发国家工程实验室,南宁 530023)
鬼臼毒素(podophyllotoxin)是一种具有显著抗肿瘤活性的天然产物,但因其存在水溶性较差、骨髓抑制、易产生耐药性等缺陷严重制约了临床应用[1-2]。虽然许多药学工作者对鬼臼毒素进行了大量的结构改造,相继也发现了依托泊苷(etopo⁃side)、替尼泊苷(teniposide)等药物[3]。然而,它们在临床应用时依然存在水溶性差、易耐药、严重的胃肠道功能紊乱等缺陷。因此,寻找更安全、选择性更好的鬼臼毒素类衍生物十分必要。

研究表明[4-5],N-苄氧羰基甘氨酰-L-脯氨酸(ZGly-Pro-OH)能特异性激活FAPα 酶,导致肿瘤细胞行为发生改变。这在表阿霉素[6]、吉西他滨[7]、沙蟾毒精[8]、蟾毒灵[9]等多个副作用较强的小分子中得以证实,这些副作用较强的小分子在与Z-Gly-Pro-OH 连接后,它们对正常器官或组织的副作用均有显著的降低。结合文献对鬼臼毒素构效关系的报道[10],本课题组前期借助计算机辅助药物设计技术筛选鬼臼毒素C4-OH 与Z-Gly-Pro-OH 之间的连接臂,最终获得130余个虚拟分子[11]。从这些虚拟分子中可知,采用氨基酸作为连接臂时,形成的虚拟分子与FAPα 酶具有更多的结合位点。为进一步研究氨基酸作为连接臂在该类鬼臼毒素衍生物研发中的价值,本研究采用不同的氨基酸将鬼臼毒素与Z-Gly-Pro-OH 进行拼接,合成了10 个新的鬼臼毒素衍生物,并通过测试它们的抗肿瘤活性,以期为开发具有自主知识产权的新型鬼臼毒素候选分子提供参考。
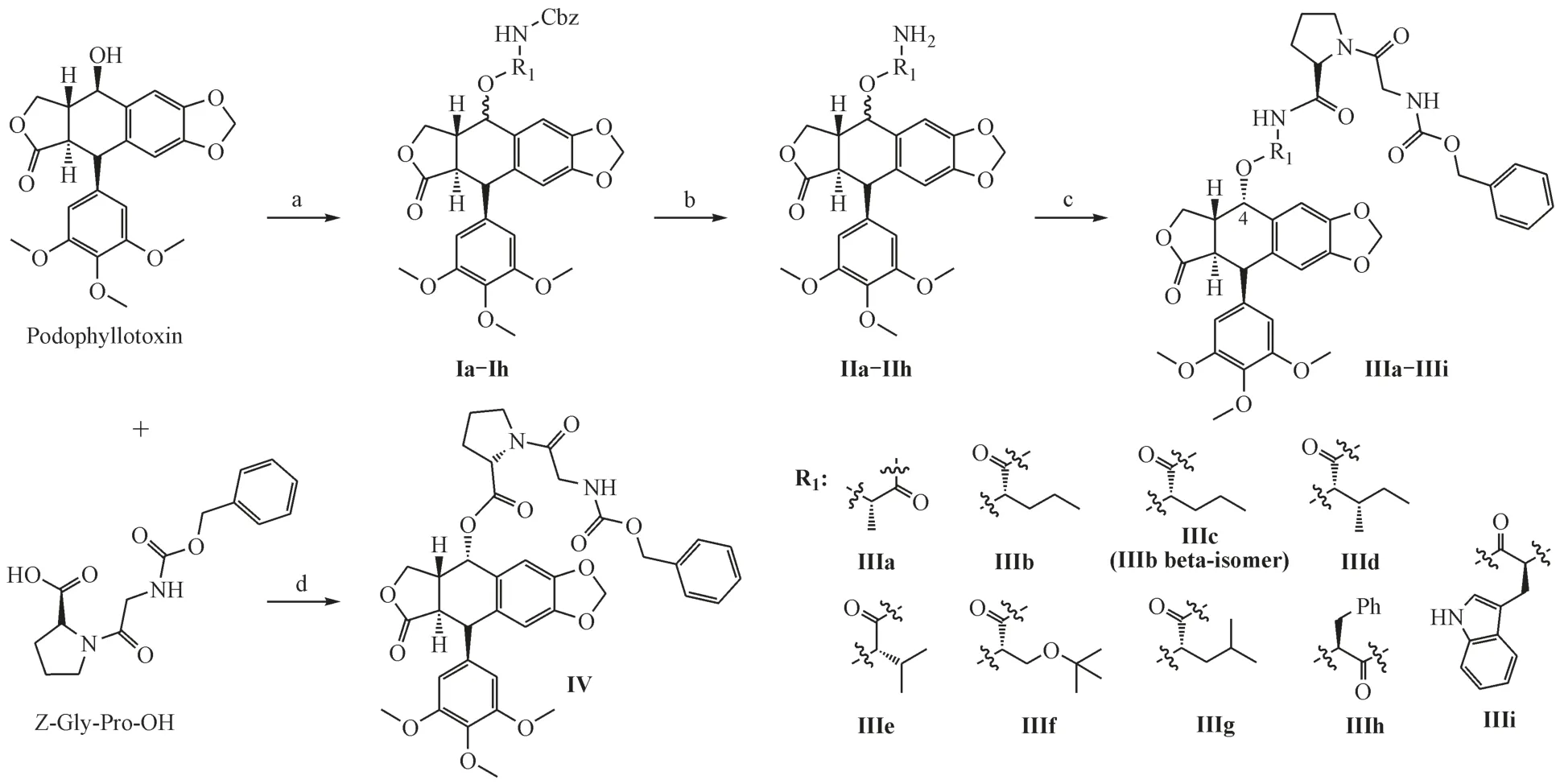
1 合成路线
合成路线如路线1所示。以鬼臼毒素为原料,通过与N-Cbz保护的不同氨基酸进行酯化反应,中间体Ⅰ脱除Cbz保护基得到中间体Ⅱ,最后与N-苄氧羰基甘氨酰-L-脯氨酸(Z-Gly-Pro-OH)进行酰胺化反应制得目标化合物Ⅲ。同时,鬼臼毒素与ZGly-Pro-OH 直接进行酯化反应得到目标化合物Ⅳ。
2 实验部分
2. 1 仪器和试剂
Avance NEO 400 MHz、600MHz 核磁共振仪(德国Bruker 公司,CDCl3为溶剂,TMS 为内标);LCMS-8045 三重四极杆液质联用仪(日本岛津公司);CKX41 倒置光学显微镜(日本奥林巴斯公司);ELx808酶标仪(美国BioTek公司);RE-2000B旋转蒸发仪(巩义瑞德仪器);DFY-10L/80 低温恒温反应浴(巩义予华仪器公司);MTT 试剂盒(上海碧云天公司);柱色谱硅胶(青岛海洋化工厂)。所有化学试剂均为市售化学纯或分析纯,未经纯化处理直接使用。
2. 2 化学合成
中间体Ⅰa 在50 mL 的反应管中,依次加入鬼臼毒素(0. 207 g,0. 5 mmol)、N-苄氧羰基-L-丙氨酸(0. 167 g,0. 75 mmol,1. 5 eq.)、DMAP(0. 183 g,1. 50 mmol,3. 0 eq.)、无水CH2Cl2(10 mL),搅拌溶解,N2保护下,0 ℃冷却搅拌30 min 后,再加入DCC(0. 155 g,0. 75 mmol,1. 5 eq.),自然升温到室温,薄层色谱(TLC)监测,约2 ~ 3 h 反应完全,加入乙酸乙酯(50 mL × 2)萃取,依次用饱和碳酸氢钠水溶液、饱和食盐水洗涤,减压浓缩溶剂,得无色油状物,产物未经纯化直接用于下一步反应。中间体Ⅰb ~ Ⅰh按照相同方法合成得到。
中间体Ⅱa 取上一步浓缩至干的油状化合物Ⅰa(0. 20 g,0. 287 mmol)于100 mL的茄形瓶,N2保护下,依次加入CH2Cl2(10 mL)、PdCl2(5. 0 mg,0. 29 mmol,0. 1 eq.)、三乙胺(0. 12 mL,0. 86 mmol,3. 0 eq.),搅拌溶解,室温下缓慢滴加三乙基硅烷(0. 14 mL,0. 86 mmol,3. 0 eq.)的CH2Cl2溶液(1 mL),薄层色谱(TLC)监测,约20 ~ 40 min反应完全,缓慢滴加三氟乙酸(0. 5 mL)终止反应,继续搅拌30 min,加入1 mol/L 的氢氧化钠水溶液调节pH 至8,硅藻土过滤,滤液用乙酸乙酯萃取(50 mL × 2),依次用饱和碳酸氢钠水溶液、饱和食盐水洗涤,减压浓缩溶剂,得浅黄色油状物,产物未经纯化直接用于下一步反应。中间体Ⅱb ~ Ⅱh按照相同方法合成得到。
Scheme 1 Synthetic route of FAPα-activated podophyllotoxin derivatives
化合物Ⅲa 参照中间体Ⅰa 的方法制备,在50 mL 的反应管中,依次加入中间体Ⅱa(0. 207 g,0. 5 mmol)、Z-Gly-Pro-OH(0. 75 mmol,1. 5 eq.)、DMAP(0. 183 g,1. 50 mmol,3. 0 eq.)、无水CH2Cl2(10 mL),搅拌溶解,N2保护下,0 ℃冷却搅拌30 min 后,再加入DCC(0. 155 g,0. 75 mmol,1. 5 eq.),自然升温到室温反应,薄层色谱(TLC)监测,约3 ~ 4 h 反应完全,加入乙酸乙酯(50 mL × 2)萃取,依次用饱和碳酸氢钠水溶液、饱和食盐水洗涤,减压浓缩溶剂,得粗产品,采用硅胶柱色谱分离纯化[洗脱剂:乙酸乙酯-石油醚(2∶1)],得白色固体,即目标化合物Ⅲa。目标化合物Ⅲb ~Ⅲi、Ⅳ按照相同方法合成得到。
化合物Ⅲa 白色固体,总收率38. 6%;mp 180 ~181 ℃;1H NMR(400 MHz,CDCl3)δ:7. 38 ~ 7. 30(7H,m,Ar-H × 5,NH × 2),6. 84(1H,s,Ar-H),6. 52(1H,s,Ar-H),6. 38(2H,s,-OCH2O-),5. 96(2H,d,J= 6. 9 Hz),5. 72(1H,s),5. 12(2H,s,Ar-CH2),4. 60(1H,d,J= 4. 3 Hz),4. 57(1H,d,J=7. 5 Hz),4. 51 ~ 4. 42(1H,m),4. 36(1H,dd,J=9. 0,7. 1 Hz),4. 24 ~ 4. 14(1H,m),4. 00(2H,d,J= 14. 7 Hz),3. 81(3H,s,-OCH3),3. 75(6H,s,-OCH3× 2),3. 66 ~ 3. 51(2H,m),3. 42(1H,dd,J=16. 7,8. 9 Hz),2. 86 ~ 2. 76(1H,m),2. 42 ~ 2. 32(1H,m),2. 18 ~ 2. 11(1H,m),2. 06 ~ 1. 98(1H,m),1. 96 ~ 1. 86(1H,m),1. 42(3H,d,J= 7. 2 Hz,CH3);13C NMR(151 MHz,CDCl3)δ:173. 6(C==O),173. 3(C==O),170. 8(C==O),168. 5(C==O),156. 3(C==O),152. 6(C × 2),148. 2,147. 6,137. 0,136. 2,134. 8,132. 1,128. 5(C × 2),128. 2,128. 1(C × 2),127. 8,109. 6,108. 1,108. 0,107. 2,101. 6(-OCH2O-),74. 4,71. 1,67. 0,60. 7(-OCH3),59. 9,56. 2(-OCH3),56. 1(-OCH3),48. 7,46. 5,45. 4,43. 6,43. 4,38. 5,29. 7,24. 9,17. 5(CH3);ESI-MS(m/z):796. 2[M + Na]+。
化合物Ⅲb 白色固体,总收率5. 8%;mp 104 ~105 ℃;1H NMR(400 MHz,CDCl3)δ:7. 39 ~ 7. 29(7H,m,Ar-H × 5,NH × 2),6. 87(1H,s,Ar-H),6. 53(1H,s,Ar-H),6. 38(2H,s,OCH2O),5. 97(2H,d,J= 6. 6 Hz),5. 69(1H,s),5. 12(2H,s,Ar-CH2),4. 61(1H,d,J= 4. 4 Hz),4. 44(1H,dd,J=13. 7,6. 5 Hz),4. 36(1H,dd,J= 9. 2,7. 1 Hz),4. 24 ~ 4. 12(2H,m),4. 05 ~ 3. 96(2H,m),3. 81(3H,s,OCH3),3. 75(6H,s,OCH3× 2),3. 60 ~ 3. 53(1H,m),3. 42(1H,dd,J= 16. 7,9. 2 Hz),2. 93(1H,dd,J= 14. 5,4. 5 Hz),2. 85 ~ 2. 74(1H,m),2. 45 ~ 2. 36(1H,m),2. 19 ~ 2. 10(1H,m),2. 05(1H,dd,J= 10. 0,6. 7 Hz),1. 92 ~ 1. 84(1H,m),1. 82 ~ 1. 74(1H,m),1. 40 ~ 1. 31(3H,m),0. 91(3H,t,J= 7. 3 Hz,CH3);13C NMR(151 MHz,CDCl3)δ:173. 6(C==O),173. 0(C==O),170. 8(C==O),168. 5(C==O),156. 3(C==O),152. 7(C × 2),148. 3,147. 7,137. 2,136. 3,134. 9,132. 2,128. 6(C × 2),128. 2,128. 1(C × 2),127. 9,109. 6,108. 1(C × 2),107. 3,101. 6,74. 4,71. 3,67. 1,60. 8(OCH3),60. 0 56. 2(OCH3× 2),52. 9,46. 5,45. 5,43. 7,43. 5,38. 6,33. 9,27. 2,24. 9,18. 9,13. 7(CH3);ESI-MS(m/z):824. 3[M + Na]+。
化合物Ⅲc(Ⅲb的C4β异构体) 白色固体,总收率28. 5%;mp 187 ~ 188 ℃;1H NMR(400 MHz,CDCl3)δ:7. 38 ~ 7. 30(6H,m,Ar-H × 2,NH),7. 20(1H,d,J= 6. 9 Hz,NH),6. 80(1H,s,Ar-H),6. 50(1H,s,Ar-H),6. 38(2H,d,J= 5. 1 Hz,OCH2O),5. 95(2H,d,J= 11. 2 Hz),5. 78(1H,d,J= 5. 4 Hz),5. 11(2H,d,J= 9. 5 Hz,Ar-CH2),4. 55(1H,d,J= 6. 9 Hz),4. 41(1H,dd,J= 9. 6,6. 7 Hz),4. 36(1H,d,J= 3. 8 Hz),4. 33 ~ 4. 27(2H,m),4. 04 ~3. 96(2H,m),3. 83(3H,s,OCH3),3. 80(6H,s,OCH3× 2),3. 58 ~ 3. 51(1H,m),3. 43 ~ 3. 37(1H,m),3. 24(1H,dd,J= 9. 2,3. 8 Hz),2. 92 ~ 2. 85(1H,m),2. 38 ~ 2. 31(1H,m),2. 15 ~ 2. 08(1H,m),2. 07 ~ 1. 97(1H,m),1. 91 ~ 1. 82(1H,m),1. 52 ~ 1. 43(1H,m),1. 28 ~ 1. 20(3H,m),0. 84(3H,t,J= 7. 3 Hz,CH3);13C NMR(151 MHz,CDCl3)δ:177. 1(C==O),172. 2(C==O),170. 7(C==O),168. 4(C==O),156. 3(C==O),153. 3(C × 2),148. 5,147. 3,138. 9,136. 9,136. 3,130. 9,128. 5(C × 2),128. 2,128. 1(C × 2),126. 0,109. 7,108. 0,105. 6(C × 2),101. 4(OCH2O),73. 0,70. 6,67. 0,60. 8(OCH3),60. 0,56. 2(OCH3× 2),52. 8,46. 4,45. 6,44. 0,43. 4,39. 7,33. 6,27. 3,24. 9,18. 8(CH2),13. 6(CH3);ESI-MS(m/z):824. 2[M +Na]+。
化合物Ⅲd 白色固体,收率23. 8%;mp 114 ~115 ℃;1H NMR(400 MHz,CDCl3)δ:7. 44(1H,d,J= 7. 1 Hz,NH),7. 38 ~ 7. 32(5H,m,Ar-H),7. 31(1H,d,J= 4. 7 Hz,NH),6. 89(1H,s,Ar-H),6. 52(1H,s,Ar-H),6. 38(2H,s,OCH2O),5. 97(2H,d,J= 9. 5 Hz,Ar-H),5. 92(1H,d,J= 9. 3 Hz),5. 12(2H,s,Ar-CH2),4. 62(1H,d,J= 7. 2 Hz),4. 60(1H,d,J= 4. 1 Hz),4. 47(1H,d,J= 8. 0 Hz),4. 35(1H,dd,J= 13. 9,6. 4 Hz),4. 21(1H,t,J= 9. 9 Hz),4. 03(2H,s),3. 81(3H,s,OCH3),3. 77(1H,s),3. 74(6H,s,OCH3× 2),3. 56(1H,t,J= 7. 7 Hz),3. 42(1H,dd,J= 16. 6,9. 1 Hz),2. 92(1H,dt,J= 13. 2,6. 6 Hz),2. 84 ~ 2. 74(1H,m),2. 46 ~2. 37(1H,m),2. 33 ~ 1. 99(2H,m),1. 93 ~ 1. 82(1H,m),1. 76 ~ 1. 53(2H,m),0. 90(6H,m,CH3×2);13C NMR(151 MHz,CDCl3)δ:173. 5(C==O),172. 2(C==O),170. 8(C==O),168. 6(C==O),156. 3(C==O),152. 7(C × 2),148. 3,147. 7,137. 2,136. 3,134. 9,132. 2,128. 6(C × 2),128. 2,128. 1(C × 2),127. 9,109. 6,108. 1(C × 2),107. 4,101. 6(OCH2O),74. 5,71. 4,67. 1,60. 8(OCH3),60. 0,57. 3,56. 1(OCH3× 2),46. 5,45. 6,43. 7,43. 5,38. 7,37. 3,27. 0,25. 6,25. 0,15. 6(CH3),11. 6(CH3);ESI-MS(m/z):838. 1[M + Na]+。
化合物Ⅲe 白色固体,总收率24. 2%;mp 100 ~ 101 ℃;1H NMR(400 MHz,CDCl3)δ:7. 46(1H,d,J= 7. 3 Hz,NH),7. 38 ~ 7. 30(5H,m,Ar-H),6. 88(1H,s,Ar-H),6. 52(1H,s,Ar-H),6. 38(2H,s,OCH2O),5. 97(2H,d,J= 8. 8 Hz,Ar-H),5. 92(1H,d,J= 9. 2 Hz),5. 11(2H,d,J= 8. 6 Hz,Ar-CH2),4. 63(1H,d,J= 7. 6 Hz),4. 60(1H,d,J=4. 6 Hz),4. 43 ~ 4. 31(2H,m),4. 20(1H,dd,J=16. 7,7. 0 Hz),4. 09 ~ 3. 98(2H,m),3. 81(3H,s,OCH3),3. 74(6H,s,OCH3× 2),3. 62 ~ 3. 51(1H,m),3. 42(1H,dd,J= 16. 8,9. 3 Hz),2. 92(1H,dt,J= 14. 1,7. 1 Hz),2. 86 ~ 2. 73(1H,m),2. 48 ~2. 39(1H,m),2. 22 ~ 2. 01(3H,m),1. 94 ~ 1. 82(1H,m),0. 94(3H,d,J= 4. 6 Hz,CH3),0. 92(3H,d,J= 4. 5 Hz,CH3);13C NMR(151 MHz,CDCl3)δ:173. 6(C==O),172. 4(C==O),171. 0(C==O),168. 7(C==O),156. 4(C==O),152. 8(C × 2),148. 4,147. 8,137. 3,136. 4,134. 9,132. 3,128. 7(C × 2),128. 4,128. 2(C × 2),127. 9,109. 7,108. 2(C × 2),107. 5,101. 8(OCH2O),74. 6,71. 5,67. 2,60. 9(OCH3),60. 1,58. 2,56. 3(OCH3× 2),46. 6,45. 7,43. 8,43. 6,38. 8,30. 8,27. 1,25. 1,19. 2(CH3),18. 3(CH3);ESI-MS(m/z):824. 2[M + Na]+。
化合物Ⅲf 白色固体,总收率21. 7%;mp 96 ~97 ℃;1H NMR(400 MHz,CDCl3)δ:7. 43 1H,(d,J= 7. 7 Hz,NH),7. 36 ~ 7. 29(6H,m,Ar-H,NH),6. 89(1H,s,Ar-H),6. 51(1H,s,Ar-H),6. 38(2H,s,OCH2O),5. 96(2H,d,J= 7. 2 Hz),5. 92(1H,d,J=5. 0 Hz),5. 11(2H,s,Ar-CH2),4. 61(1H,d,J= 4. 5 Hz),4. 58(1H,d,J= 6. 4 Hz),4. 39(1H,dd,J=9. 2,7. 1 Hz),4. 24 ~ 4. 14(2H,m),3. 82 ~ 3. 78(2H,m),3. 79(3H,s,OCH3),3. 75(6H,s,OCH3×2),3. 64 ~ 3. 52(3H,m),3. 46 ~ 3. 37(1H,m),2. 97 ~ 2. 88(1H,m),2. 85 ~ 2. 72(1H,m),2. 44 ~2. 24(1H,m),2. 03(1H,m),1. 98 ~ 1. 88(2H,m),1. 08(s,9H,CH3);13C NMR(151 MHz,CDCl3)δ:173. 7(C==O),171. 0(C==O),170. 8(C==O),168. 0(C==O),156. 2(C==O),152. 6(C × 2),148. 2,147. 6,137. 1,136. 2,134. 9,132. 1,128. 5(C × 2),128. 2,128. 0(C × 2),127. 7,109. 6,108. 0(C × 2),107. 3,101. 6(OCH2O),74. 6,73. 7,71. 3,67. 0,62. 2,60. 7(OCH3),60. 0,56. 1(OCH3× 2),49. 8,46. 3,45. 4,43. 6,43. 4,38. 8,28. 1,27. 2(CH3× 3),24. 8;ESI-MS(m/z):868. 3[M + Na]+。
化合物Ⅲg 白色固体,总收率35. 9%;mp 134 ~ 135 ℃;1H NMR(400 MHz,CDCl3)δ:7. 63(1H,d,J= 6. 1 Hz,NH),7. 43(1H,d,J= 7. 5 Hz,NH),7. 40 ~ 7. 30(5H,m),6. 90(1H,s,Ar-H),6. 53(1H,s,Ar-H),6. 39(2H,s,OCH2O),5. 97(2H,d,J= 5. 0 Hz,Ar-H),5. 93(1H,d,J= 9. 3 Hz),5. 12(2H,s,Ar-CH2),4. 66(1H,d,J= 4. 7 Hz),4. 44(1H,d,J= 6. 6 Hz),4. 39 ~ 4. 32(1H,m),4. 23 ~ 4. 12(2H,m),4. 10 ~ 3. 92(2H,m),3. 81(3H,s,OCH3),3. 75(6H,s,OCH3× 2),3. 68 ~3. 36(3H,m),2. 97 ~ 2. 76(1H,m),2. 44 ~ 2. 23(1H,m),2. 15 ~ 1. 81(5H,m),1. 42 ~ 1. 25(1H,m),1. 00 ~ 0. 85(6H,m,CH3× 2);13C NMR(151 MHz,CDCl3)δ:173. 6(C==O),171. 0(C==O),168. 5(C==O),167. 3(C==O),156. 1(C==O),152. 6(C × 2),148. 2,147. 7,137. 1,136. 3,134. 9,132. 1,128. 5(C × 2),128. 2,128. 1(C × 2),127. 9,109. 5,108. 0(C × 2),107. 3,101. 6,74. 3,71. 2,67. 0,60. 7(OCH3),59. 2,56. 1(OCH3× 2),51. 7,46. 8,45. 5,43. 7,43. 4,40. 6,33. 9,27. 2,25. 3,24. 9,22. 6,21. 9;ESI-MS(m/z):838. 3[M + Na]+。
化合物Ⅲh 白色固体,收率25. 8%;mp 206 ~207 ℃;1H NMR(400 MHz,CDCl3)δ:7. 54(1H,d,J= 7. 0 Hz,NH),7. 43(1H,d,J= 8. 6 Hz,NH)),7. 41 ~ 7. 31(5H,m,Ar-H),7. 24 ~ 7. 17(3H,m,Ar-H),7. 11(1H,s),7. 09(1H,s),6. 54(1H,s,Ar-H),6. 49(1H,s,Ar-H),6. 36(2H,s,OCH2O),5. 94(1H,s),5. 89(1H,s),5. 81(1H,d,J= 9. 4 Hz),5. 14(2H,d,J= 4. 0 Hz,Ar-CH2),4. 58(1H,d,J= 4. 5 Hz),4. 55(1H,d,J= 7. 2 Hz),4. 16 ~ 4. 07(2H,m),3. 99(1H,d,J= 4. 8 Hz),3. 86(1H,d,J= 3. 9 Hz),3. 81(3H,s,OCH3),3. 74(6H,s,OCH3× 2),3. 58(1H,dd,J= 8. 3,5. 8 Hz),3. 53 ~ 3. 39(3H,m),3. 20 ~ 3. 15(1H,m),2. 89(1H,dd,J= 14. 5,4. 6 Hz),2. 71 ~ 2. 61(1H,m),2. 47 ~ 2. 33(1H,m),2. 07 ~ 1. 89(3H,m);13C NMR(151 MHz,CDCl3)δ:173. 6(C==O),171. 9(C==O),170. 4(C==O),168. 4(C==O),156. 2(C==O),152. 6(C × 2),148. 2,147. 5,136. 2,135. 5,134. 9,132. 1,129. 1(C × 2),128. 7,128. 6(C × 2),128. 5(C × 2),128. 4,128. 2,128. 1,127. 5(C × 2),109. 5,108. 0(C × 2),107. 3,101. 6(OCH2O),74. 8,71. 3,67. 1,60. 7(OCH3),59. 8,56. 2(OCH3× 2),53. 8,46. 3,45. 5,43. 6,43. 4,38. 4,33. 9,28. 1,24. 9;ESI-MS(m/z):872. 1[M + Na]+。
化合物Ⅲi 白色固体,总收率26. 3%;mp 124 ~ 125 ℃;1H NMR(400 MHz,CDCl3)δ:7. 52(1H,t,J= 6. 1 Hz,NH),7. 47(1H,d,J= 5. 7 Hz,NH),7. 45-7. 41(1H,m),7. 40 ~ 7. 31(9H,m,Ar-H),7. 11(1H,t,J= 7. 6 Hz),6. 93(1H,t,J= 7. 5 Hz),6. 55(1H,s),6. 49(1H,s),6. 38(2H,s,OCH2O),5. 78(1H,d,J= 9. 4 Hz),5. 14(1H,d,J=7. 2 Hz,Ar-CH),5. 11(1H,d,J= 4. 8 Hz,Ar-CH),4. 56(1H,d,J= 4. 3 Hz),4. 52(1H,d,J= 7. 6 Hz),4. 43 ~ 4. 28(1H,m),4. 22 ~ 4. 15(1H,m),4. 02(2H,t,J= 7. 9 Hz),3. 89(1H,d,J= 7. 5 Hz),3. 81(3H,s,OCH3),3. 75(6H,s,OCH3× 2),3. 60 ~ 3. 53(1H,m),3. 51 ~ 3. 39(1H,m),3. 37 ~ 3. 32(1H,m),3. 25(2H,dd,J= 14. 4,6. 5 Hz),2. 94 ~ 2. 81(1H,m),2. 31 ~ 2. 24(1H,m),2. 18 ~ 1. 87(3H,m);13C NMR(151 MHz,CDCl3)δ:173. 7(C==O),172. 4(C==O),170. 9(C==O),168. 4(C==O),156. 8(C==O),152. 6(C × 2),148. 3,147. 5,136. 3,136. 2,135. 0,134. 8,132. 1,128. 7(C × 2),128. 5,128. 1,128. 0(C × 2),127. 9,123. 2,122. 4,119. 5,118. 2,111. 5,109. 5,109. 1,108. 2,108. 0,107. 3,101. 6(OCH2O),74. 6,71. 2,67. 6,60. 8(OCH3),59. 9,56. 3(OCH3× 2),53. 5,46. 2,45. 5,43. 6,43. 4,38. 4,30. 7,29. 7,24. 8;ESI-MS(m/z):889. 4[M + H]+。
化合物Ⅳ白色固体,收率56. 2%;mp 176 ~177 ℃;1H NMR(400 MHz,CDCl3)δ:7. 41 ~ 7. 29(5H,m,Ar-H),6. 97(1H,s,Ar-H),6. 52(1H,s,Ar-H),6. 39(2H,s,OCH2O),5. 98(1H,s,Ar-H),5. 97(1H,d,J= 1. 0 Hz,Ar-H),5. 11(2H,s,Ar-CH2),4. 60(1H,d,J= 4. 3 Hz),4. 54(1H,d,J= 8. 3 Hz),4. 34(1H,t,J= 8. 0 Hz),4. 17(1H,dd,J= 12. 8,6. 7 Hz),4. 13 ~ 4. 05(1H,m),3. 97(2H,dd,J=17. 1,4. 2 Hz),3. 80(3H,s,OCH3),3. 75(6H,s,OCH3× 2),3. 65 ~ 3. 50(3H,m),2. 96 ~ 2. 74(1H,m),2. 71 ~ 2. 62(1H,m),2. 54 ~ 2. 44(1H,m),2. 33 ~ 2. 21(1H,m),2. 18 ~ 1. 91(1H,m);13C NMR(151 MHz,CDCl3)δ:173. 6(C==O),172. 6(C==O),167. 2(C==O),156. 3(C==O),152. 6(C ×2),148. 2,147. 8,137. 3,136. 3,134. 9,132. 1,128. 5(C × 2),128. 1(C × 3),128. 0,109. 6,108. 3(C × 2),107. 2,101. 6(OCH2O),74. 4,71. 1,67. 0,60. 8(OCH3),59. 2,56. 3(OCH3× 2),46. 1,45. 4,43. 7,43. 4,38. 5,29. 2,25. 0;ESI-MS(m/z):702. 3[M]+。
2. 3 抗肿瘤活性测试
以鬼臼毒素(podophyllotoxin)和临床使用的抗肿瘤药物依托泊苷为阳性对照,目标化合物设置3. 125,6. 25,12. 5,25,50,100 μmol/L 6 个浓度,按文献[12]的MTT 法测试对人肝癌细胞HepG2、人髓系白血病单核细胞THP-1、人宫颈癌细胞HeLa、人乳腺癌细胞MCF-7的体外抗细胞增殖活性。
2. 4 分子对接模拟分析
采用ChemBio3D Ultra 14. 0绘制目标化合物结构并进行能量最小化,设置Minimum RMS Gradient为0. 001,保存为mol2 格式。将优化的目标化合物导入AutodockTools1. 5. 6 进行加氢、计算并分配电荷、设置可旋转键后保存为“pdbqt”格式。从PDB 数据库下载FAPα 蛋白(PDB ID:1Z68),使用PyMoL(2. 3. 0)去除水分子,将蛋白导入AutoDock⁃tools1. 5. 6 进行加氢、计算并分配电荷、指定原子类型并保存为“pdbqt”格式。 采用Autodock Vina1. 1. 2 进行对接,参数设置为:中心坐标(cen⁃ter_x=38. 033,center_y=0. 39,center_z=69. 392);格点盒子大小设定为126 × 126 × 126(格点间距为0. 375 Å),其余参数为默认。利用PyMOL 2. 3. 0对结果进行相互作用分析。
3 结果与讨论
3. 1 化合物的合成
在合成中间体Ⅰ时,尝试了N-叔丁氧羰基(Boc)、N-芴甲氧羰基(Fmoc)保护的氨基酸与鬼臼毒素反应,但所得产物在进行脱Boc 或脱Fmoc 时,无法将Boc 或Fmoc 彻底脱除,产物经MS 确认也不是所需中间体Ⅱ,最终选择苄氧羰基(Cbz)保护的氨基酸作为原料,通过两步反应成功制备了中间体Ⅱ。同时,在TLC 跟踪第一步反应进度时,发现除原料与缩合剂外有2 个新的斑点生成,且这2 个新斑点在后续进行第二步和第三步反应时分别转为新产物而消失,由此我们断定这2个斑点为目标中间体Ⅰ的α和β两种异构体。在进行脱Boc或脱Fmoc制备中间体Ⅱ时,采用三乙基硅烷作为氢源、氯化钯催化的条件下,在20 ~ 40 min 的时间内得到中间体Ⅱ,且该条件所需试剂相比钯碳-氢气的条件更便捷、更安全。在合成目标产物Ⅲ时,用TLC 检测目标产物存在α和β两种异构化产物,但由于β构型产物的量较少,在通过硅胶柱色谱分离时只获得以正缬氨酸为连接臂的Ⅲb和Ⅲc两种异构体,以其他氨基酸为连接臂的β构型产物很遗憾都未通过分离获得,仅获得了它们的α构型产物。
3. 2 化合物的表征
在目标化合物Ⅲa ~ Ⅲi 和Ⅳ的1H NMR 中,δH7. 63 ~ 7. 29 处的多重峰为苯环上的H 和两个CONH 上的H 信号,δH6. 38 附近的单峰为鬼臼毒素亚甲二氧基(-OCH2O-)信号,δH5. 12附近的单峰为Z-Gly-Pro-OH 中苄基结构的-CH2-信号,δH3. 81和δH3. 75 为鬼臼毒素结构中的3 个-OCH3信号。在目标化合物Ⅲa ~ Ⅲi 和Ⅳ的13C NMR 中,δC173. 6,173. 3,170. 8,168. 5,156. 3等附近的C信号为目标化合物的多个C==O 信号,δC101. 6 附近的C 信号为亚甲二氧基,δC60. 8、56. 2 附近的C 信号为3个-OCH3。
为进一步确定目标化合物的C4位置的构型,本研究使用400 MHz 核磁共振仪采集了鬼臼毒素的1H NMR 数据,再通过对比文献[13]的鬼臼毒素数据,确定鬼臼毒素δH4. 63 具有7. 1 Hz 的H 信号为鬼臼毒素C4-H 信号。随后,对比鬼臼毒素与化合物Ⅲb、Ⅲc 的核磁数据可确认化合物Ⅲb 在δH4. 61 的H 信号与化合物Ⅲc 在δH4. 55 的H 信号为C4-H 的信号,再对比它们的耦合常数大小,化合物Ⅲb 在δH4. 61 信号的耦合常数为4. 4 Hz,化合物Ⅲc 在δH4. 55 信号的耦合常数为6. 9 Hz。由此可见,化合物Ⅲc的耦合常数与鬼臼毒素C4-H信号的耦合常数更接近。因此,确认化合物Ⅲc为C-4β构型产物,而化合物Ⅲb为C-4α构型产物。并且根据化合物Ⅲb、Ⅲc在经过硅胶柱色谱分离后的质量,二者的比例约为5∶1。采用相同方式,化合物Ⅲa、Ⅲd ~ Ⅲi、Ⅳ在δH4. 60 附近H 信号的耦合常数均在4. 5 Hz 左右,故判断化合物Ⅲa、Ⅲd ~ Ⅲi、Ⅳ为C-4α构型产物。
3. 3 抗肿瘤活性及构效关系
由表1结果可知,目标化合物Ⅲa ~ Ⅲi和Ⅳ对HepG2、THP-1、HeLa、MCF-7 肿瘤细胞株都有不同程度的抑制作用,且大部分目标化合物对4 种肿瘤细胞的抑制作用优于依托泊苷。其中,化合物Ⅲa ~ Ⅲc、Ⅲe ~ Ⅲi、Ⅳ对HepG2 细胞的抑制作用强于依托泊苷,并且化合物Ⅲa和Ⅳ对HepG2细胞的抑制作用还强于鬼臼毒素。所有目标化合物对THP-1 细胞的抑制作用均强于依托泊苷,并且化合物Ⅲa、Ⅲd、Ⅲe、Ⅲi、Ⅳ对THP-1 细胞的抑制作用还强于鬼臼毒素。化合物Ⅲa ~ Ⅲe、Ⅲi、Ⅳ对HeLa 细胞的抑制作用强于依托泊苷和鬼臼毒素。化合物Ⅲa、Ⅲb、Ⅲi、Ⅳ对MCF-7 细胞的抑制作用强于依托泊苷和鬼臼毒素。化合物Ⅲh 对HepG2、THP-1、HeLa 细胞的作用优于依托泊苷,但不及鬼臼毒素。在这些目标化合物中,化合物Ⅲa 对HepG2 细胞的抑制作用最强,IC50为0. 58 nmol/L,对THP-1、HeLa、MCF-7 细胞的作用强度也约为依托泊苷的167、206和23倍。
Table 1 Anti-tumor activity of compounds Ⅲa-Ⅲi and Ⅳ(±s,n = 3 )

Table 1 Anti-tumor activity of compounds Ⅲa-Ⅲi and Ⅳ(±s,n = 3 )
Compd.ⅢaⅢbⅢcⅢdⅢeⅢfⅢgⅢhⅢiⅣPodophyllotoxin Etoposide IC50/(μmol/L)HepG2 0.58 × 10-3 ± 0.46 1.14 ± 0.37 2.43 ± 0.94>40 1.69 ± 0.76 6.84 ± 0.72 2.22 ± 0.86 12.89 ± 1.59 1.29 ± 0.89 0.11 ± 0.62 0.79 ± 1.39 17.75 ± 0.68 THP-1 0.10 ± 1.82 2.69 ± 0.43 2.34 ± 1.03 0.41 ± 0.78 0.41 ± 2.28 12.12 ± 1.32 1.36 ± 1.19 4.56 ± 0.48 0.56 ± 1.60 0.25 ± 0.79 0.95 ± 0.95 16.76 ± 1.33 HeLa 0.57 ± 0.57 3.89 ± 0.47 3.17 ± 1.02>40 3.02 ± 0.44>40>40>40 3.68 ± 1.32 6.08 ± 0.53>40>40 MCF-7 1.42 ± 1.03 3.79 ± 0.29 8.38 ± 0.89 13.32 ± 1.17 7.15 ± 0.92>40 28.15 ± 1.21>40 5.38 ± 0.85 2.57 ± 1.05 6.26 ± 1.13 32.88 ± 1.05
初步构效关系分析发现:当作为连接臂的氨基酸具有更小空间体积时,目标产物对HepG2、THP-1、HeLa、MCF-7 细胞具有更好的抑制作用。随着氨基酸空间结构增大,形成的目标产物对4种细胞的抑制作用多有减弱趋势,如化合物Ⅲd、Ⅲf、Ⅲg、Ⅲh 等,尤其是化合物Ⅲf 和Ⅲg,对HeLa细胞的抑制作用相比化合物Ⅲa 大大降低。鬼臼毒素与Z-Gly-Pro-OH 通过酯化反应直接得到的化合物Ⅳ,对HepG2、THP-1、HeLa、MCF-7 细胞显示出良好的活性,也进一步体现了连接臂所占空间较小时有利于发挥抗肿瘤作用。
鉴于Z-Gly-Pro-OH 能激活FAPα 酶,为进一步探索合成衍生物与FAPα 酶是否具有相互作用,采用分子对接模拟分析了化合物Ⅲa与FAPα酶的结合作用(路线2),发现化合物Ⅲa 与FAPα 酶的Tyr458(A)、Ala459(A)、Arg402(A)、Thr297(A)、Leu296(A)、Trp298(A)残基能形成氢键,其氢键长度分别为3. 22、3. 74 Å、3. 52 Å、2. 88 Å、3. 20 Å、3. 72 Å、3. 33 Å、3. 77 Å、3. 09 Å;化合物Ⅲa 与FAPα 酶的与Asp457(A)、Pro216(A)、Trp214(A)、Trp213(A)、Phe357(A)、Pro355(A)、Val403(A)、Val356(A)、Val299(A)具有疏水作用。从这些结合位点可看出,鬼臼毒素和Z-Gly-Pro-OH 结构均可与FAPα 酶产生结合位点,偶联的氨基酸结构几乎没有产生结合位点,这也揭示鬼臼毒素和Z-Gly-Pro-OH 进行拼接合成时,连接臂结构过大可能不利于目标分子作用于FAPα 酶发挥抗肿瘤作用。而本研究合成的新型衍生物是否通过作用于FAPα 酶从而发挥抗肿瘤作用,FAPα 酶在本文研究的细胞株中是否也具有高表达,均将通过后期研究进行验证。如合成化合物对FAPα 低表达细胞都具有显著抑制作用,则可为研究人员提供新的研究出发点。

Scheme 2 Molecular docking of compound Ⅲa and FAPα enzyme
4 结 论
以天然来源化合物鬼臼毒素为原料,结合前期虚拟筛选结果,首次合成了10 个新型的鬼臼毒素衍生物,体外抗肿瘤活性筛选结果表明,大部分目标化合物对HepG2、THP-1、HeLa、MCF-7 肿瘤细胞的抑制作用优于依托泊苷和鬼臼毒素,尤以化合物Ⅲa对HepG2细胞的抑制作用最为显著,值得进一步深入研究。

