桑叶多糖对免疫抑制小鼠肠道损伤和微生物多样性的调节作用
陈晓兰 宣嘉颖 王 婧 冒玉娟 徐向萍 杨海峰
(江苏农牧科技职业学院,泰州225300)
在畜禽养殖中,非洲猪瘟、猪蓝耳病、猪圆环病毒病、禽流感等诸多免疫抑制性疾病对动物健康造成了巨大的影响。这些免疫抑制性病毒不仅侵袭动物的免疫器官,而且对动物的肠道、呼吸道均造成一定程度的损害。肠道作为机体最大的黏膜屏障,在抗感染免疫中发挥重要作用[1]。因此,提高肠道黏膜屏障和免疫功能,尤其是调节免疫抑制状态下肠道健康,对于免疫抑制性疾病的防控具有重要意义。动物和人类胃肠道黏膜表面居住着数万亿共生微生物,其对宿主健康有着深远的影响[2]。肠道菌群生态系统可增强宿主防御机制,如增强黏膜屏障功能,参与免疫系统的发育与调节[3]。由内源性或环境等因素引起的肠道微生物群落紊乱会对局部和系统免疫造成影响,进而引发各种疾病。迄今为止,许多植物多糖,如香菇多糖[4]和紫甘薯多糖[5]已被证明可以调节肠道免疫和肠道微生物群落的组成。
桑叶为常用的中草药之一,富含多糖、黄酮、生物碱等活性物质,具有抗糖尿病、抗炎、调节机体免疫能力以及抗氧化等多种药理作用[6]。研究表明,桑叶多糖(mulberry leaf polysaccharide,MLP)可有效调节免疫新城疫疫苗雏鸡体液免疫和细胞免疫应答[7],随后发现MLP可显著增强鸡呼吸道黏膜免疫应答[8]。MLP是否调节肠道黏膜免疫、影响肠道微生物群落组成有待进一步研究。鉴于此,本研究采用腹腔注射环磷酰胺(cyclophosphamide,CTX)作为建模手段,评价在免疫抑制状态下MLP对小鼠肠道损伤的修复功能和肠道微生物菌群紊乱的调节作用。
1 材料与方法
1.1 药物与主要试剂
左旋咪唑(levamisole,LM)和CTX购自美国Sigma公司,MLP(纯度95%)为本实验室制备[8]。
组织固定液、DNA试剂盒购自北京索莱宝科技有限公司,RNAiso Plus(Code No. 9109)、TB Green Premix Ex TaqTMⅠ(Code No. RR820A)和PrimeScript RT Master Mix(Code No. 0360A)购自日本TaKaRa公司,MiSeq Reagent Kit v3购自美国Illumina公司,Agencourt AM Pure XP PCR Purification Beads购自美国Beckman Coulter公司,无水乙醇、氯仿和异丙醇等其他所有分析纯试剂购自国药集团上海化学试剂有限公司。
1.2 试验仪器
试验仪器包括高速冷冻离心机(德国Eppendorf公司)、PCR仪(德国Eppendorf公司)、荧光定量PCR仪(美国ABI公司)、制冰机(日本SANYO公司)、移液器(10、100、200、1 000 μL)(德国Eppendorf公司)、超净工作台(江苏苏净集团有限公司)、NanoDrop 2000(美国Thermo Fisher Scientifi公司)、Invitrogen Qubit3.0 Spectrophotometer(美国Thermo Fisher Scientific公司)、Agilent 2100 Bioanalyzer(美国Agilent Technologies公司)、Illumina MiSeq Benchtop Sequencer(美国Illumina公司)、ABI 2720 Thermal Cycler(美国Thermo Fisher Scientific公司)、Eppendorf 5810R Centrifuge(德国Eppendorf公司)、NanoDropTMOne/OneC微量紫外-可见光分光光度计(上海凌仪生物科技有限公司)。
1.3 试验动物
雄性BALB/c小鼠,购自南京青龙山动物养殖中心,5周龄,体重(20.0±0.5) g,共计60只,饲养于12 h明/12 h暗的屏障环境中,自由采食和饮水。严格依据江苏农牧科技职业学院动物伦理委员会规定的要求进行饲养管理和动物试验。
1.4 试验设计
小鼠适应7 d后将其随机分为正常对照组(NC组)、环磷酰胺模型组(MC组)、桑叶多糖低剂量组(MLPL组)、桑叶多糖中剂量组(MLPM组)、桑叶多糖高剂量组(MLPH组)和药物对照组(LM组),每组10只小鼠。各组小鼠腹腔注射80 mg/kg BW CTX(除NC组外),每天1次,连续3 d,以诱导免疫抑制。第4天开始MLPL、MLPM、MLPH和LM组小鼠每天分别灌胃20、40、80 mg/kg BW的MLP和40 mg/kg BW的LM,连续给药9 d;NC和MC组小鼠每天灌胃等量饮用水。在试验过程中,每3 d称量体重1次,并于停药后(第13天)采用乙醚麻醉小鼠,实施颈椎脱臼法处死,进行样品采集。
1.5 指标测定
1.5.1 增重
分别于注射CTX前以及注射CTX后第4、7、10、13天对所有小鼠进行称重,计算各组小鼠增重。
1.5.2 小鼠空肠组织形态学
小心剪取各组小鼠(每组3只)约5 cm长的空肠,用磷酸盐缓冲液(PBS)稍作清洗后,10%中性甲醛溶液固定48 h,用镊子去除空肠表面残留的脂肪,剪取1 cm肠段浸泡于乙醇-福尔马林(AF)固定液约30 min,经不同浓度乙醇溶液脱水后,开始浸蜡和组织包埋。制成4 μm厚度的切片,再经烤片、脱蜡后过不同浓度乙醇溶液,后用超纯水浸泡后进行苏木精-伊红(HE)染色,再经过脱水封片后,使用倒置光学显微镜在100倍视野下观察空肠组织病理学变化。
1.5.3 小鼠结肠黏膜屏障蛋白和免疫相关基因mRNA表达
取各组小鼠(每组3只)结肠组织样本,采用定量逆转录PCR(quantitative reverse transcription PCR,RT-qPCR)法分别对上皮细胞紧密连接蛋白[闭合蛋白(Occludin)、闭锁小带蛋白-1(ZO-1)、封闭蛋白-5(Claudin-5)]、黏液素2(MUC2)、免疫相关因子[肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-10(interleukin-10,IL-10)、转化生长因子-β(transforming growth factor-β,TGF-β)]和免疫信号通路相关蛋白[Toll样受体4(Toll-like receptor 4,TLR4)、髓样分化因子88(myeloid differentiation protein 88,MyD88)、核因子-κB p65亚基(p65)]的mRNA表达进行测定,使用StepOnePlus Real-Time PCR系统进行RT-qPCR分析。
1.5.3.1 RNA的提取及浓度和纯度测定
称取20~50 mg结肠样品,充分剪碎,加入液氮和氧化锆研磨珠,充分匀浆至无明显组织块。然后参照RNAiso Plus操作说明提取总RNA,用NanoDrop 2000检测其浓度和纯度,符合要求后于-80 ℃保存备用。
1.5.3.2 逆转录合成cDNA
使用反转录试剂PrimeScript RT Master Mix将RNA反转录为cDNA,作为RT-qPCR模板,配制体系和反应条件参照试剂盒说明书。
1.5.3.3 RT-qPCR扩增
以β-肌动蛋白(β-actin)为内参基因,测定靶基因的相对表达量,由生工生物工程(上海)股份有限公司合成,用于小鼠基因转录分析的基因特异性引物序列见表1。使用TB Green Premix Ex Taq Ⅱ进行RT-qPCR检测,配制体系参照说明书进行。加样结束后离心排除气泡,再放置到荧光定量PCR仪中进行反应,反应结束后,采用2-△△Ct法计算靶基因的mRNA相对表达量。

表1 用于小鼠基因转录分析的基因特异性引物序列

续表1基因Genes登录号Accession number引物序列Primer sequences (5'—3')产物大小Product size/bpToll样受体4TLR4NM_021297.3F: GCTCTCAGCCATCCACAAAGR: GAGTCGGGAAGAGGAAGAGG68髓样分化因子88MyD88NM_010851.3F: TTTCCCAGTATCCTGCGGTTR: GCGGAAGAACACAGACAGAC151闭合蛋白OccludinU49185.1F: AGCACTTAACCTGCCTGGATR: AGCCTGTGGAAGCAAGAGAT191封闭蛋白-5Claudin-5NM_013805.4F: TTCTTCTATGCGCAGTTGGCR: TTGGTGCCTACTTCACCGAT68黏液素2MUC2JN961199.1F: GCTCTCAAATGGTGCAGAGGR: AGTGGGAAGGGATGAATGGG105锁小带蛋白-1ZO-1XM_036152895.1F: ACTCCCACTTCCCCAAAAACR: CCACAGCTGAAGGACTCACA166核因子-κB p65亚基p65NM_001365067F: GGATTCCGGGCAGTGACGR: CACGGCGCGCTAAAGTAAAG81
1.5.4 盲肠微生物群落
采用微生物扩增子测序法测定盲肠微生物群落。将采集的盲肠内容物解冻后,用DNA试剂盒提取基因组DNA,之后检测扩增样本目的区域(V4~V5区域),阳性对照选择标准细菌基因组DNA Mix。盲肠内容物样本的测序和生物信息学研究在上海天昊生物科技有限公司测定。采用R软件包(V3.4.0,https://www.r-project.org/)根据操作分类单元(operational taxonomic units,OTUs)的丰度进行不同物种筛选,比较MLP对免疫抑制小鼠盲肠微生物多样性的影响。
1.6 统计分析
数据采用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,数据采用平均值±标准误(SE)表示,P<0.05为差异显著。
2 结果与分析
2.1 MLP对免疫抑制小鼠体重的影响
如表2所示,小鼠注射CTX后第4天,与NC组相比,其他各组小鼠体重显著下降(P<0.05),呈负增长。随后开始给药,各组增重呈逐渐恢复趋势。小鼠注射CTX后第7天,与MC组相比,MLPL、MLPM、MLPH和LM组增重均增加,其中MLPM组增重显著高于MC组(P<0.05),但MLPL、MLPM、MLPH和LM组之间增重无显著差异(P>0.05)。小鼠注射CTX后第10天,MC组增重显著低于其他各组(P<0.05)。小鼠注射CTX后第13天,MC组增重显著低于MLPL、MLPH和LM组(P<0.05)。
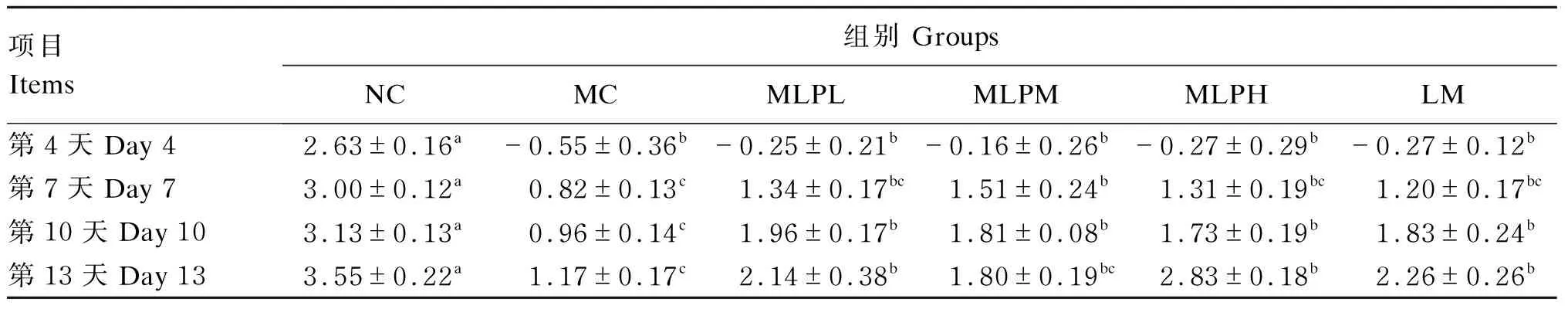
表2 各组小鼠增重的变化
2.2 MLP对空肠组织病理学变化的影响
肠黏膜是食品污染物、化学物质和病原体与机体接触的第1道屏障,在调节免疫对应激源的反应中发挥着重要作用[12]。病理结果显示,小鼠注射CTX后加重了小鼠空肠绒毛萎缩和屏障损伤,与MC组比较,MLPL、MLPM和MLPH组小鼠空肠病理损伤明显减轻(图1)。以上结果表明,MLP可以通过改善CTX致免疫抑制小鼠的肠黏膜屏障,缓解肠黏膜损伤,有助于肠黏膜免疫应答的恢复。
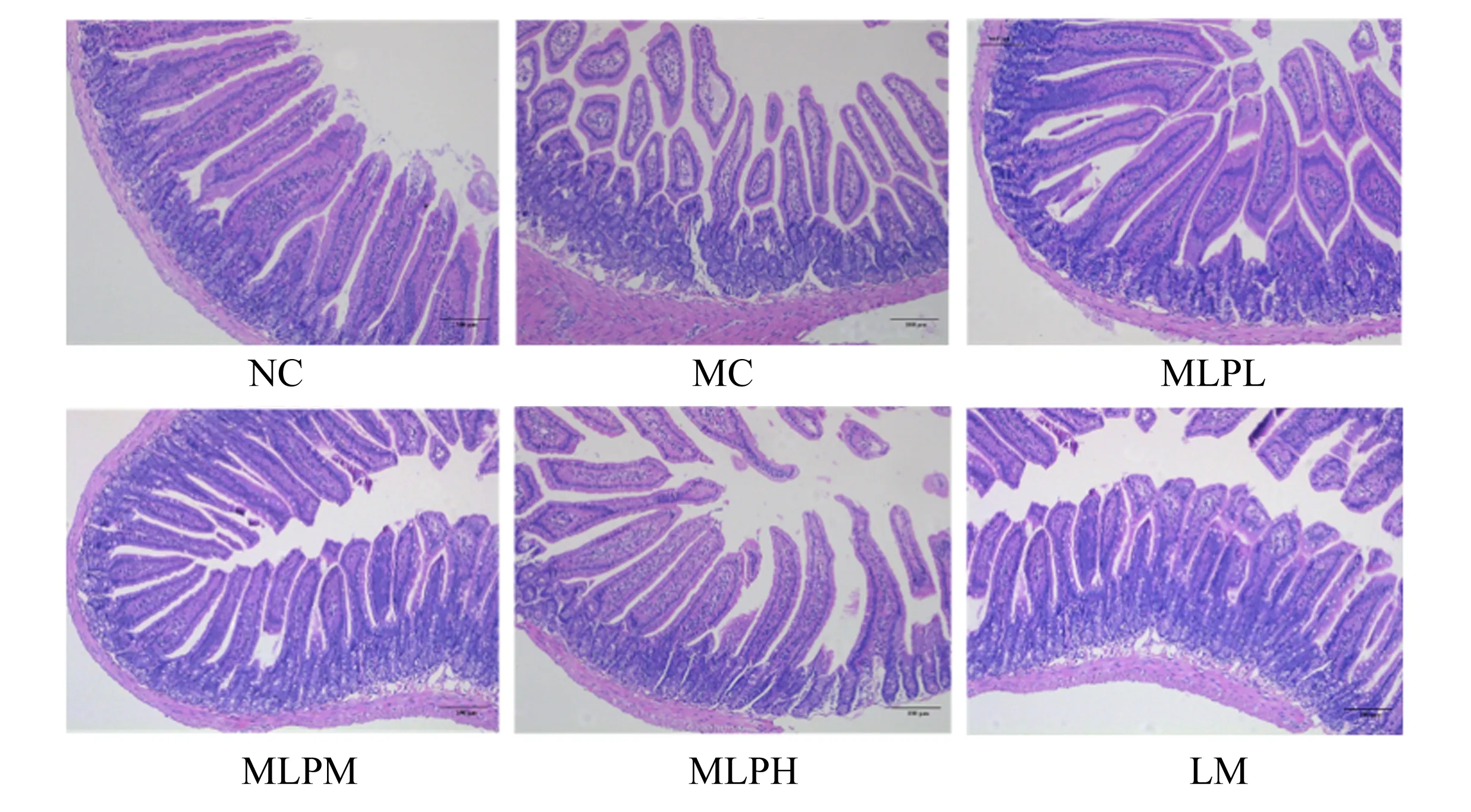
NC:正常对照组 NC group;MC:环磷酰胺模型组 MC group;MLPL:桑叶多糖低剂量组 MLPL group;MLPM:桑叶多糖中剂量组 MLPM group;MLPH:桑叶多糖高剂量组 MLPH group;LM:药物对照组 LM group。下图同 the same as below。
2.3 MLP对结肠上皮细胞紧密连接蛋白和MUC2 mRNA表达的影响
如表3所示,与NC组相比,MC组Claudin-5、ZO-1、Occludin、MUC2的mRNA相对表达量显著降低(P<0.05)。与MC组相比,MLPM、MLPH和LM组Claudin-5、MUC2的mRNA相对表达量显著升高(P<0.05),MLPM和MLPH组Occludin的mRNA相对表达量显著升高(P<0.05),MLPH组ZO-1的mRNA相对表达量显著升高(P<0.05)。其中,MLPH组Claudin-5、Occludin的mRNA相对表达量显著高于LM组(P<0.05),Occludin的mRNA相对表达量显著高于NC组(P<0.05)。以上结果表明,MLP可以通过上调紧密连接蛋白和MUC2的mRNA表达,调节CTX致免疫抑制小鼠的肠道黏膜损伤。

表3 MLP对结肠上皮细胞紧密连接蛋白和MUC2 mRNA表达的影响
2.4 MLP对结肠上皮细胞TNF-α、IL-1β、IL-10和TGF-βmRNA表达的影响
如表4所示,与NC组相比,MC组TNF-α、IL-1β的mRNA相对表达量显著降低(P<0.05),IL-10、TGF-β的mRNA相对表达量显著升高(P<0.05)。与MC组相比,MLPM、MLPH和LM组TNF-α、IL-1β的mRNA相对表达量升高(P<0.05),MLPL、MLPM、MLPH和LM组IL-10和TGF-β的mRNA相对表达量显著降低(P<0.05)。其中,MLPH组TNF-α、IL-1β、IL-10、TGF-β的mRNA相对表达量与NC组差异不显著(P>0.05)。以上结果表明,MLP可以通过上调促炎因子TNF-α、IL-1β和下调抗炎因子IL-10、TGF-β的mRNA表达,调节CTX致免疫抑制小鼠的结肠免疫应答。

表4 MLP对结肠上皮细胞TNF-α、IL-1β、IL-10和TGF-β mRNA表达的影响
2.5 MLP对结肠上皮细胞TLR4、MyD88、p65 mRNA表达的影响
如表5所示,与NC组相比,MC组TLR4、MyD88、p65的mRNA相对表达量显著降低(P<0.05)。与MC组相比,MLPM、MLPH和LM组TLR4、MyD88、p65的mRNA相对表达量显著升高(P<0.05),MLPL组MyD88的mRNA相对表达量也显著升高(P<0.05)。以上结果表明,MLP可能通过上调TLR4的mRNA表达,启动MyD88、p65信号通路,从而转录相关免疫细胞因子来介导免疫应答,拮抗CTX诱导的免疫抑制。
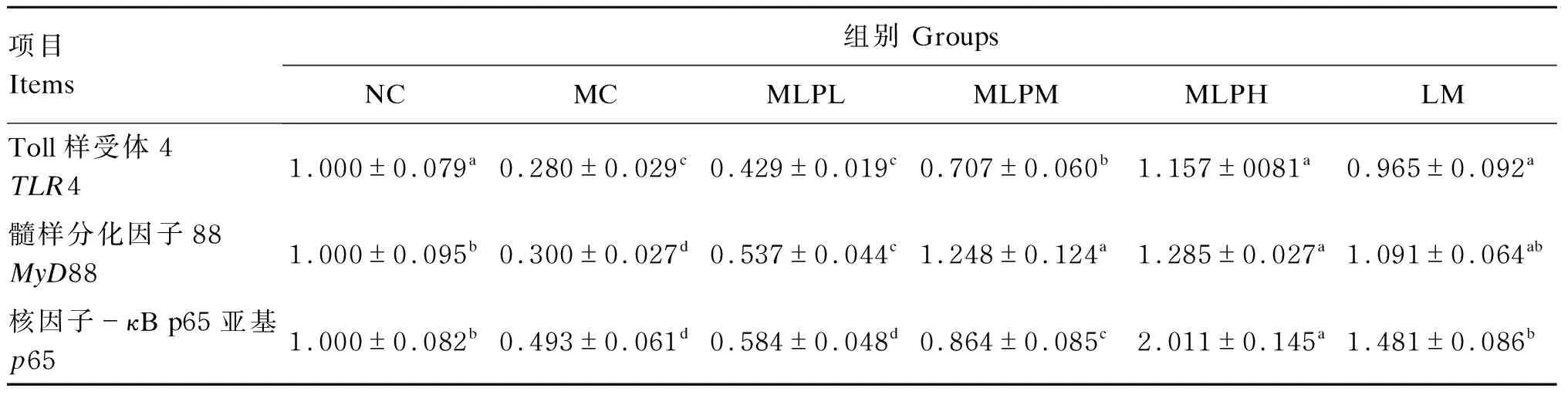
表5 MLP对结肠上皮细胞TLR4、MyD88、p65 mRNA表达的影响
2.6 MLP对盲肠微生物多样性的影响
如图2所示,在门水平上,盲肠内容物中的微生物群落主要包括拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。如图3所示,与NC组相比,MC组拟杆菌门的相对丰度显著降低(P<0.05);与MC组相比,NLPH组拟杆菌门的相对丰度显著增加(P<0.05)。与NC组相比,MC组免疫抑制相关菌如丁酸弧菌属(Butyricimonas)和真杆菌属(Eubacterium)的相对丰度显著增加(P<0.05),而MLPL、MLPM、MLPH和LM组丁酸弧菌属和真杆菌属的相对丰度显著降低(P<0.05)。以上结果表明,MLP可有效调节CTX诱导的肠道微生物群落紊乱,恢复肠道微生物稳态。

Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Actinobacteria:放线菌门;Proteobacteria:变形菌门;Deferribacteres:脱铁杆菌门;Candidatus_Saccharibacteria:暂定螺旋体门;Unassigned:未定菌;Verrucomicrobia:疣微菌门;Chloroflexi:绿弯菌门;Tenericutes:软壁菌门;Acidpbacteria:酸杆菌门;Planctomycetes:浮霉菌门;Elusimicrobia:迷踪菌门;Thaumarchaeota:奇古菌门;Nitrospirae:硝化螺旋菌门;Latescibacteria:黏胶球形菌门。
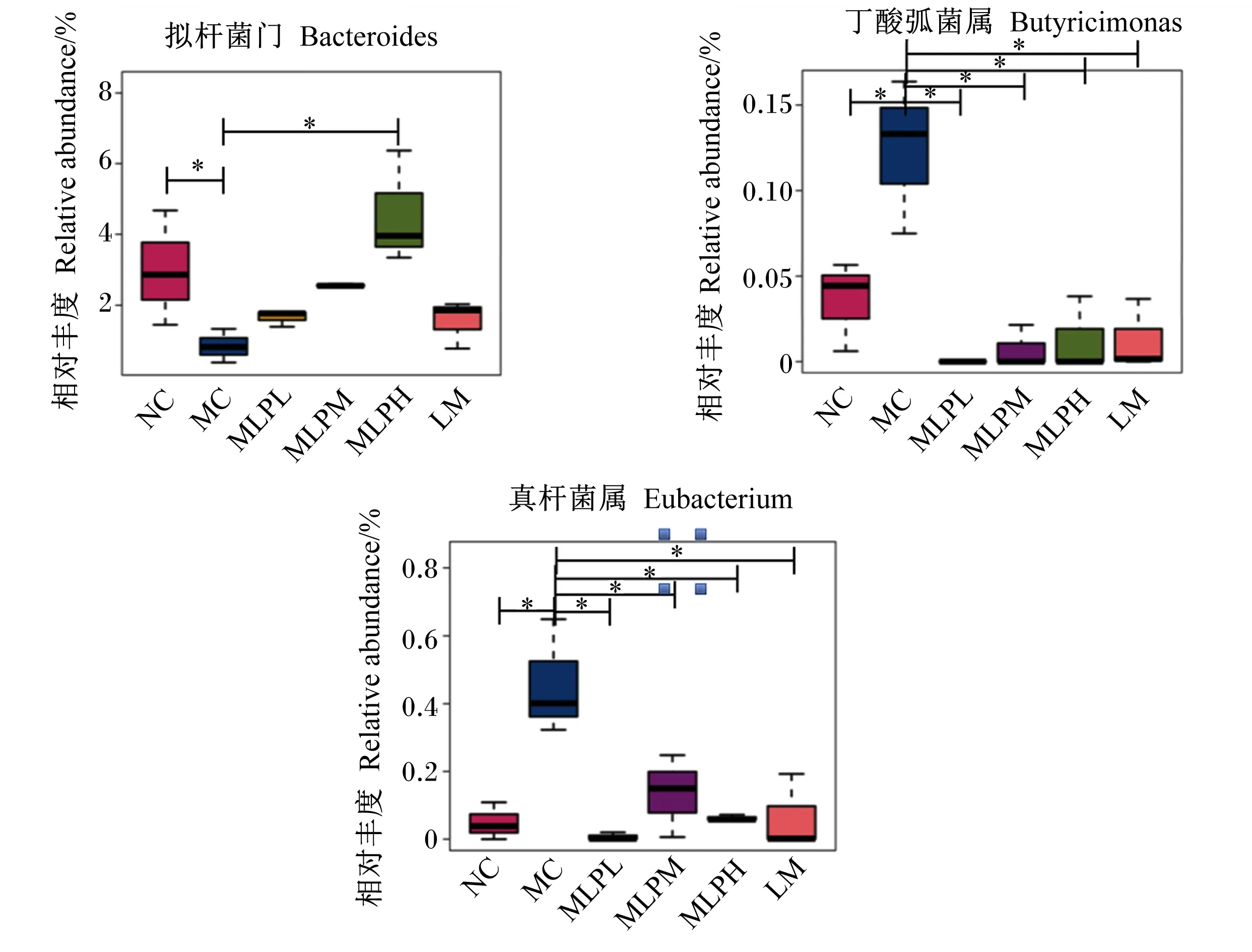
*表示差异显著(P<0.05)。
3 讨 论
CTX是一种强效免疫抑制剂,已被证明可抑制动物生长发育,破坏肠道黏膜屏障和免疫系统,引起肠道微生物菌群紊乱[9]。本研究结果显示,小鼠腹腔注射80 mg/kg BW的CTX,可产生明显的体重减轻,空肠黏膜受损,结肠上皮细胞紧密连接蛋白和MUC2的mRNA相对表达量显著下降,结肠上皮细胞TLR4和信号通路蛋白MyD88、p65的mRNA相对表达量也显著下降,导致盲肠微生物菌群严重紊乱,表明采用CTX构建小鼠肠道黏膜损伤模型是成功的。Shi等[10]报道,4周龄雄性BALB/c小鼠腹腔注射50 mg/kg BW的CTX,每天1次,连续注射2 d,亦能导致肠道菌群结构的变化和小肠组织损伤;廖吕燕等[11]报道,给雄性昆明小鼠腹腔注射100 mg/kg BW的CTX,导致盲肠菌群紊乱。由此可见,采用CTX构建小鼠免疫抑制状态下肠道损伤和菌群紊乱模型,CTX使用剂量与小鼠日龄、品种相关,同时需结合建模目的确定给药剂量。
肠绒毛增加了小肠的表面积,从而使营养物质吸收更为充分[12]。同时,紧密连接蛋白能维持肠道上皮细胞之间的完整性,参与肠上皮细胞之间信息传递和交换[13]。MUC2作为肠道杯状细胞分泌的一种高度糖基化黏蛋白,在阻止致病菌的入侵、协助肠道益生菌的定植上发挥重要作用[14]。本研究显示,小鼠腹腔注射CTX后,空肠绒毛萎缩,结肠紧密连接蛋白Occludin、ZO-1和Claudin-5以及MUC2的mRNA相对表达量显著下降,肠道黏膜结构完整性遭到破坏,而小鼠体重下降,呈现负增长的主要原因可能是肠道黏膜结构破坏导致营养物质吸收不良引起。小鼠连续灌胃MLP后,空肠绒毛生长逐渐恢复,结肠紧密连接蛋白Occludin、ZO-1、Claudin-5和MUC2的mRNA相对表达量也逐步提升,小鼠体重不断增加,在给药结束时,基本恢复到正常水平,尤其紧密连接蛋白Occludin的mRNA相对表达量已经与正常水平相当,说明MLP对CTX致免疫抑制小鼠肠道黏膜屏障损伤具有较好的修复作用,在维持肠道黏膜上皮屏障稳定性上具有明显优势。植物多糖对肠道黏膜上皮屏障的调节作用也有诸多类似研究报道,如火麻仁多糖能显著降低空肠隐窝深度,增加空肠绒毛长度和绒腺比,通过上调肠道紧密连接蛋白的表达从而保护肠道屏障结构的完整性[15]。
TNF-α、IL-1β为肠道上皮细胞产生的细胞因子,在先天性和适应性免疫应答中发挥重要作用[16]。本研究显示,MLP可促进结肠组织中TNF-α、IL-1β表达,拮抗CTX致小鼠结肠免疫细胞因子的抑制状态,增强小鼠的肠道非特异性免疫功能。Ma等[17]研究了灰树花多糖免疫活性,得出一定浓度灰树花多糖提高了CTX介导免疫低下小鼠脾细胞中TNF-α、IL-1β含量。板党多糖、沙棘多糖等治疗溃疡性结肠炎的机制皆与调节一些炎性因子TNF-α、IL-1β的表达密切相关[18-19]。IL-10和TGF-β作为抗炎因子是免疫应答中重要的负性调节分子[20]。研究显示,缺乏IL-10的小鼠T细胞功能明显恢复[21],TGF-β含量的下降有利于淋巴细胞的激活[22]。本研究中,在免疫抑制条件下,MLP可显著下调结肠组织中抗炎细胞因子IL-10、TGF-β的表达,这将有利于机体免疫细胞细胞的激活,从而拮抗免疫抑制。综上可知,中药多糖可通过调节炎症因子TNF-α、IL-1β和抗炎因子IL-10、TGF-β表达,在促进肠道免疫损伤修复中发挥重要作用。
TLR4是免疫细胞表面重要的非特异性免疫受体之一[23],在多种免疫细胞表面均有表达[24]。一旦TLR4与相应的配体结合后,则会启动细胞内系列信号通路,对天然免疫和特异性免疫进行调节。研究发现,口服粗根荨麻多糖可使CTX致免疫抑制小鼠肠道TLR4蛋白表达量升高至接近正常水平[25]。本研究中,CTX诱导机体免疫抑制后,结肠组织TLR4的表达被抑制,此时若是有外来病原微生物的侵袭,则TLR4识别异物的能力下降,则增加了疾病爆发的风险。使用MLP灌胃给药后,MLPL、MLPM和MLPH组结肠组织TLR4的mRNA相对表达量显著上升,甚至MLPH组TLR4的mRNA相对表达量能恢复至健康水平,这与上述文献报道结果一致,提示MLP能显著拮抗CTX诱导的TLR4表达抑制。
MyD88是一种胞质可溶性蛋白,是Toll 样受体(TLR)信号通路中非常重要的转导蛋白,通过调控炎症因子的表达影响免疫应答[26]。p65是核因子-κB(NF-κB)家族中的功能活性亚基,这些通路蛋白和亚基可参与多种细胞因子的调节,发挥免疫调节作用[27]。本研究显示,在免疫抑制状态下,小鼠结肠组织MyD88和p65表达被抑制,而小鼠灌胃MLP后,两者的表达均显著上调,尤其是MLPH组显示出显著的上调作用,甚至高于NC组。由此可见,在免疫抑制状态下,MLP对肠道黏膜免疫的调节机制可能是激活TLR4,启动MyD88依赖的NF-κB通路,从而启动细胞因子TNF-α、IL-1β、IL-10、TGF-β等表达介导免疫应答。研究显示,大麻籽多糖通过核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)-Kelch样环氧氯丙烷相关蛋白(Kelch-like epichlorohydrin-associated protein 1,Keap1)信号通路保护CTX诱导的小鼠肠道氧化损伤[28];人工冬虫夏草多糖可减轻CTX诱导的肠屏障损伤,这种损伤可能与丝裂原活化蛋白激酶(MAPK)途径有关[29]。由此可见,不同中药多糖对肠道黏膜免疫的调节机制存在多种方式,可能与中药多糖的组成相关,有待进一步深入探讨。
多糖可以通过抑制某些潜在病原体或促进有益微生物来改变肠道微生物群落组成,以维持机体健康[30],如紫甘薯多糖可以降低产碱杆菌属和萨特氏菌属的相对丰度,增加毛螺菌属和颤螺旋菌属的相对丰度,从而调节小鼠肠道细菌的种类和数量[31]。本研究中,MLP改变了CTX致免疫抑制小鼠肠道微生物群落的组成,通过上调益生菌拟杆菌门的相对丰度,降低有害菌丁酸弧菌属和真杆菌属的相对丰度,调节肠道微生态紊乱,进而改善肠道生物屏障功能。罗青等[32]报道,枸杞粉及多糖可通过降低厌氧菌的相对丰度、增加有益菌的相对丰度调节CTX致免疫低下小鼠肠道菌群紊乱。这与本研究结果有一定的相似性,说明中药多糖能够调节肠道菌群的比例,在促进肠道菌群平衡中具有显著作用。
4 结 论
综上所述,小鼠诱导免疫抑制模型后口服MLP,可从以下方面拮抗免疫抑制:通过恢复体重、缓解和修复肠道黏膜损伤增强肠道上皮屏障防御能力;通过调节肠道TLR4表达,激活p65、MyD88信号通路,促进免疫细胞因子TNF-α、IL-1β的释放,从而增强肠道黏膜免疫功能;还能调节肠道菌群结构和代谢紊乱,使有益菌数量增加,控制有害菌数量,平衡肠道微生物。

