百里香酚与迷迭香酸组合对脂多糖攻毒大鼠生长性能、炎症反应和肠道健康的影响
李润林 赵道远 李盼盼 雷铭康 吴佳庆 吴建民 汪 晶* 朱伟云
(1.南京农业大学动物科技学院,国家动物消化道营养国际联合研究中心,南京210095;2.南京农业大学理学院,南京210095)
植物提取物是从天然植物和植物产品中提取出来的活性物质,其绿色无污染且具有多种益生作用,如缓解炎症反应、改善肠道菌群组成等[1]。当前研究发现单一植物提取物需要大量添加才能发挥有效的益生作用,并且其对于潜在致病菌的抑制作用相对单一,而复合植物提取物可以通过协同或叠加效应更好地发挥抑菌和益生作用,对于提高动物健康状况具有更好的效果。
百里香精油具有广谱抑菌、消炎和提高机体抗氧化等作用,其作为一种有效的抗生素替代产品已在众多研究中得到证实。研究发现百里香酚对多种致病菌的增殖具有抑制作用[2-3],它能够通过抑制α-溶血素、肠毒素等相关酶的合成,降低肿瘤坏死因子的活性,进而对金黄色葡萄球菌的生长产生抑制作用[3],亦能通过改变细胞膜结构和通透性达到抑制沙门氏菌增殖的作用[4]。动物试验结果表明百里香酚能够有效减轻卵清蛋白等细胞因子诱导引发的炎症反应[5],并且能够增强断奶仔猪肠道的消化和吸收功能,同时增强肠道微生物群对致病菌的抵抗能力,提高抗菌活性,进而有效地改善仔猪肠道菌群组成[6]。并且,还有研究发现饲粮添加10 mg/kg的百里香酚能有效避免猪链球菌2型感染引起的炎症反应[7]。亦有研究发现灌胃10 mL/kg BW的浓度为500 mg/kg的百里香精油制剂能有效缓解硫代乙酰胺诱导的小鼠急性肝损伤[8]。迷迭香酸也具有较强的抗菌活性,能够有效抑制大肠杆菌、链球菌等多种潜在致病菌的生长,其代谢产物1,8-桉叶素能够通过破坏细菌的细胞膜,继而起到抑制沙门氏菌增殖的作用[9]。动物试验表明小鼠每天灌胃20或40 mg/kg的迷迭香酸能够通过调节氧化/抗氧化平衡对哮喘小鼠氧化性肺损伤起到明显的保护作用[10]。但在畜禽生产中关于迷迭香酸的应用研究相对较少,现有的研究发现迷迭香酸在提高机体抗氧化活性、降低机体炎症反应[11]和改善肉品质[12]等方面具有较好效果。
目前对于复合植物提取物的研究也有了较多进展。香芹酚和百里香酚组合在体外条件下能够显著提高对大肠杆菌、沙门氏菌、绿脓杆菌和金黄色葡萄球菌等条件性致病菌的抑制效果[13]。并且,百里香酚和苯甲酸复合物能够促进仔猪肠道发育,提高仔猪生长性能[14]。综上所述,百里香酚具有较好地抑制条件致病菌增殖的作用。而迷迭香酸作为一种酚酸性植物提取物,不仅能配合百里香酚的抑菌作用,其自身也具有抑菌、消炎和抗氧化等作用,两者配合使用可能具有更好地促进动物肠道健康的效果。基于以上研究结果,我们认为百里香酚与迷迭香酸组合可能在提高动物生长性能,改善幼龄动物肠道屏障功能,调节肠道菌群结构及缓解炎症反应等方面具有较好的效果。因此,本试验通过建立脂多糖(LPS)诱导的大鼠肠道炎症模型,研究百里香酚与迷迭香酸组合对大鼠空肠屏障功能、菌群结构及炎症反应的影响,为其在预防和减少肠道炎症反应,改善动物肠道健康等方面的研究提供参考。
1 材料与方法
1.1 试验材料
饲养试验于2019年12月至2020年1月在南京农业大学动物试验中心完成。百里香酚和迷迭香酸均购自上海某生物有限公司,纯度≥98%。LPS试剂购自上海源叶生物科技有限公司。
1.2 试验设计
试验选40只初始体重为(54.86±2.26) g的21日龄SD大鼠,公母各占1/2。适应性饲养1周后,将大鼠随机分为4组,分别为对照组(Con组)、百里香酚组(Thy组)、迷迭香酸组(Ros-A组)、百里香酚×迷迭香酸组(Thy×Ros-A组),每组10只(公母各占1/2),单笼饲养。所有大鼠均饲喂同一基础饲粮,其组成及营养水平如表1所示。百里香酚组、迷迭香酸组和百里香酚×迷迭香酸组每天分别灌胃20 mg/kg BW的百里香酚、20 mg/kg BW的迷迭香酸、10 mg/kg BW百里香酚+10 mg/kg BW迷迭香酸组合制剂,Con组每天灌胃等量的生理盐水。所有大鼠连续灌胃14 d。在第13天,对照组、百里香酚组、迷迭香酸组和百里香酚×迷迭香酸组腹腔注射500 μg/kg BW的LPS溶液建立急性肠道炎症模型,攻毒剂量参考Yao等[15]的试验。腹腔注射LPS 12 h后进行屠宰取样。试验期间大鼠自由采食和饮水,按照常规免疫、消毒程序进行饲养管理。

表1 基础饲粮组成及营养水平(干物质基础)

续表1项目 Items含量 Content食盐 NaCl0.30矿物质预混料 Mineral premix1)0.50维生素预混料 Vitamin premix2)0.50合计 Total100.00营养水平 Nutrient levels3)粗蛋白质 Crude protein20.96粗脂肪 Crude fat4.05粗纤维 Crude fibre4.29
1.3 样品采集
试验第14天(LPS注射后12 h),将大鼠麻醉后采用断头法处死,采集空肠中段组织3~4 cm置于4%多聚甲醛溶液中固定。取空肠黏膜及食糜样品,液氮速冻后置于-80 ℃保存备用。
1.4 测定指标与方法
1.4.1 生长性能测定
每只大鼠为1个重复,试验的第1天和第14天分别对大鼠进行称重,并计算平均日增重。
1.4.2 空肠组织形态结构观察
将采集的空肠组织置于4%多聚甲醛溶液中固定。参照常规方法制作切片,经过脱水、包埋、切片和苏木精-伊红(HE)染色后使用虚拟显微镜观察肠道切片的形态结构。采用Image-Pro Plus图像处理系统测定每张切片中5个典型视野,测定绒毛高度和隐窝深度,并计算绒毛高度/隐窝深度(即绒隐比)。
1.4.3 空肠黏膜中抗氧化指标和细胞因子含量测定
抗氧化指标:总超氧化物歧化酶(T-SOD)与谷胱甘肽过氧化物酶(GSH-Px)活性、丙二醛(MDA)含量、总抗氧化能力(T-AOC)均采用比色法进行检测,采用南京建成生物工程研究所生产的试剂盒按照试剂盒使用说明进行测定。炎症因子含量:白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)含量与髓过氧化物酶(MPO)活性均采用酶联免疫吸附测定(ELISA)法测定,采用全波长酶标仪进行测定,试剂盒购自酶联生物有限公司,操作步骤严格按照说明书执行。
1.4.4 空肠黏膜中相关基因mRNA相对表达量测定
空肠黏膜总RNA采用Trizol法提取,用RNA的260和280 nm处吸光度比值(OD260/280值)鉴定RNA质量。反转录使用TOYOBO公司的ReverTra Ace®qPCR RT Master Mix试剂盒,带有gDNA清除功能。使用ABM公司的EvaGreen 2×qPCR Master Mix进行实时荧光定量PCR(RT-qPCR)。以β-肌动蛋白(β-actin)为内参基因,目的基因和内参基因的引物序列见表2。PCR条件为:95 ℃预变性10 min;然后95 ℃变性15 s,60 ℃延伸60 s,持续40个循环。采用循环阈值(Ct值)进行RT-qPCR扩增的相对定量。采用比较Ct值法比较目的基因相对于β-actin的表达量。

表2 实时荧光定量PCR所用引物

续表2基因Genes引物序列Primer sequence (5'—3')产物大小Product size/bp序列号Accession No.白细胞介素1受体关联激酶1 IRAK1F:CTCCTCCATCAAGCCAAGCCR:CACACCCAAAACCACCCTCT149NM_001127555.1肿瘤坏死因子受体相关因子6 TRAF6F:CGCCAAAATGGAAACGCAGAR:TGCTTCCATCTCGGCAACTT88NM_001107754.2闭锁连接蛋白-1 ZO-1F:GAGGATGGTCACACCGTGGTR:GGAGGATGCTGTTGTCTCGG169XM_0210988961.1闭合蛋白-1 Claudin-1F:GCCCTACTTTGCTGCTCCTGR:TTTCTGGTTGTTCCCACACG141NM_021098896.1咬合蛋白 OccludinF:ATGCTTTCTCAGCCAGCGTAR:AAGGTTCCATAGCCTC176NM_001163647.2β-肌动蛋白 β-actinF:ATGCTTCTAGACGGACTGCGR:GTTTCAGGAGGCTGGCATGA109XM_003357928.4
1.4.5 空肠食糜中短链脂肪酸浓度测定
使用气相色谱法测定空肠食糜中短链脂肪酸的浓度。预处理:每个重复称取0.30 g的空肠食糜于2.0 mL离心管中,再加入1.2 mL的双蒸水混匀后,12 000 r/min离心10 min,取上清液0.80 mL,加入0.16 mL 25%偏磷酸巴豆酸混合溶液,-20 ℃保存过夜。测定前解冻,4 ℃、12 000 r/min离心10 min。吸取上清液通过0.22 μm微孔滤膜后待测。
参照Wang等[17]的方法,使用自动进样仪取0.3 μL待测上清液,瞬时注入气相色谱仪(岛津GC-14B)中,气相色谱条件为:毛细管色谱柱(柱长为30 m,内径为0.32 mm,膜厚为0.25 μm,Sigma-Aldrich,美国),柱温135 ℃,进样口温度200 ℃,采用氢火焰离子检测器,检测器温度200 ℃,载气为氮气,压力为60 kPa,氢气压力为50 kPa,氧气压力为50 kPa。
1.4.6 空肠食糜中菌群的高通量测序
采用十六烷基三甲基溴化胺(CTAB)的方法提取空肠食糜DNA[17],提取和纯化总DNA后,使用分光光度计检测DNA的浓度和纯度,并将DNA浓度统一稀释到500 ng/mL。以稀释后的DNA为模板,使用带Barcode的特异引物(319F:5′-ACTCCTACGGGAGGCAGCA-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′)[18]对提取出的空肠食糜微生物DNA的16S rRNA的V3~V4区进行PCR扩增,扩增后的产物用2%琼脂糖凝胶电泳检测;同时使用QuantiFlourTM-ST蓝色荧光定量系统对PCR产物进行检测定量,之后按测序量要求,对PCR产物进行均一化处理;最后,使用Illumina MiSeq平台进行上机测序及文库构建。
1.5 数据统计分析
试验数据用Excel 2021初步处理后,运用SPSS 26.0统计软件中的单因素方差分析和Duncan氏法进行数据分析。数据用平均值±标准差(mean±SD)表示,P<0.05表示显著差异,P>0.05表示差异不显著。
2 结果与分析
2.1 百里香酚与迷迭香酸组合对LPS攻毒大鼠生长性能的影响
由图1可知,灌胃7 d后,百里香酚×迷迭香酸组大鼠的体重高于对照组和单一植物提取物组(百里香酚组、迷迭香酸组),并且百里香酚×迷迭香酸组大鼠的平均日增重显著高于对照组和迷迭香酸组(P<0.05)。上述结果说明灌胃百里香酚和迷迭香酸均能提高大鼠的生长性能,且以百里香酚与迷迭香酸组合的效果最好。

Con:对照组;Thy:百里香酚组;Ros-A:迷迭香酸组;Thy×Ros-A:百里香酚×迷迭香酸组。数据柱标注不同字母表示差异显著(P<0.05)。下图同。
2.2 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠黏膜形态结构和屏障功能的影响
由图2和表3可知,与对照组相比,灌胃百里香酚与迷迭香酸组合能够显著提高大鼠空肠的绒毛高度(P<0.05),显著降低隐窝深度(P<0.05),并且百里香酚×迷迭香酸组大鼠空肠的绒隐比也显著高于对照组和单一植物提取物组(P<0.05)。

A:对照组;B:百里香酚组;C:迷迭香酸组;D:百里香酚×迷迭香酸组。

表3 百里香酚和迷迭香酸组合对LPS攻毒大鼠空肠黏膜形态结构的影响
由图3可知,与对照组相比,百里香酚×迷迭香酸组大鼠空肠黏膜中ZO-1、Occludin和Claudin-1 mRNA的相对表达量显著上调(P<0.05),并且其相对表达量也高于(P>0.05)或显著(P<0.05)高于单一植物提取物组。上述结果说明灌胃百里香酚与迷迭香酸组合能够在一定程度上缓解LPS攻毒对大鼠空肠屏障功能产生的负面影响。
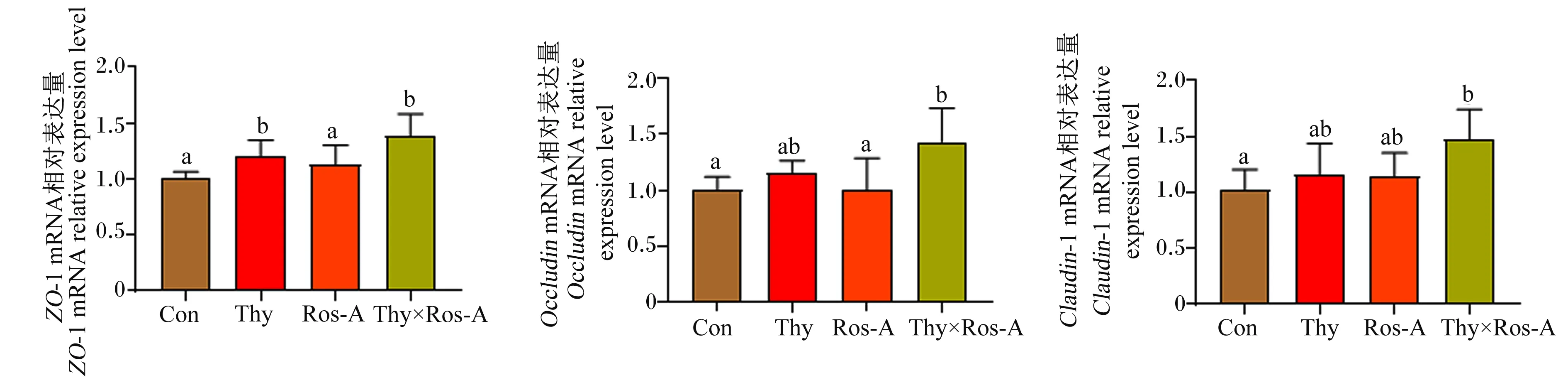
图3 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠黏膜中紧密连接蛋白基因mRNA相对表达量的影响
2.3 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠食糜中菌群结构和代谢产物的影响
2.3.1 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠食糜中微生物多样性的影响
表4所示为大鼠空肠食糜微生物α多样性结果。百里香酚×迷迭香酸组的Shannon指数显著低于对照组、百里香酚组和迷迭香酸组(P<0.05),而Simpson指数显著高于对照组、百里香酚组和迷迭香酸组(P<0.05)。百里香酚×迷迭香酸组、百里香酚组和迷迭香酸组的Chao1指数显著高于对照组(P<0.05)。

表4 百里香酚与迷迭香酸组合对空肠食糜中微生物α多样性的影响
图4是基于操作分类单元(OTU)水平的主成分分析(PCA)。PCA显示,LPS攻毒后,对照组、百里香酚组、迷迭香酸组、百里香酚×迷迭香酸组空肠食糜中菌群显著分开,并且ANOSIM分析结果表明其组间具有显著差异(R=0.270 2,P=0.004 0)。

图4 百里香酚与迷迭香酸组合对LPS攻毒大鼠
2.3.2 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠食糜中菌群组成的影响
图5所示为空肠食糜菌群门水平丰度>0.1%的菌门,其中优势菌门为厚壁菌门(Fimicutes)、变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)(图5-A)。在门水平上对各菌门相对丰度进一步统计分析(图5-B)发现,与对照组、百里香酚组和迷迭香酸组相比,百里香酚×迷迭香酸组Fimicutes的相对丰度显著增加(P<0.05),Proteobacteria的相对丰度显著降低(P<0.05);百里香酚×迷迭香酸组Actinobacteria和Verrucomicrobia的相对丰度显著低于迷迭香酸组(P<0.05),与对照组和百里香酚组相比有所降低,但差异不显著(P>0.05);此外,百里香酚×迷迭香酸组Cyanobacteria的相对丰度显著低于百里香酚组(P<0.05),略低于对照组和迷迭香酸组(P>0.05)。

Fimicutes:厚壁菌门;Proteobacteria:变形菌门;Cyanobacteria:蓝藻门;Actinobacteria:放线菌门;Verrucomicrobia:疣微菌门;Bacteroidetes:拟杆菌门;Others:其他。图6同 the same as Fig.6。
图6所示为空肠食糜菌群属水平丰度>0.1%的菌属,共有12个,其中乳杆菌属(Lactobacillus)、罗姆布茨菌属(Romboutsia)、norank_f_Muribaculacea、Turicibacter、双歧杆菌属(Bifidobacterium)为优势菌属(图6-A)。在属水平上对各菌属相对丰度进一步统计分析(图6-B)发现,与对照组相比,3个植物提取物组链球菌属(Streptococcus)、嗜气性杆菌属(Rodentibacter)和罗斯氏菌属(Rothia)的相对丰度显著降低(P<0.05);百里香酚×迷迭香酸组Lactobacillus的相对丰度显著高于对照组(P<0.05),百里香酚组和迷迭香酸组Lactobacillus的相对丰度也高于对照组,但差异未达显著水平(P>0.05)。此外,与单一植物提取物组相比,百里香酚×迷迭香酸组norank_f_Muribaculacea的相对丰度显著低于迷迭香酸组(P<0.05),norank_f_norank_o_Chloroplast的相对丰度显著低于百里香酚组(P<0.05)。

Clostridium_sensu_stricto_1:狭义梭菌属1;Lactobacillus:乳杆菌属;Romboutsia:罗姆布茨菌属;Streptococcus:链球菌属;Rodentibacter:嗜气性杆菌属;Rothia:罗斯氏菌属;Bifidobacterium:双歧杆菌属;Akkermansia:阿克曼氏菌属。
2.3.3 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠食糜中短链脂肪酸浓度的影响
由表5可知,3个植物提取物组空肠食糜中乙酸和总短链脂肪酸浓度显著高于对照组(P<0.05);此外,百里香酚×迷迭香酸组和百里香酚组大鼠空肠食糜中丙酸和丁酸浓度也显著高于对照组(P<0.05)。
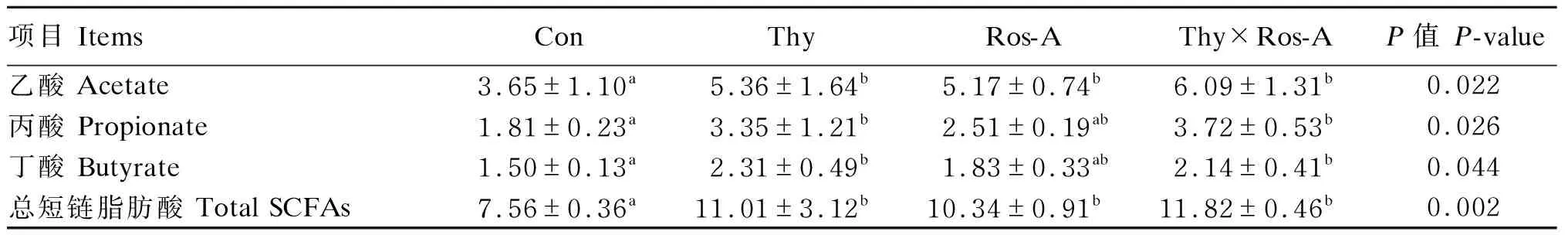
表5 百里香酚与迷迭香酸组合对大鼠空肠食糜中短链脂肪酸浓度的影响
2.4 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠黏膜炎症反应和抗氧化水平的影响
2.4.1 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠黏膜炎症反应的影响
由图7可知,与对照组相比,百里香酚、迷迭香酸及其组合均能不同程度地降低大鼠空肠黏膜中MPO的活性,其中百里香酚与迷迭香酸组合能显著降低空肠黏膜中MPO活性(P<0.05)。与对照组相比,百里香酚×迷迭香酸组空肠黏膜中IL-6的含量显著降低(P<0.05),抑炎因子IL-10的含量显著提高(P<0.05),TNF-α的含量有降低的趋势(P=0.079)。
由图8可知,与对照组相比,百里香酚、迷迭香酸及其组合均能不同程度降低大鼠空肠黏膜中TLR-4、MyD88、TRAF-6、IRAK1的mRNA相对表达量,其中百里香酚×迷迭香酸组与对照组的差异达到显著水平(P<0.05);并且,与单一植物提取物组相比,百里香酚×迷迭香酸组大鼠空肠黏膜中TLR-4、MyD88、TRAF-6、IRAK1的mRNA相对表达量也有所降低,但差异未达到显著水平(P>0.05)。

图8 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠黏膜中TLR-4/MyD88信号通路相关基因mRNA相对表达量的影响
2.4.2 百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠黏膜中抗氧化指标的影响
由表6可知,与对照组、百里香酚组和迷迭香酸组相比,百里香酚×迷迭香酸组大鼠空肠黏膜中T-SOD活性显著提高(P<0.05),T-AOC有提高的趋势(P=0.059);此外,百百里香酚×迷迭香酸组大鼠空肠黏膜中GSH-Px活性和MDA含量分别高于和低于对照组、百里香酚组和迷迭香酸组,但差异未达显著水平(P>0.05)。
3 讨 论
作为抗生素替代品,百里香酚在多项研究中均表明对于提高动物的生长性能具有较好的效果。Diao等[14]研究发现,在仔猪饲粮中添加100 mg/kg百里香酚和苯甲酸复合物能够提高断奶仔猪的生产性能,提高仔猪的平均日增重,并能够促进仔猪肠道发育。Yan等[12]研究显示,在杜×长×大肥育猪饲粮中添加0.01%百里香精油能够提高育肥猪的生产性能和肉品质,提高营养物质消化率。Mathlouthi等[19]研究发现,在1日龄雏鸡饲粮中添加100 mg/kg迷迭香酸能够提高其生长性能,降低肠道大肠杆菌数量,显著降低腹泻率,并具有替代抗生素的效果。虽然目前还没有百里香酚和迷迭香酸对于大鼠影响的相关研究,但其对于鸡和仔猪的研究也能反映其作为抗生素替代品的效果。在本研究中,我们发现百里香酚、迷迭香酸以及二者组合均能提高大鼠的生长性能。并且,从第7天起百里香酚×迷迭香酸组大鼠的体重开始高于对照组和百里香酚组、迷迭香酸组,并且百里香酚×迷迭香酸组大鼠的平均日增重显著高于对照组和迷迭香酸组。这表明灌胃百里香酚和迷迭香酸组合对动物生长性能的改善效果优于百里香酚或迷迭香酸的单一添加。

表6 百里香酚和迷迭香酸组合对LPS攻毒大鼠空肠黏膜中抗氧化指标的影响
生长性能的改善常伴随着生理结构的变化,而肠道健康与动物的生长发育有紧密联系。肠道绒毛高度和隐窝深度是评价动物肠道黏膜形态结构的重要指标。肠道绒毛高度增加,能够增加肠绒毛单位面积的细胞数,进而提高肠道吸收能力;隐窝深度增加会使组织的周转加快,增加维持的能量需求,降低吸收效率[20]。绒隐比反映小肠的功能状态,其值降低表明肠道整体消化吸收能力的下降。本研究中,我们发现大鼠灌胃百里香酚、迷迭香酸及其组合不仅能增加LPS攻毒大鼠空肠黏膜的绒毛高度,降低隐窝深度,提高绒隐比,而且与对照组相比,百里香酚×迷迭香酸组达到显著水平。这表明百里香酚、迷迭香酸及其组合均能减少LPS攻毒引起的大鼠肠道损伤,促进肠道的消化吸收功能,并且百里香酚与迷迭香酸组合的效果更为显著。周洪彬等[21]研究表明,在肉仔鸡饲粮中添加百里香酚和香芹酚等均可提高肠道黏膜形态结构。Cheng等[22]研究也发现,在断奶仔猪饲粮中添加牛至油可提高空肠绒毛高度,改善肠道屏障的完整性。在本研究中,百里香酚×迷迭香酸组大鼠空肠黏膜中ZO-1、Occludin和Claudin-1的mRNA相对表达量显著上调,并且百里香酚×迷迭香酸组上述屏障蛋白基因的mRNA相对表达量还高于或显著高于单一植物提取物组。这表明植物提取物能预防和减少LPS攻毒引起的大鼠肠道屏障功能损伤,并且百里香酚和迷迭香酸组合的效果更为明显。
肠道微生态平衡对于维持动物肠道健康和促进动物生长发育具有重要作用。近年来的研究证实肠道微生物及其代谢产物能够促进肠道发育,提高肠道屏障功能,降低肠道炎症反应[23-24]。本研究结果发现,百里香酚×迷迭香酸组的Shannon指数显著降低,Simpson指数和Chao1指数显著提高。这表明百里香酚×迷迭香酸组大鼠空肠微生物多样性显著降低,但丰富度显著提高。并且,β多样性分析结果也表明4组大鼠空肠食糜中菌群显著分开。以上结果均证明大鼠灌胃植物提取物后,特别是灌胃百里香酚和迷迭香酸组合后,其空肠中菌群结构发生了显著变化。有研究指出,Fimicutes和Bacteroidetes广泛存在于动物肠道中,而Fimicutes/Bacteroidetes的比值能够有效评价动物肠道微生物状态,特别是Fimicutes的变化直接影响机体能量摄取和脂肪代谢过程[25-26]。Proteobacteria是革兰氏阴性菌的主要菌门,包括多种病原微生物,如大肠杆菌、沙门氏菌、志贺氏杆菌等,可能导致某些特性疾病如炎症性肠病[27]。而对大鼠空肠食糜中菌群组成在门水平上进一步分析发现,百里香酚×迷迭香酸组Fimicutes的相对丰度显著增加,Proteobacteria的相对丰度显著降低。这一变化可能与百里香酚和迷迭香酸的抑菌性有关,百里香酚、迷迭香酸对大肠杆菌、沙门氏菌具有较强的抑制作用。以上结果提示我们,百里香酚与迷迭香酸组合能够通过改变碳水化合物代谢相关菌群改善肠道微生态环境,例如,提高Fimicutes的相对丰度增加能量供给,促进机体生长发育;降低Proteobacteria等条件致病菌的相对丰度,降低肠道疾病和炎症反应。对大鼠空肠食糜中菌群组成在属水平上进一步分析发现,百里香酚×迷迭香酸组Lactobacillus的相对丰度显著高于对照组,也略高于百里香酚组和迷迭香酸组。前人研究发现乳酸杆菌具有改善肠道微生态环境,增强肠道屏障功能和提高机体免疫力的作用[28]。此外,本研究还发现3个植物提取物组的链球菌属、嗜气性杆菌属和斯氏菌属的相对丰度较对照组显著降低。综上可知,百里香酚与迷迭香酸组合对LPS攻毒大鼠空肠菌群结构产生了一定的影响,增加了Firmicutes/Bacteroidete的比值以及有益菌Lactobacillus等的相对丰度,降低了Proteobacteria和Streptococcus、Rodentibacter等的相对丰度,从而有利于肠道健康。试验中我们还发现3个植物提取物组空肠食糜中乙酸和总短链脂肪酸浓度显著高于对照组,百里香酚×迷迭香酸组大鼠空肠食糜中乙酸、丙酸、丁酸和总短链脂肪酸浓度均显著高于对照组。而引起空肠食糜中短链脂肪酸浓度提高的原因可能是因为灌胃植物提取物后空肠中一些产酸菌(如Lactobacillus等)在空肠中的相对丰度增加[25]。
肠道炎症反应对于维持肠道屏障功能和机体健康具有重要作用。本试验结果表明,百里香酚与迷迭香酸组合能显著降低大鼠空肠黏膜中MPO的活性和IL-6的含量,显著提高抑炎因子IL-10的含量,TNF-α的含量有降低的趋势。这表明百里香酚与迷迭香酸组合能够降低大鼠空肠黏膜中促炎细胞因子的产生,促进抑炎因子的分泌。我们还发现百里香酚与迷迭香酸组合能够显著降低大鼠空肠黏膜中TLR-4/MyD88信号通路中TLR-4、MYD88、TRAF6、IRAK1的mRNA相对表达量。这表明百里香酚与迷迭香酸组合能够降低LPS攻毒引起的大鼠肠道炎症反应。当然,引起肠道炎症反应降低的原因可能与多种因素有关。Tedelind等[24]研究发现,短链脂肪酸尤其是丁酸可以通过抑制LPS诱导的TNF-α激活核因子-κB(NF-κB)来发挥抗炎作用。并且,有研究发现迷迭香酸能够显著降低小鼠毛细血管的通透性,并降低血清中炎症因子TNF-α、白细胞介素-1β(IL-1β)、C-反应蛋白(CRP)的产生[29];百里香酚能够通过抑制机体的NF-κB信号通路的传导,降低相关细胞因子如TNF-α和IL-6等的合成[30]。这表明百里香酚与迷迭香酸组合可能通过抑制炎症因子的分泌,调节肠道菌群组成及其代谢产物等方式预防和减少LPS攻毒引起的炎症反应。
炎症反应往往伴随着氧化应激的产生,肠道发生炎症反应后会引起肠黏膜中的白细胞浸润增加,进而引起应激的产生[31]。在本研究中,我们发现百里香酚与迷迭香酸组合能够显著提高空肠黏膜中T-SOD活性,T-AOC也有提高的趋势。而关于百里香酚和迷迭香酸的研究也证明其在体外条件下具有较强的自由基清除能力,能够提高机体的抗氧化水平。并且,相关研究也证实肠道氧化应激可以通过调节核因子E2相关因子2(Nrf2)途径,进而调节紧密连接蛋白的表达,来影响肠道黏膜的屏障功能[32-33]。
4 结 论
百里香酚与迷迭香酸组合能够提高大鼠的生长性能,预防和减少LPS攻毒引起的大鼠肠道黏膜形态损伤,调节空肠食糜的菌群结构,降低肠道的炎症反应和氧化应激,有助于保护空肠的屏障功能。百里香酚与迷迭香酸组合的效果优于百里香酚或迷迭香酸单一成分,二者具有较好的组合效应。

