涮辣与昆明皱皮椒苯丙氨酸解氨酶(PAL)的生物信息学及表达分析*
张 祥,刘雨婷,张婧柔,李平平,谢志和,张芮豪,邓明华,2
(1.云南农业大学 园林园艺学院,云南 昆明 650201;2.云南省通海县经济作物工作站,玉溪市邓明华专家基层科研工作站,云南 通海 652700)
苯丙氨酸解氨酶 (phenylalanine ammonia-lyase,PAL)属于lyases 家族,最近此类酶被重新命名为EC 4.3.1.24 (苯丙氨酸解氨酶)、EC 4.3.1.25(酪氨酸解氨酶)和EC 4.3.1.26 (苯丙氨酸/酪氨酸解氨酶),该酶催化苯丙氨酸的非氧化脱氨基反应,产生反式肉桂酸和NH3[1]。PAL 是苯丙烷途径中的第1 步反应酶,同时也是此途径的限速酶[2-3]。苯丙烷途径中产生的中间产物可直接或间接合成多种植物次生代谢物质,包括类黄酮、木质素、酚类、植物抗毒素和辣椒素等,这些次生代谢物在植物生长发育及抗逆方面起重要作用[4-7]。因此,研究不同辣椒材料、发育时期和栽培环境下的PAL 酶活性及基因表达对解析辣椒次生代谢物质合成和积累有重要价值。
马铃薯未成熟块茎组织中的PAL表达水平和酶活性最高[8]。BALDI 等[9]研究表明:苯丙烷类和类黄酮生物合成相关基因可能在调控苹果早期果实发育中起重要作用,并指出在苹果果实发育前期,PAL表达水平显著上调。同样,在葡萄果实发育的一定阶段呈现出PAL 依赖性[10]。对拟南芥PAL基因的研究显示:PAL在植物生长、发育和对环境胁迫的反应中不可或缺[11]。由此可知,除不同发育时期外,PAL在应对不同环境因子胁迫中也发挥着一定的作用。目前许多研究表明:PAL类基因在应对环境刺激反应中受到不同的调节[12-13],同时相关植物激素如脱落酸、赤霉素和茉莉酸等也会影响PAL基因的表达量和酶活性[14]。
涮辣是云南的特色辣椒品种,为小米辣的栽培变种,分布于云南省德宏、保山和西双版纳等地,是已知报道中中国最辣的辣椒[15-16]。王姣等[17]通过研究得到云南涮辣中PAL 酶活性与辣椒素含量的变化基本一致,表明PAL 是影响涮辣辣椒素积累的重要因素。本实验室通过测定涮辣和昆明皱皮椒辣椒素和二氢辣椒素含量,经辣度换算后发现涮辣辣度为昆明皱皮椒的42.4 倍(数据未发表),两者同为云南本地特色辣椒,但辣椒素积累差异较大。PAL 作为影响辣椒素合成的主要酶之一,尽管在不同发育时期、环境和物种对PAL作用有许多相关研究,但对于地方特色辣椒(如云南高辣度涮辣)辣椒素积累现象的分子水平解释较少。因此,本研究将涮辣与昆明皱皮椒进行对比,运用生物信息学方法构建系统发育树,基于qPCR 与报道的PAL 酶活性测定方法,测定不同发育时期、不同栽培环境下PAL的表达水平与酶活性,并测定不同外源物质处理下涮辣PAL表达水平,旨在解析涮辣与昆明皱皮椒PAL基因及蛋白的差异,探究不同发育时期、不同栽培环境下PAL基因表达及酶活性的变化规律,为研究PAL在云南特色涮辣辣椒素积累中的作用提供借鉴与参考。
1 材料与方法
1.1 试验材料
涮辣与昆明皱皮椒来源于云南农业大学园林园艺学院番茄辣椒实验室,于露天和大棚2 种不同环境中正常栽培。以花后每10 d 为1个发育时期,选择7个发育时期的辣椒果实作为试验材料,分别构建2 种辣椒的cDNA 混池进行PAL基因克隆。选择辣椒不同发育时期的果实测定PAL表达水平及酶活性,对涮辣花后30 d 果实进行不同外源物质处理并测定PAL表达水平,所有试验均设置3个生物学重复。
1.2 试验方法
1.2.1PAL基因分离与鉴定
使用RNA 提取试剂盒 (北京华越洋生物科技有限公司)提取涮辣与昆明皱皮椒总RNA,利用Takara 公司反转录试剂盒合成第1 链cDNA,并以此为模板,使用KIM 等[18]报道的PALRTPCR 特异性引物 (表1)进行RT-PCR 特异性扩增,回收特异性PCR 产物送至北京擎科新业生物技术有限公司进行测序,使用ORF Finder 软件预测PAL开放阅读框,在线BLAST 进行验证。
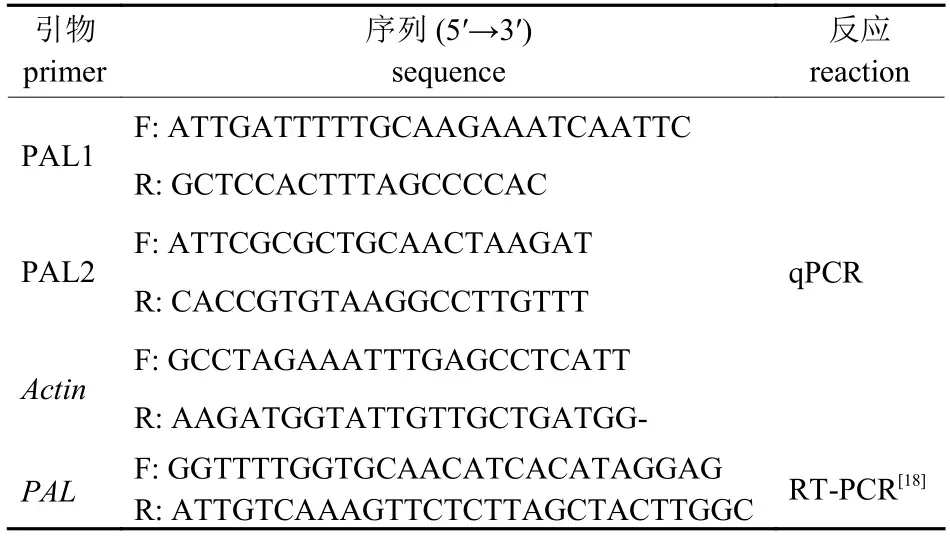
表1 反应引物Tab.1 Primers involved in the reaction
1.2.2 涮辣与昆明皱皮椒的PAL基因特性分析
基于Pepper Hub 与NCBI 公共数据库查找辣椒 (GeneID:107 843 098)与其他茄科植物PAL基因的上游2 000 bp 序列,在plant CARE 软件上预测上游顺式元件,用Microsoft Excel 365 筛选整理,TBtools 软件进行顺式元件可视化。使用DNAMAN 9 对涮辣和昆明皱皮椒PAL序列进行同一性分析,使用MEGA X 进行序列比对。
1.2.3 涮辣与昆明皱皮椒的PAL 蛋白特性分析
使用在线软件MEME 分析各物种PAL 氨基酸序列motif,并在TBtools 软件中进行可视化。蛋白结构域预测基于DART 与PFAM 工具;使用PORTPARAM 工具对涮辣与昆明皱皮椒 PAL蛋白理化性质进行预测;使用SOPMA 预测涮辣与昆明皱皮椒 PAL 蛋白二级结构;基于SWISSMODEL 在线工具对涮辣与昆明皱皮椒的PAL 蛋白三级结构进行预测,在预测结果中以GMQE(全局模型质量估计)值和QMEAN Z 得分衡量模型的准确性。GMQE 估计模型质量,其分数表示为介于0 和1 之间的数字,反映使用该对齐模板构建模型的预期准确性以及目标的覆盖范围,数字越大,即可靠性越高;QMEAN Z 得分在0 左右表示模型结构和类似大小的试验结构之间良好一致,-4.0 或以下分数表示模型质量低。用Pymol 2.4.1 软件对三级结构模型进行3D 渲染;使用SignalP-5.0、TMHMM 和NetPhos 预测二者PAL蛋白的信号肽、跨膜结构和磷酸化位点;运用PSORT Prediction 预测涮辣与昆明皱皮椒 PAL 的亚细胞定位。
1.2.4 进化树构建
在NCBI BLAST 上选择不同物种但同一性大于70%的PAL 氨基酸序列,使用 MEGA X 软件基于邻接法并设置Bootstrap method 为1 000,选择Poisson model 模型检验构建系统发育树,并使用ITOL 软件作图。
1.2.5 不同发育时期涮辣与昆明皱皮椒的PAL表达水平及酶活性测定
利用Primer-blast 设计qPCR 引物(表1),基于qPCR 测定PAL表达水平,使用KOUKOL[19]和王姣等[17]报道的方法提取不同发育时期的涮辣和昆明皱皮椒果实PAL 酶;使用分光光度计于290 nm 下测定其OD 值,PAL 活性以1 mL 酶液在1 h 内OD290nm的变化表示。
1.2.6 不同外源因子处理涮辣及PAL表达水平测定
选择脱落酸(ABA,0.5 mmol/L)、赤霉素(GA3,0.5 mmol/L)、过氧化氢(H2O2,30%水溶液)、茉莉酸甲酯(MeJA,0.1 mmol/L)、水杨酸(SA,0.1 mmol/L)和褪黑素(MT,0.1 mmol/L)6 种外源物质分别对果实胎座进行浸泡处理(处理时间:0、3、6、12 和15 h),其中0 h 为未处理样品,以管家基因Actin作为校正,测定PAL表达量。
2 结果与分析
2.1 涮辣与昆明皱皮椒的PAL 基因分析
2.1.1 涮辣和昆明皱皮椒的PAL基因碱基序列对比分析
涮辣和昆明皱皮椒PAL进行RT-PCR 特异性扩增并测序后,经BLAST 验证,二者与NCBI数据库中GeneID:107843092 的辣椒PAL类基因序列同一性高达99%以上。开放阅读框预测显示:涮辣PAL基因2 166 bp,编码721个氨基酸残基;昆明皱皮椒PAL基因2 154 bp,编码717个氨基酸残基。同一性分析结果显示:涮辣与昆明皱皮椒PAL碱基序列同一性为98.71%。涮辣与昆明皱皮椒PAL基因序列比对结果表明:涮辣存在12个碱基插入,且涮辣PAL存在16个SNP 位点,分别为:20 (A-T)、53 (T-G)、239 (C-G)、452 (G-A)、771 (G-A)、786 (A-C)、1095 (A-T)、1527 (A-G)、1711 (T-C)、1759 (A-C)、1917 (T-C)、1992 (G-C)、2091 (G-C)、2103 (G-A)、2104 (A-G)和2106 (T-C)。
2.1.2 辣椒及其他常见茄科植物PAL上游顺式元件预测
对茄科中除辣椒外的番茄、马铃薯、潘那利番茄和普通烟草的PAL基因上游顺式元件进行预测,结果共预测到447个顺式元件,其中马铃薯109个,潘那利番茄78个,普通烟草71个,番茄79个,辣椒109个 (图1)。所有预测到的顺式元件共有11 种,按类型可分为:①核心启动元件:启动子和增强子区、-30 转录起始位点;② 植物激素响应元件:脱落酸(ABA)、赤霉素(GA)、水杨酸(SA)、茉莉酸甲酯(MeJA)和生长素(Auxin)响应元件;③环境响应元件:防御与胁迫响应、光响应元件;④ 转录因子响应结合位点:光响应MYB 结合位点、干旱诱导MYB 结合位点。

图1 辣椒及其他常见茄科植物PAL 基因上游顺式元件预测Fig.1 Prediction of cis-element upstream of PAL genes in pepper and other Solanaceae plants
在辣椒中除存在核心启动元件外,还存在1个GA 响应元件,10个光响应元件和1个干旱诱导MYB 结合位点。由预测结果可推测:在辣椒PAL基因的表达调控中,其受GA 等植物激素和光的调控,另外在对干旱胁迫响应过程中,MYB类转录因子也参与此调控过程。
2.2 涮辣与昆明皱皮椒 PAL 蛋白特性分析
2.2.1 不同物种PAL 蛋白保守结构分析
选取包括茄科、十字花科、木犀科和菊科4个科共22 条PAL 氨基酸序列进行保守motif 分析,结果(图2)显示:共得到20个显著保守的motif,其中,包括涮辣与昆明皱皮椒在内的所有植物都含有15、4、6、16、10、9、1、3、13、2、8、5、12 和7 等14个不同保守motif。由此可推测:以上14个保守motif 是PAL 蛋白结构的重要组成部分,且是保证不同物种之间PAL 功能相似的决定性结构。对辣椒而言,除Capsicum baccatum之外的辣椒含有17 和20 两个特有保守motif,而C.chinense、C.annuum和涮辣相对于昆明皱皮椒含特有的motif 19。蛋白结构域分析结果显示:涮辣和昆明皱皮椒PAL 属于cl30215 超家族中PLN02457 保守蛋白结构域家族,存在PLN 0457 结合位点,同时属于lyases家族,包含芳香裂解酶结构域。

图2 不同物种PAL 蛋白氨基酸motif 分析Fig.2 Motif analysis of amino acids in PAL proteins of different species
2.2.2 涮辣与昆明皱皮椒 PAL 理化性质分析
蛋白理化性质预测结果显示:涮辣与昆明皱皮椒 PAL 蛋白分子式分别为C3436H5533N965O1057S32和C3418H5509N959O1051S33,分子量分别为78.30 和77.91 ku,理论等电点(IP)为 6.26 和6.31,均为脂溶性、亲水性的稳定蛋白。亚细胞定位预测结果显示:两者PAL 定位在质膜的确定性为0.700,在微体(过氧化物酶体) 的确定性为0.300,在内质网膜上的确定性为0.200,在线粒体内膜上的确定性为0.100。
2.2.3 涮辣与昆明皱皮椒的PAL 蛋白二级结构分析
预测结果(图3)显示:2个品种辣椒PAL 蛋白含有4 种二级结构,包括α 螺旋、延伸链、β 转角和无规卷曲,其中α 螺旋与无规卷曲占主要部分(涮辣:85.02%;昆明皱皮椒:86.19%)。昆明皱皮椒 PAL 蛋白中无规卷曲与延伸链多于涮辣,α 螺旋和β 转角却少于涮辣PAL。

图3 涮辣与昆明皱皮椒 PAL 蛋白二级结构Fig.3 Secondary structures of PAL proteins in ShuanLa and Kunming wrinkled pepper
2.2.4 涮辣与昆明皱皮椒的PAL 蛋白三级结构分析
SWISS-MODEL 预测结果(图4)显示:涮辣的PAL 蛋白模型GMQE 值为0.85,QMEAN Z得分为-0.66;昆明皱皮椒的GMQE 值为0.85,QMEAN Z 得分为-1.82,表明本次预测的涮辣和昆明皱皮椒 PAL 蛋白质三级结构准确性高,模型可靠。

图4 涮辣(a)与昆明皱皮椒 (b) PAL蛋白三级结构预测图Fig.4 Prediction of tertiary structures of PAL proteins in ShuanLa (a) and Kunming wrinkled pepper (b)
2.2.5 涮辣与昆明皱皮椒的PAL 蛋白信号肽、跨膜结构分析和磷酸化位点预测
SignalP-5.0 与TMHMM Server v.2.0 预测结果(图5)显示:涮辣和昆明皱皮椒 的PAL 蛋白均无信号肽与跨膜结构。使用NetPhos 3.1 Server 对涮辣与昆明皱皮椒 PAL 蛋白磷酸化位点预测,同时对预测位点在0~1 区间内进行打分,预测位点可信度随得分从0.5 到1 增加而增加,涮辣与昆明皱皮椒 PAL 中评分大于等于0.5 的磷酸化位点均为81个。对同一位点,以最高得分的氨基酸残基类型为准进行筛选,涮辣与昆明皱皮椒均筛选到58个得分最高的磷酸化位点;在涮辣中S 型30个,T 型21个,Y 型7个;昆明皱皮椒中S 型31个,T 型20个,Y 型7个。

图5 涮辣(a)与昆明皱皮椒(b) PAL 蛋白磷酸化位点预测结果Fig.5 Results of predicting the phosphorylation sites of PAL protein in ShuanLa (a) and Kunming wrinkled pepper (b)
2.2.6 不同物种PAL 系统发育树构建与分析
以选取的包括涮辣和昆明皱皮椒在内共22 条PAL 序列构建进化树,结果(图6)表明:PAL 序列在系统发育上按照4个不同的科,聚为四大类群。其中,茄科植物中PAL 又分出众多亚支。涮辣和昆明皱皮椒PAL 与同科同属的C.chinense和C.annuum在系统发育上亲缘关系最近,与C.baccatum最远;不同属中,与茄属的亲缘关系最近;不同科中,与木犀科最近,与十字花科亲缘关系最远。
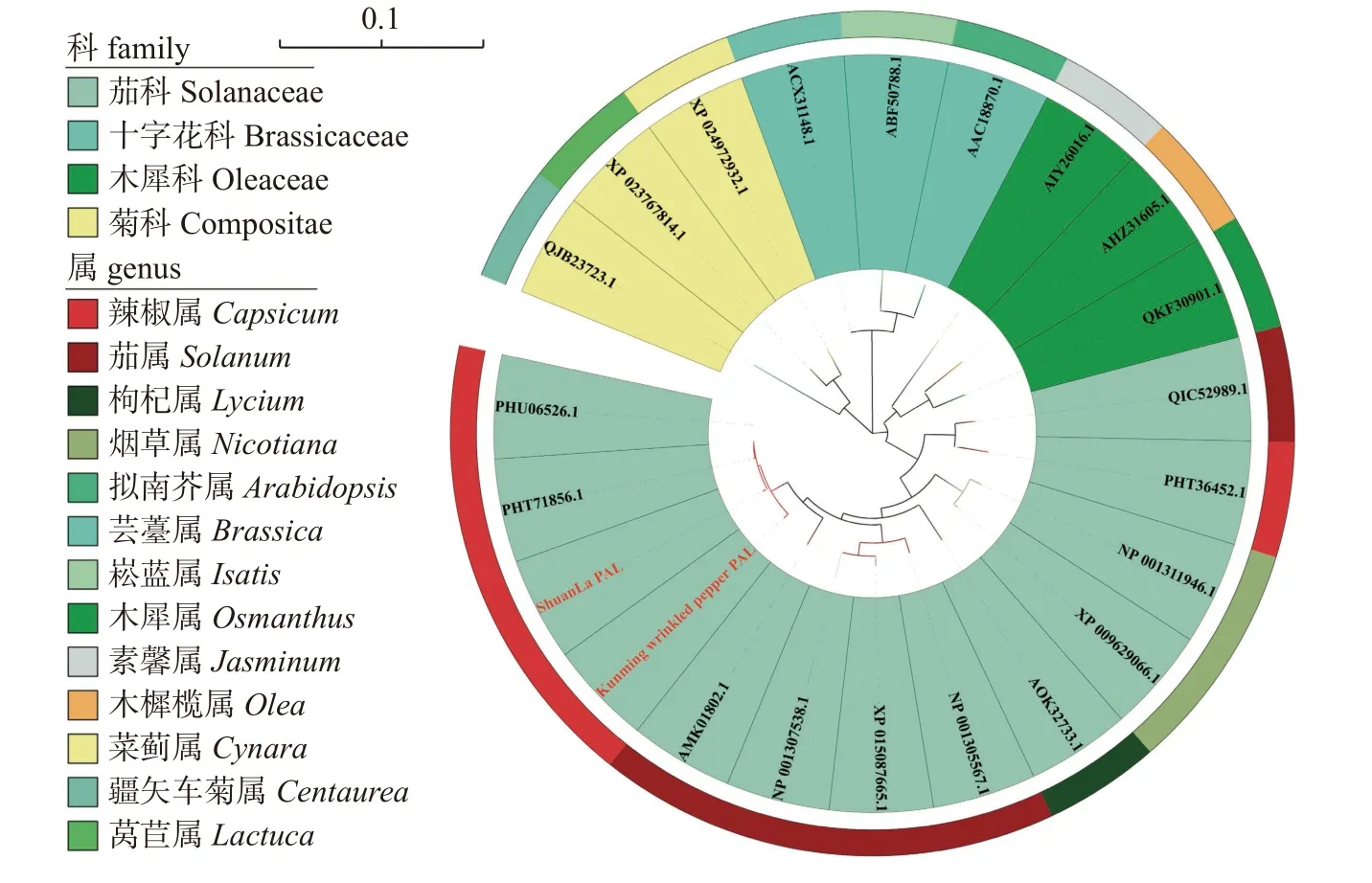
图6 不同植物PAL 蛋白系统发育树Fig.6 Phylogenetic trees of PAL proteins of different plants
2.3 涮辣与昆明皱皮椒 PAL 基因表达及酶活性分析
2.3.1 不同材料与环境条件下PAL基因表达分析
由图7 可知:PAL基因的表达在不同栽培环境下及2 种辣椒之间差异十分明显。PAL基因在辣椒果实发育中的表达趋势为先缓慢升高后急剧降低。在果实发育前期(10 d),该基因的表达处于较高阶段;在果实发育中期(20~40 d),该基因的表达处于高位,在第40 天达到峰值;在辣椒果实发育后期,该基因的表达急剧下降,在第70 天达到最低。同一环境下,涮辣PAL表达水平整体高于昆明皱皮椒,且在第50 天时,露地条件下涮辣PAL的表达量是昆明皱皮椒的4 倍。而在果实整个发育时期,露地栽培环境下的涮辣PAL表达量皆高于大棚栽培;而在发育的大部分阶段,露地栽培条件下昆明皱皮椒PAL的表达量也高于大棚栽培。

图7 涮辣与昆明皱皮椒 PAL 在不同发育时期、不同环境下相对表达量与酶活性Fig.7 The relative expression levels and enzyme activities of PAL in ShuanLa and Kunming wrinkled pepper at different developmental stages and under different environments
2.3.2 在果实不同发育阶段和环境条件下PAL 酶活性差异
由图7 还可知:在辣椒果实发育过程中,PAL 酶活性先缓慢升高后急剧降低。在果实发育的中期(20~40 d),该酶活性处于高位,并在第40 天时达到峰值;之后,随发育时间的延长该酶活性急剧下降,在第70 天达到最低。在栽培环境中,涮辣PAL 酶活性皆高于昆明皱皮椒,在发育至30 d 时,其露地栽培条件下的酶活性是昆明皱皮椒的2.5 倍。就同种材料不同环境而言,大棚栽培条件下PAL 酶活性在发育的7个阶段都低于露地栽培。
2.4 不同外源物质对涮辣PAL 基因表达的影响
由图8 可知:除GA3处理为外,其他5个外源物质对涮辣PAL表达的影响总体趋势均为先升高后降低。从整体上看,PAL基因的表达对ABA、GA3、MeJA 和SA 处理的反应较为明显,对H2O2和MT 处理响应较低。在ABA 和MeJA处理下,PAL在3 h 时表达量最高,随后随时间增加而降低;在H2O2与SA 处理下,PAL在6 h时表达量最高;对于GA3处理而言,涮辣PAL在处理后0~3 h内呈升高趋势,在3~6 h内呈下降趋势,且在6 h 时表达量几乎降为0,而后在6~15 h 内,其表达量随时间增加而增加,直至15 h 表达量最高;在MT 处理下,PAL表达水平随处理时长变化而变化,在3~6 h 持续下降,随后直到12 h 持续上升,然后至15 h 内下降。

图8 不同外源因子对涮辣PAL 表达的影响Fig.8 Influence of different exogenous substances on the expression of ShuanLa PAL
3 讨论
3.1 涮辣与昆明皱皮椒 PAL 基因及蛋白特性存在差异
PAL 广泛分布于高等植物中,是苯丙烷途径中的关键酶,参与苯丙烷类化合物前体的生物合成[20-21]。本研究利用同源克隆的方法从涮辣与昆明皱皮椒中分离鉴定出PAL基因开放阅读框,其中涮辣PAL基因共2 166个碱基,编码721个氨基酸残基;昆明皱皮椒PAL基因共2 154个碱基,编码717个氨基酸残基。基于生物信息学方法,对涮辣与昆明皱皮椒PAL基因、蛋白特性与进化关系进行预测和分析。上游顺式元件预测结果揭示了辣椒PAL可能受GA 调控,另外辣椒PAL具有光响应元件与干旱诱导MYB 结合位点,结果与前人研究结果[14]相符。
涮辣与昆明皱皮椒 PAL 蛋白分子量分别为78.30 和77.91 ku;理论等电点分别为 6.26 和6.31;2 种辣椒PAL 蛋白带负电荷残基总数大于带正电荷残基总数;二者皆是脂溶性、亲水性的稳定蛋白。PAL 细胞定位主要在质膜上,而在微体、内质网膜和线粒体膜上的可能性较小,与黄小贞等[22]的研究相似。通过对不同物种PAL 氨基酸序列保守motif 分析,在一定程度上反映了PAL具有较高的保守性,但部分物种PAL 包含特有motif,也说明了不同物种对PAL 蛋白功能的需求存在差异。同时,不同辣椒PAL 蛋白保守结构之间的差异可能是辣椒素生物合成产生差异的重要原因。
蛋白保守结构域预测结果显示:涮辣与昆明皱皮椒 PAL 存在PLN 0457 结合位点,包含芳香裂解酶结构域(lyase aromatic),与玉米、山葡萄和荸荠等[23-25]植物中PAL基因报道一致,可知涮辣与昆明皱皮椒 PAL 属于lyases 家族的一员。在辣椒PAL 蛋白二级结构中含有大量α 螺旋与无规卷曲,与冯立娟等[26]对石榴 PAL 的预测结果相符。CALABRESE 等[27]用X 射线晶体学描述了PAL 的三维结构,结果显示:每个亚基含有716个残基,其分子质量为76.88 ku,每个亚基呈海马形状,与其他2个亚基头尾相连,最大限度地增加了相邻亚基的相互作用,并产生1个紧密配合的四聚体。涮辣与昆明皱皮椒 PAL 蛋白三级结构的预测结果符合PAL 晶体学结构。涮辣与昆明皱皮椒 PAL 蛋白无信号肽与跨膜结构,结果与马铃薯PAL[28]相符。PAL 蛋白磷酸化位点预测显示:二者都具有58个磷酸化位点,而在枸杞和马铃薯等茄科[2,26]植物皆预测到PAL 磷酸化位点,但现有磷酸化蛋白质组学研究未能证实PAL 磷酸化[29-30],所以对于PAL 蛋白是否进行磷酸化还需要进一步研究。PAL 系统发育树结果表明:PAL 在遗传过程中保守性较高,结果与盖江涛等[4]的报道相符。
3.2 PAL 参与环境、外源因子对辣椒的调控并且影响辣椒素积累
由PAL 参与的苯丙烷途径在植物发育过程中发挥重要作用,其产生的次生代谢物如辣椒素和木质素等参与植物发育过程中相关结构的构成[11,31]。本研究测定了不同发育时期和环境条件下涮辣与昆明皱皮椒PAL相对表达量与酶活性,结果表明:PAL 在辣椒果实发育过程中的酶活性基本和表达水平成正比,趋势为先缓慢升高后急剧降低,并在果实发育中期达到最高,说明PAL 在辣椒果实发育的前、中期影响较大。植物进化出多种防御信号途径应对环境胁迫和病原体攻击,苯丙烷途径为其中1 条重要的代谢途径[32]。相关研究结果表明:低温等外界环境因子可诱导PAL快速表达[33-35]。在本研究中,就同一材料而言,露地栽培的辣椒PAL表达量与酶活性高于大棚栽培,故推测露地与大棚2 种不同的栽培条件下环境因子的差异对PAL 酶活性及表达有影响,如低温等因素可能诱导辣椒PAL较高表达,以产生较多次生代谢物质来抵御环境胁迫。通过不同外源物质对涮辣进行处理,从整体上看,除H2O2和MT 对涮辣PAL表达影响较小外,ABA、GA3、MeJA 和SA 处理的影响都较为明显。相关研究也报道了在一定时间内ABA、GA、SA 和MeJA等植物外源激素能够诱导植物PAL表达增加[35-37]。PAL 作为辣椒素生物合成的关键酶,已有研究报道涮辣中PAL 酶活性与辣椒素含量成正比[17]。同一栽培环境下,涮辣PAL的表达量与酶活性高于昆明皱皮椒,结合本研究中涮辣PAL表达量与其酶活性的正比关系,暗示涮辣PAL基因的高表达可能是其辣椒素含量极高的原因。
4 结论
涮辣与昆明皱皮椒PAL基因和蛋白存在差异,在进化关系上具有保守性。同时PAL 在涮辣和昆明皱皮椒生长发育过程中有重要功能,并且参与外源物质的调控。

