细胞冻融策略优化及设备研究进展
赵芷慧 黄永华
(上海交通大学机械与动力工程学院 上海 200240)
Arrhenius公式指出在低温下生物样品内的酶活性受到抑制,化学反应减慢到近乎停滞,因此理论上可实现生物材料低温下的长期保存[1]。1949年两位英国生物学家发现在甘油溶液中的精子能够经历从常温到低温的巨大温度跨度而不死亡[2],这被视为生物样品低温保存的首次成功尝试。低温冻存技术已在很多领域发挥重要作用[3-6]:在细胞治疗手段中,细胞组织等生物材料长期保存及高效冷链供应,保证有限资源合理利用;血红细胞、干细胞、免疫细胞等低温保存帮助实现再生治疗及异体移植;精子、卵母细胞、卵巢组织、胚胎和植物种子等低温保存帮助实现人类辅助生殖治疗以及珍稀动植物种保存等。本文阐述了细胞冻存典型方式及损伤机理,对细胞冷冻策略优化及设备研究的进展分类总结,重点梳理了在升降温策略及载体设备层面的进展。
1 典型冻存方式及冷冻损伤
1.1 冻存方式
自然界内固体主要以晶体态和玻璃态两种形式存在。液体转化成固体可通过两种方式实现[7]:一为非连续的晶态相变;二为连续的玻璃化转变,形成高黏度的非晶体,是晶核产生与生长速度和降温速度竞争对抗的结果,通常需要足够快的降温速度。上述两种不同的途径与形态对应两种低温冻存形式:程序化慢速冷冻和玻璃化快速冷冻。
前者将生物材料放入低温保护剂中进行预处理,然后以较慢(对于经过处理的多数哺乳动物细胞,一般为1 ℃/min)且可控的速度将样品降温至零下某一温度,再移入液氮中长期保存,复温则多采用水浴方式。目前多沿用K. Oktay等[8]提出的经典方案或优化改进,其应用相对广泛和成熟,但操作经验相关性强,产生低温损伤可能性大。
后者一般使用较高浓度的低温保护剂和超高降温速度,使样品凝固成无定形状态,然后移入液氮中长期保存,复温时也需采用相同量级甚至更快的方式。目前动物及人类的生殖细胞和干细胞已实现玻璃化冷冻[9-10]。可显著降低冷冻损伤,但还不具有普适性。
1.2 冷冻损伤
关于生物材料从常温到低温的大温区跨度产生的冷冻损伤机理有多种解释,包括:渗透性和机械损伤,氧化性损伤(oxidative stress, OS)和低温保护剂(cryprotectants, CPAs)毒性损伤等[1,11]。这里简要介绍P. Mazur等[12]提出的两因素假说,他认为有两个独立因素造成冷冻损伤:1)胞内冰晶损伤,冰晶生长刺穿和挤压细胞膜,破坏细胞器,从而破坏细胞活性及正常功能;2)溶质损伤,细胞冷冻过程因为内外渗透压差而脱水,细胞膜受压力,细胞内电解质浓度增加,导致细胞蛋白质、溶酶体和细胞膜损伤。不同降温速度时细胞冻存状态如图1所示。在慢速冷却过程中,如果降温速度过慢,部分细胞外液先于细胞内液结晶,细胞外液浓度增高,细胞内外的渗透压差使细胞内水分向外渗透,过度脱水导致溶质损伤;如果降温速度过快(但未达到玻璃化冷冻),细胞内部的水分来不及外渗,过冷产生冰晶,造成胞内冰晶损伤。因此,慢速冷冻将会存在一个最佳降温速率,且该速率与细胞比表面积、膜渗透性等相关,不同细胞有不同的最佳冷冻速率,但即使处于最佳冷冻速率仍无法完全避免上述两种低温冷冻损伤[13-14]。
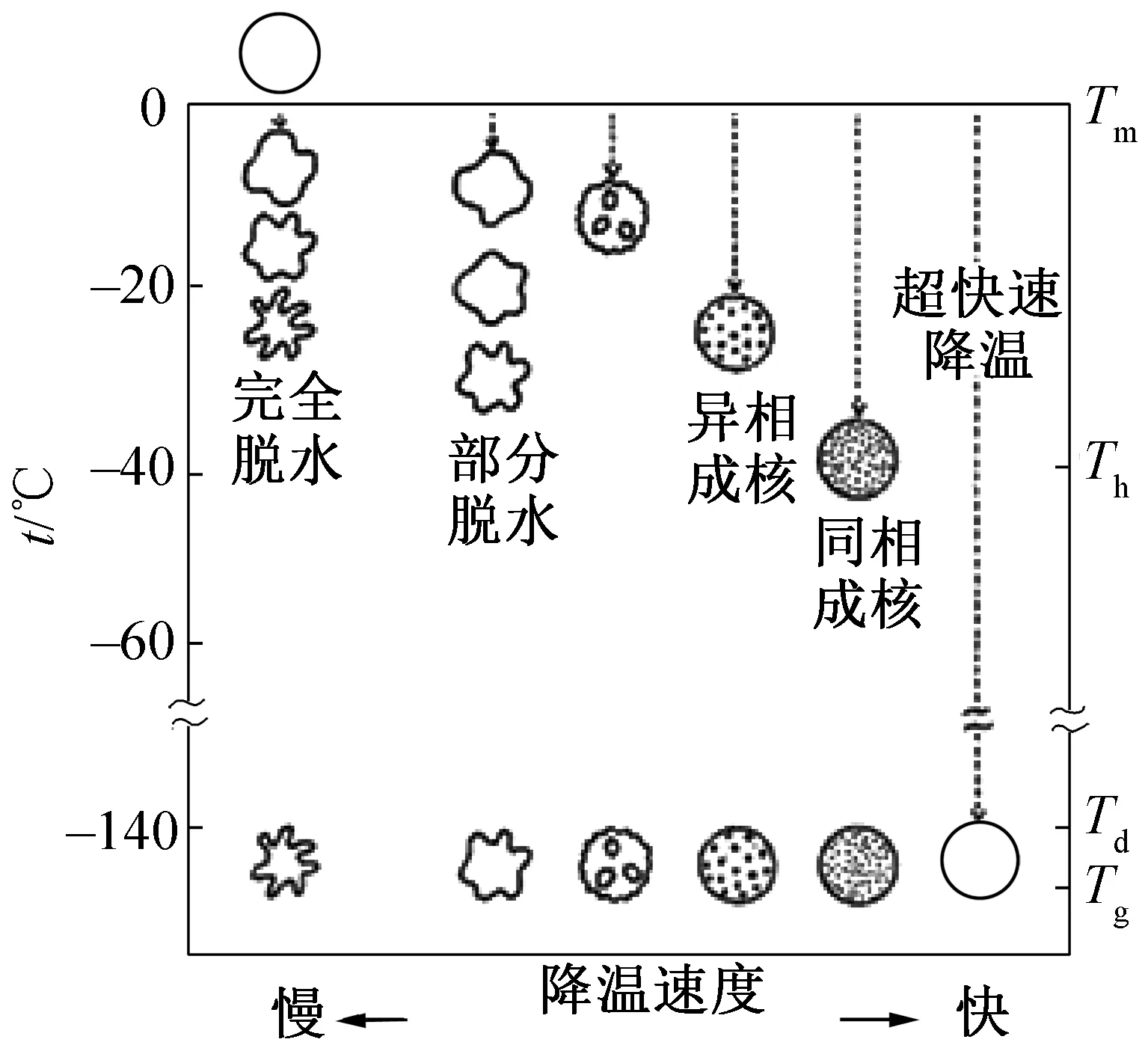
图1 不同降温速度时细胞冻存状态[15]
理论上,完全玻璃化冷冻时细胞内液直接进入高黏度的玻璃态,无冰晶产生,且时间极短,细胞内浓度无明显变化,可避免低温损伤。但水来实现完全玻璃化转变所需要的最小降温速率(即临界降温速率)为107~108℃/min[16],几乎无法实现。而通过加入低温保护剂,可降低临界降温速度[17]。但高浓度低温保护剂的副作用是产生细胞毒性(包括膜透化和渗透损伤),故细胞完全玻璃化冷冻难以实现。但幸运的是,细胞可承受一定程度的小冰晶,因此没有必要实现完全的玻璃化冷冻[18]。
玻璃化快速冷冻过程成核危险区可用图2表示,其中Tm为熔融温度;Th为均相成核温度;Tg为玻璃化转化温度;Td为反玻璃化转变温度。降温时,Tm-Tg间为冰晶快速生长危险区域,复温时Td-Tm为冰晶再生长的重结晶危险区域。对于玻璃化快速冷冻,需要尽量减小危险区温跨范围并快速经过,为了避免重结晶对细胞造成的损伤,复温速度通常要等于或高于临界降温速度[19]。
细胞低温冻融的基本操作步骤可总结为:添加低温保护剂、降温冻存、复温、去除低温保护剂,最后使用。以此可提取细胞冻融3个关键要素:1)不同细胞本身特性,如冷适应性、体积、形状、比表面积和膜特性等[13,21];2)细胞外环境,如保护剂溶液的种类、浓度和添加物等[22-24];3)升降温策略,如升降温速率、终止温度、保持时间等[25-28]。
2 细胞冻存的优化策略与设备的进展
细胞冻存优化策略如表 1所示,以提高成功率为目的优化方法可从细胞、细胞外环境和升降温策略3个层面进行分类:对细胞层面的策略包括受生物启发的仿生结构设计、海藻糖输送技术、冷冻前压力预处理等;细胞外环境层面的策略包括高效低毒性低温保护剂(CPA)合成、添加抗冻蛋白(antifreeze proteins, AFP)和抗冻糖蛋白(antifreeze glycoproteins,AFGP)、添加合成聚合物、添加抗氧化剂、添加纳米颗粒、细胞封装技术等;升降温策略及载体设备层面的改进包括以减小体量和强化传热为目标的新型载体设备、微流体技术及相关冷冻设备、物理场应用等。本文主要总结升降温策略及载体设备层面的进展,尤其针对玻璃化快速冷冻。由于材料性质(载体物性、生物材料尺寸等)及传热方法是升降温速率的主要决定因素,对于升降温策略及载体设备的改进方向主要是:减小待冷冻样本体量以减小热阻和强化传热。
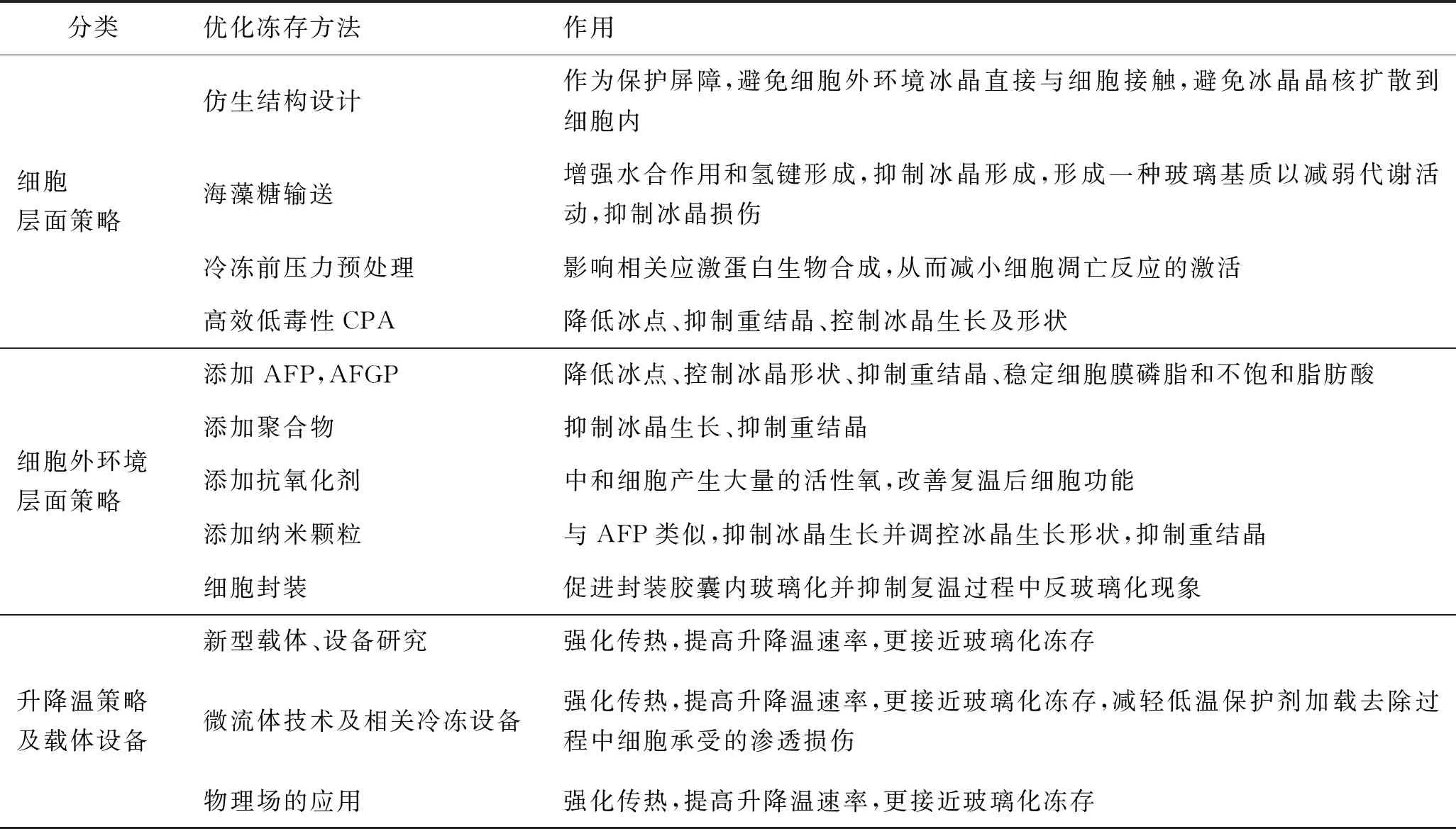
表1 细胞冻存优化策略
2.1 玻璃化冷冻载体
玻璃化冻存,要求有合适的冻存载体,如表2和图3所示。冷冻载体按形状大致可分为细管形和环网形两种。
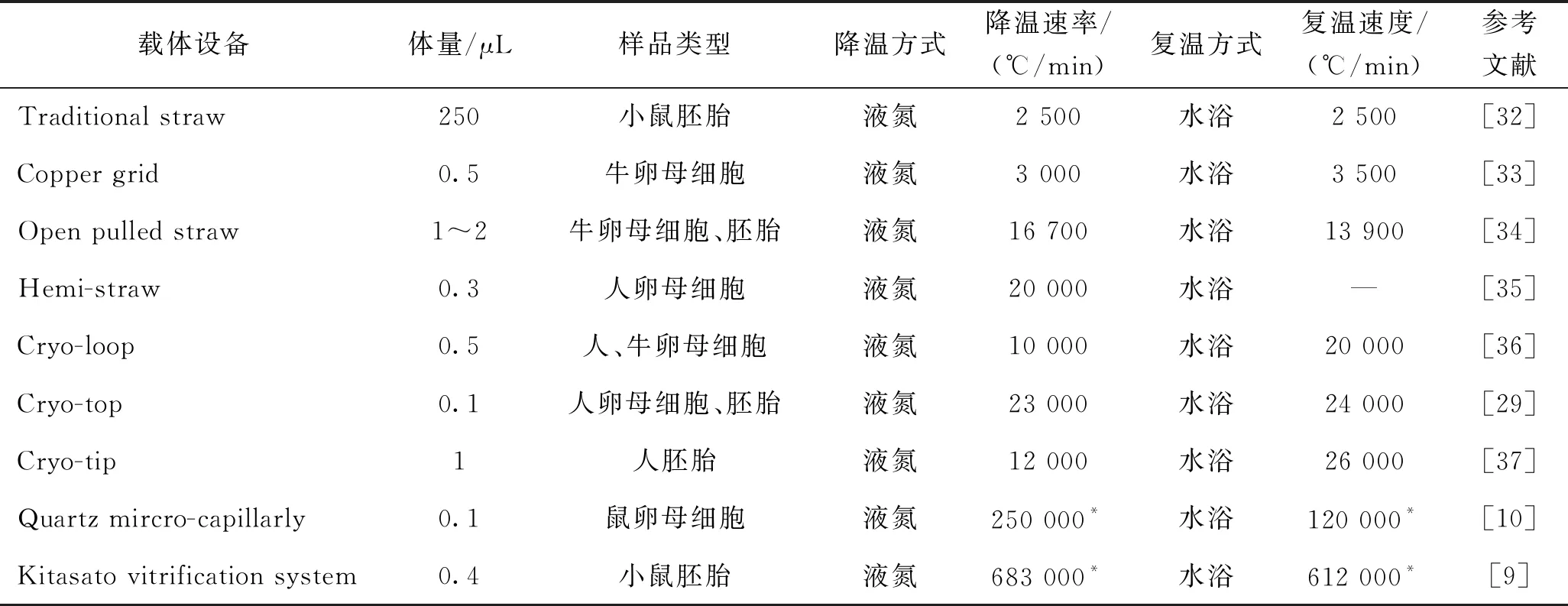
表2 典型玻璃化快速冷冻载体

图3 典型玻璃化快速冷冻载体
与Traditional straw相似,Open pulled straw(OPS)、Hemi-straw、Quartz mircro-capillarly(QMC)、Cryo-tip、Cryo-top和Kitasato vitrification system (KVS)均为细管式结构,但减少了样本容量,其升降温方式主要是投入液氮中降温、水浴中复温。OPS和Hemi-straw的管壁更薄内径更小,但仍沿用塑料材质;QMC则采用熔融石英毛细管代替塑料获得导热性能的提升。Cryo-top进一步减低载样量,在一些卵母细胞冻存实验中展现了更好的保存效果[29]。此类细管形的玻璃化快速冷冻载体仍在不断被改进,如2017年K. Momozawa等[9]提出一种 KVS方法,更容易控制低温保护剂体积,载样量为0.4 μL,并可通过体视显微镜观察置样情况,模拟计算显示该方法获得了更高的升降温速率。与上述载体不同,Copper grid和Cryo-loop等则是环网状载体的代表,通过铜网格或低温保护剂溶液表面张力形成的薄膜加载样品。它们的单次处理细胞数量有限,且细胞回收分离存在一定困难。需要说明的是,OPS、QMC、Cryo-top、Copper grid、Cryo-loop等载体生物样品会直接与液氮接触,存在污染的风险。C. J. Tiersch等[30]利用3D打印技术制作不同尺寸的圆环状玻璃化冷冻载体,可在控制成本情况下满足玻璃化冷冻、体积控制、标记、保护储存样本等功能。A. Arav等[31]使用一种以细管状载体,投入液氮溶液中为形式的新型玻璃冷冻仪器进行卵母细胞的冻融实验,该仪器操作简单,自动化程度高,可标准化精确设置样品在不同浓度保护剂溶液的暴露时间,实现了18 000 ℃/min的降温速度和21 454 ℃/min的复温速度。
2.2 液滴玻璃化冷冻
除了细管状和环网状玻璃化冷冻载体,还发展出一种以液滴形式进行玻璃化快速冷冻的方法,具体存在两种形式,如图4所示。
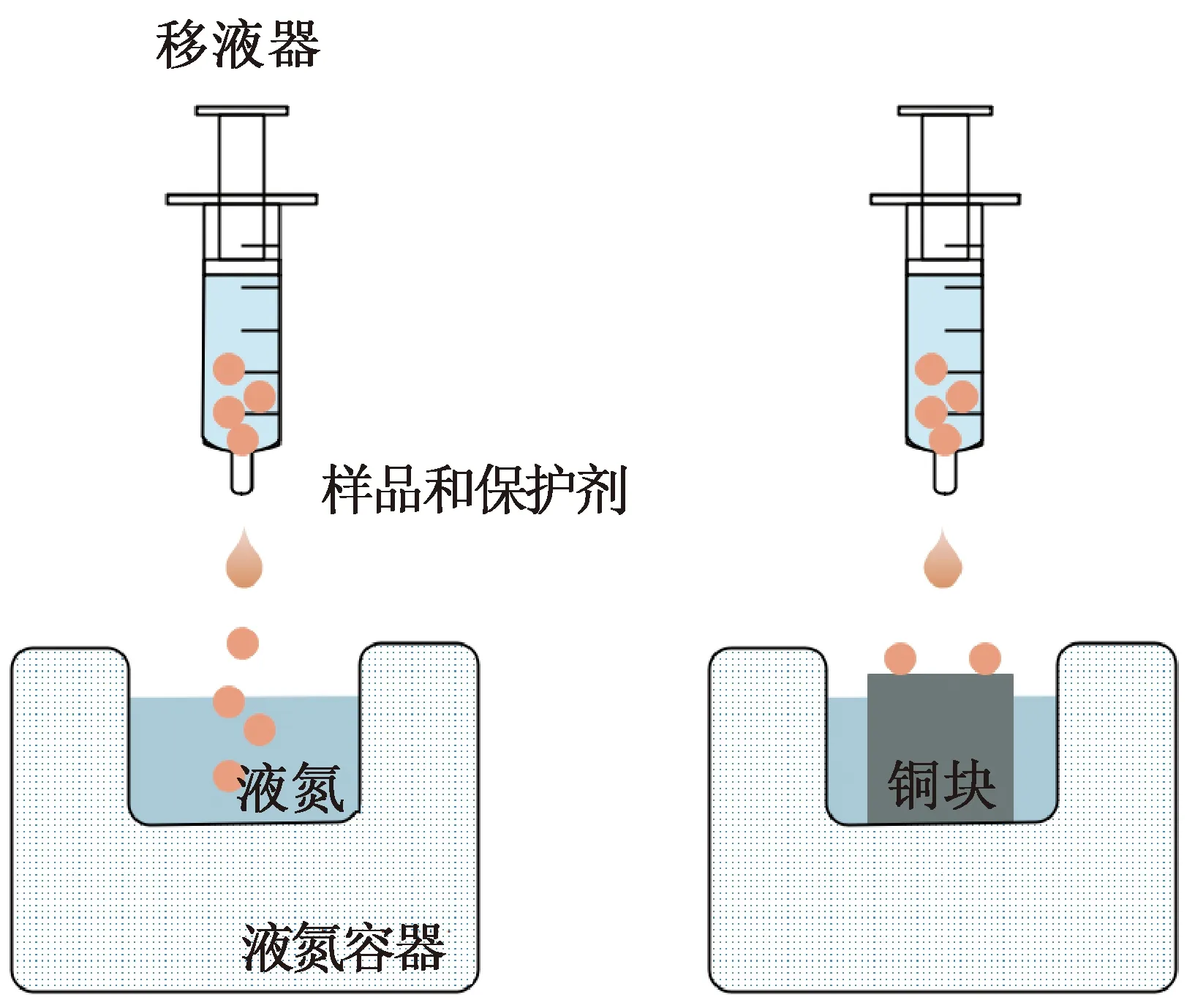
图4 液滴形式玻璃化冷冻
1)液滴直接接触液氮冷却法:将载有细胞和低温保护剂的液滴直接滴入液氮中[38-39]。V. Landa等[38]较早将小鼠胚胎以液滴形式投入液氮冷冻,液滴体积为5~20 μL,尺寸较大且稳定可控性差,升降温速率有限。需要注意的是,方法1)因样品与液氮直接接触,可能对样品产生污染,造成样品再收集困难,且与液滴直接接触的液氮会汽化,并在周围形成一层蒸气包裹液滴,从而增大传热热阻降低传热效果,即产生Leidenfrost现象[16]。直接将液滴滴入液氮同时观测细胞内外冰晶形成情况变得不可实现。
2)液滴接触预冷固体表面冷却法(solid-surface vitrification,SSV):用液氮将导热良好的固体金属预冷,再将载有细胞和低温保护剂溶液的液滴滴在该金属表面[40]。第二种方法在一定程度上可以避免Leidenfrost现象,也使通过显微成像系统研究成为可能。方法2)的液滴玻璃化冷冻方法取得了一些创新进展,主要体现在结合喷射、微流控、细胞打印等技术以可控且稳定的获得体积更小的含样液滴。R. El Assal等[41]通过微注射泵和氮气输送装置组成喷射装置,如图5(a)所示,由聚乙烯薄膜接收含样液滴,将喷有微滴的聚乙烯薄膜浸入无菌液氮中实现玻璃化冷冻。Shi Meng等[42]研发了一种基于超薄银膜和细胞打印机的非接触式液滴玻璃化冷冻装置,如图5(c)所示,该装置具有两个腔室分别提供冷/热量的液氮/水室和盛放样品液滴的样品室,两腔室中间由一层超薄银膜隔开,含样液滴被打印在银膜上,通过银膜与液氮或水接触实现功能。如图5(b)所示,Y. Akiyama等[43]利用压电控制喷墨设备和两轴自动移动台将含有生物样本的液滴打印到一端浸入液氮中预冷的基底上,实现无低温保护剂的玻璃化冻存,数值显示最高降温速率可达37 000 ℃/min。Xia Yu等[44]改用声学液滴喷射装置进行3种不同细胞SSV实验,实现了精确、高速、低保护剂浓度、稀有细胞冻存。Zhang Yu等[45]使用一种新型CryoLogic玻璃化冷冻(cryologic vitrification method, CVM)方法,该方法将样本液滴承载在钩状载体上,再将接触预冷的固体表面实现样品液滴玻璃化冷冻,为hiPSCs安全存储提供了新的方式。
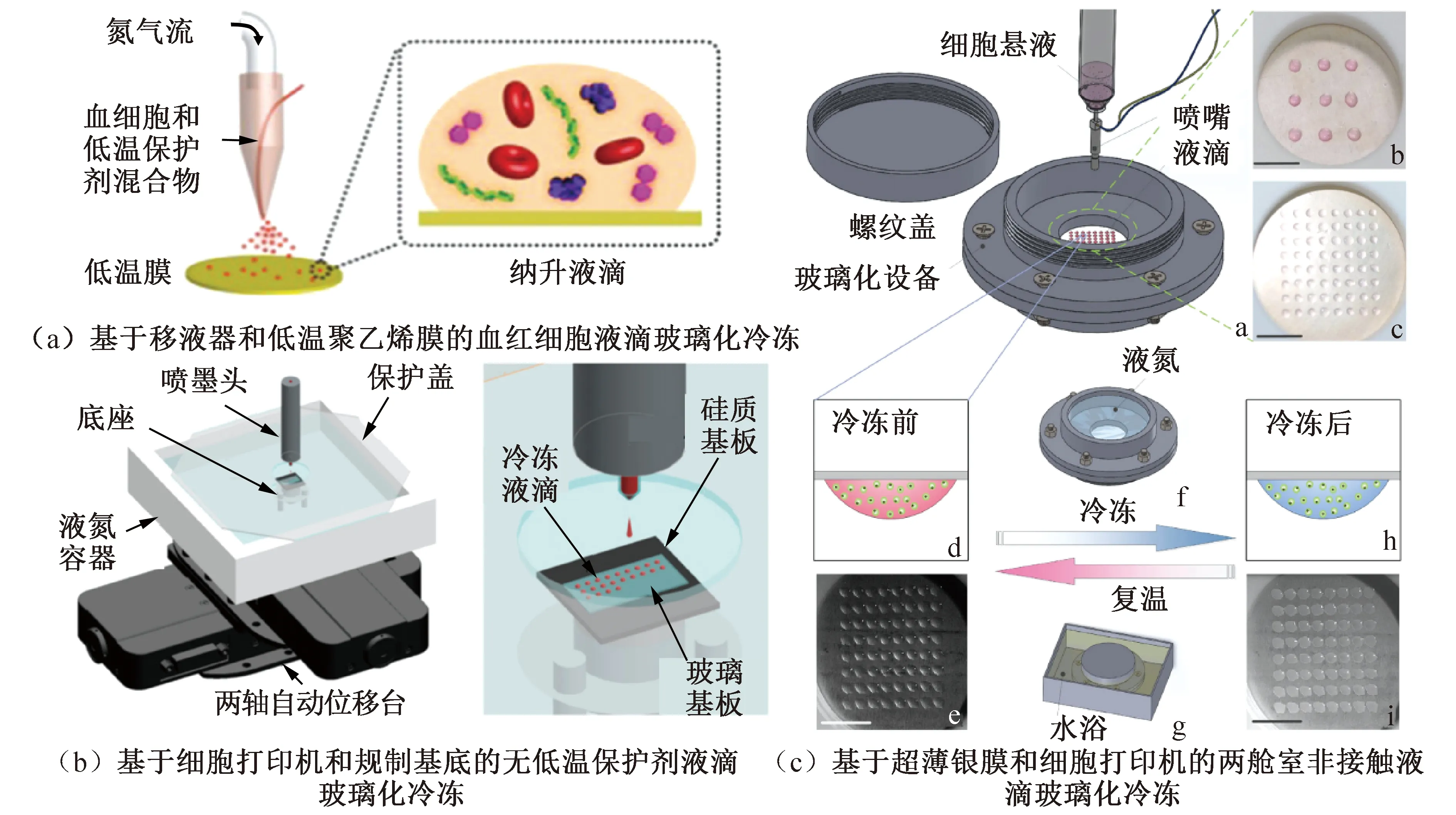
图5 三种液滴玻璃化冷冻装置
2.3 微流体技术及相关冷冻设备
微流体技术是指在微观尺度下(1 μm~1 mm)控制和操作复杂流体的技术,由于与细胞尺度相当,可对细胞进行操作与控制。微流体技术在细胞冻存领域主要有3个应用方向:细胞膜渗透特性测量与研究、低温保护剂添加与去除,以及包括微流体封装及微通道一体芯片等的冻存方法及设备。本文将集中介绍后两种。
通常细胞冻存的基本流程包括低温保护剂的添加与去除,过程中细胞在不同浓度的溶液间转移。传统操作中细胞内外渗透压会发生突变,可能对细胞造成渗透性损伤。微流体技术则为细胞外环境中低温保护剂浓度连续变化提供可能,从而减小低温保护剂带来的渗透性损伤。Y. S. Song等[46]研制了一个水平三入口的微流体低温保护剂添加装置,如图6(a)所示,两边为保护剂溶液入口,中间为细胞样品入口,实现了沿通道方向保护剂浓度的连续改变,实验证明后细胞存活率有所提高。如图6(b)所示,Zheng Yuan等[47]设计法微流体装置将低温保护剂和细胞悬液分别从两个入口引入,先后经过流动聚焦区域、蛇形通道混合区域和平行通道平衡区域,实现连续的保护剂溶液添加,经过液氮冷冻及水浴复温后,提高了细胞存活率。
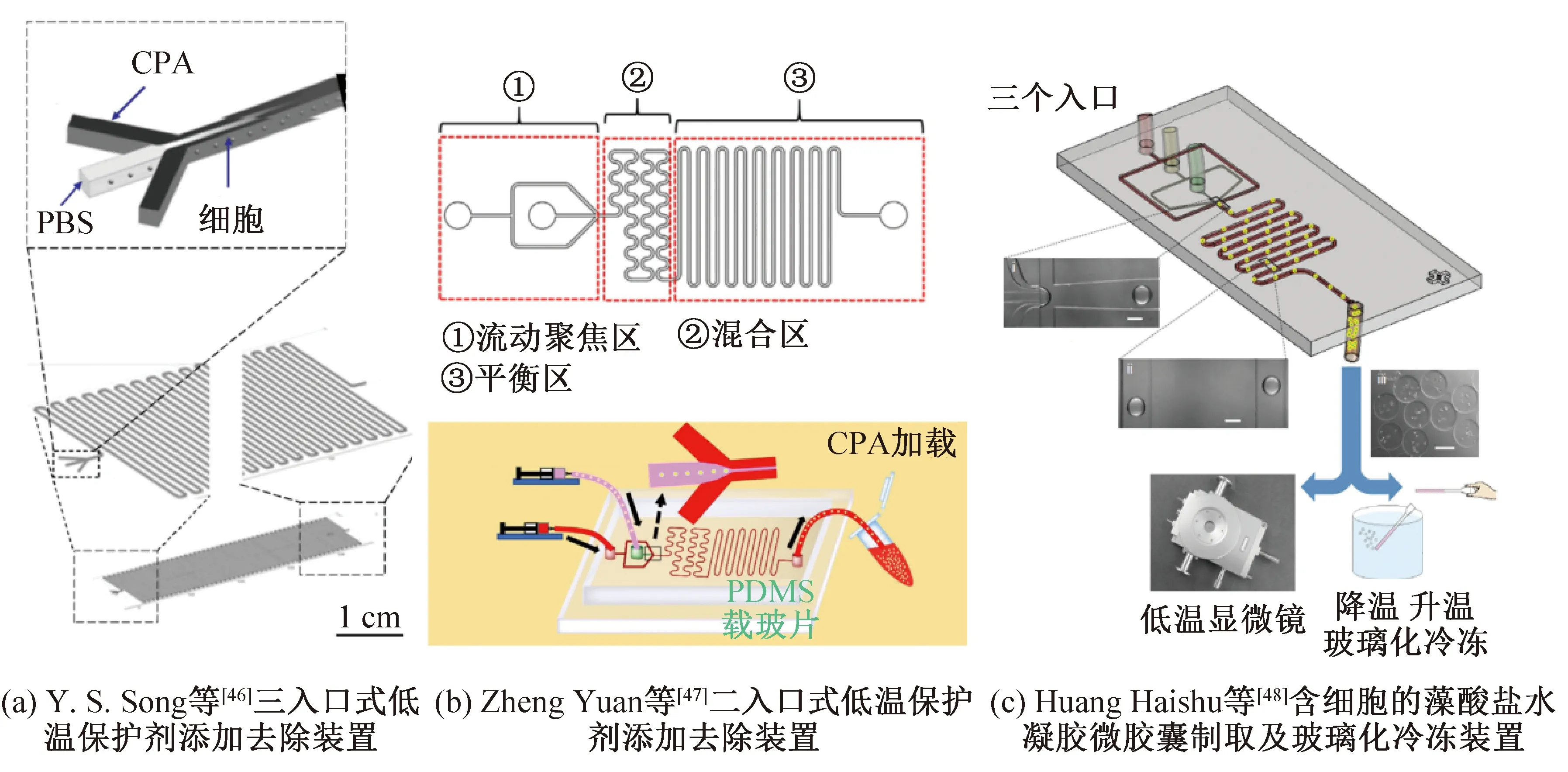
图6 微流体技术在细胞冻存中的部分应用
利用微流体技术可将细胞样本处理成分散的液滴单元,作为理想的微反应器,提高传热传质性能。如图6(c)所示,Huang Haishui等[48]通过非平面流动聚焦装置制备了含小鼠胚胎干细胞和人类脂肪干细胞的藻酸盐水凝胶微胶囊,胶囊直径约为220 μm,然后通过传统塑料吸管和QMC载体实现低保护剂浓度下的玻璃化冷冻。
如果将低温保护剂添加、降温冷冻、升温复苏、低温保护剂去除操作整合在一个微流控芯片上,可以很大程度上减小实验操作繁琐程度,并防止操作之间可能出现的细胞丢失以及额外的机械损伤。E. Kondo等[49]使用微流控芯片进行附着态细胞样品的低温冻存。Zhou Xiaoming等[50]设计出基于微通道强化传热原理的夹心状微流控芯片,并以此进行细胞玻璃化保存操作。Jiang Boshi等[51]设计出一个基于疏水PDMS材质的微流控芯片,可同时实现参数控制自动化的玻璃化冷冻前处理和玻璃化冷冻操作。周新丽等[52]就不同材质的微流控一体化冷冻保存芯片进行实验研究,在微流控芯片细胞冻存方面进行了探索。
2.4 物理场的应用
物理场包括电磁场、激光场、声场等。物理场的引入主要从两个途径影响细胞冻存效果:1)提高升温速率,使样品内温度场更均匀,从而抑制再结晶现象;2)影响水分子的运动状态,进而控制降温过程中冰晶的形成和生长[53]。
Jin Bo等[54-55]最早将激光引入低温冻存细胞的复温过程中,如图7(a)所示,将印度墨水加入样品溶液中,以Cryo-top为载体,利用液氮进行冷冻。然后使用1 064 nm红外激光器对小鼠卵母细胞进行复温,在低保护剂浓度及(相对)低降温速率的情况下实现了较高的复温存活率。K. Khosla等[17,56]针对体积更大的细胞提出细胞内外共同激光复温的方法,如图7(b)所示,将生物无害的金纳米棒注射进入斑马鱼胚胎及低温保护剂溶液中,通过Cryo-top和液氮进行冷冻。之后也通过1 064 nm红外激光器进行复温,取得较高的复温存活率。F. Panhwar等[57]使用合成的氧化石墨烯(GO)/二硫化钼(MoS2)纳米片和808 nm近红外激光器对液氮冷冻的人脐静脉内皮细胞进行复温,如图7(c)所示,结果显示该方法可减少冰晶形成并抑制重结晶,复温细胞具有高存活率和完整的生物功能。Hou Yi等[58]合成 Pluronic F127-液态金属纳米颗粒(PLM NPs)和808 nm近红外激光器对人骨髓基质细胞进行复温,如图7(d)所示,复温后细胞活力约70%。Wang Jianye等[59]利用Fe3O4纳米颗粒的电磁感应作用对玻璃化冻存的人脐带基质间充质干细胞进行复温,如图7(e)所示,结果表明该方法可有效抑制复温过程中的反玻璃化现,并提高冻存细胞的存活率。Cao Yuan等[60]通过3D打印制作了聚四氟乙烯载体用于大量细胞的冻存操作,并通过Fe3O4纳米颗粒的电磁感应作用对冻存细胞样品进行快速均匀复温,如图7(f)所示。

图7 物理场在冻存细胞中的应用
3 总结与展望
本文在介绍程序化慢速冷冻和玻璃化快速冷冻两种低温冻存方式及冷冻损伤两因素假说的基础上,分析了细胞特性、细胞外环境和升降温策略三个影响细胞冻存效果的要素,将细胞冻存的优化策略及设备分为细胞层面、细胞外环境层面和升降温策略及载体设备层面三类,重点回顾与总结了细胞冻存优化在升降温策略及载体设备层面的进展,得到如下结论:
1)完全玻璃化快速冷冻具有可以避免低温冷冻损伤的机理优势,是先进的冻存手段,但受限于升降温速度和低温保护剂毒性,现有的玻璃化冷冻方法仍不具有普适性。
2)升降温策略及载体设备层面的优化,以减小体量、强化传热为宗旨,应用新型的载体设备、微流体技术和物理场达到更高的升降温速率。其中仅依靠减小体量的方式提高升降温速率易达到瓶颈,且对于不同体积的细胞普适性欠佳,实现组织器官层面的玻璃化冻存相当困难。因此基于微尺度强化传热和物理场等先进的换热方式可能是有潜力的发展方向。此外,寻找更有效抑冰、低毒性的低温保护剂,对样品进行封装、结构设计等也是有潜力的发展方向。
3)随着高速高清成像技术和显微技术的发展,低温显微成像系统可为细胞内外冰晶生长的可视化研究提供支撑,但也需要突破升降温速率的极限,在更宽的速率范围实现细胞降温及复融。
本文受上海市科委创新行动计划(20S31903400)和上海市申康促进创新能力三年行动计划(SHDC2020CR3077B)项目资助。(The project was supported by Innovation Action Plan of Shanghai Science and Technology Commission(No.20S31903400) and Three-year Action Plan of Shanghai Shenkang to Promote Innovation Ability(No.SHDC2020CR3077B).)

