低共熔溶剂预处理提高甘草渣酶解效果优化
解先利,刘云云,余强,张宇,张荣清,邱雨心
(1 陕西科技大学机电工程学院,陕西 西安 710021;2 中国科学院广州能源研究所,广东 广州 510640)
化石燃料储量有限以及燃烧过程引发的环境问题(如空气污染、温室效应),使得以农林废弃物、市政固体废弃物和工业废料等废弃物为原料的燃料乙醇成为颇具前景的绿色替代能源。使用可再生的燃料乙醇可减少温室气体排放,因为农作物生长过程吸收的CO和其转化为燃料后燃烧排放的CO量相当,可达到碳中和,因此发展燃料乙醇对维持生态平衡具有重要意义。
近年来,中药业在我国蓬勃发展,其生产加工过程产生的中药渣呈逐步增加趋势,每年排放量约有(6000~7000)万吨。传统的中药渣大多采用废弃、填埋以及焚烧等方法处理,造成了资源浪费和环境污染问题。中药渣作为生物质的一种,其含有丰富的纤维素、半纤维素等多糖以及木质素组分,采用生物、热化学等技术可将其转化为燃料和高附加值能源产品。
生物质转化燃料乙醇一般需要经过预处理、酶水解和发酵过程。预处理主要目的是打破原料致密复杂的结构,对后续酶水解至关重要。预处理方法主要有物理法(机械法、微波处理法和超声波处理法等)、化学法(酸法、碱法和高温液态水等)以及有机溶剂法(离子液体)等。低共熔溶剂(DES)作为有机溶剂的一种,因具有易制备、成本低、易回收等优势,近年来受到广泛关注。DES 又称类离子液体,通常是由氢键受体(HBA)和氢键供体(HBD)通过分子间氢键形成均一、稳定的绿色溶剂,且混合物熔点低于任意组分熔点。HBA 通常为氯化胆碱等,HBD 一般为羧酸、酰胺和多元醇等。Li 等以氯化胆碱为氢键受体,乳酸为氢键供体,在不同摩尔比下分别合成DES 对稻草进行预处理,发现在90℃、氯化胆碱∶乳酸摩尔比为1∶3 条件下,反应3h,木质素和半纤维被有效去除。Zhang等用氯化胆碱/一元羧酸、氯化胆碱/二元羧酸和氯化胆碱/多元醇预处理玉米芯,发现木质素脱除和酶水解效率的提高与酸量、酸强度和氢键供体的性质有关,高效DES 对原料预处理效果至关重要。
本文以甘草中药渣为原料,在前期实验基础上,以氯化胆碱(ChCl)为氢键受体(HBA)、乙醇胺(M)为氢键供体(HBD),在摩尔比1∶5 条件下合成DES,考察了DES体系不同温度、时间和固液比对预处理前后甘草渣化学组分和酶解效果的影响,并利用类分形动力学、扫描电镜(SEM)、X 射线洐射仪(XRD)和傅里叶变换红外光谱(FTIR)对相关反应机理进行了分析。
1 材料与方法
1.1 实验材料
甘草渣由中国四川神农药业有限公司提供,原料洗涤,烘干粉碎后,过筛至20~60目之间,储存在密封袋于干燥皿中保存,备用。纤维素酶,由丹麦诺维信(NovezymesA/S)生物工程有限公司提供,其滤纸酶活为221FPU/mL;实验过程中所用的氯化胆碱、乙醇胺、柠檬酸、柠檬酸钠等化学试剂均为分析纯。
1.2 中药渣预处理
1.2.1 DES制备
氯化胆碱与乙醇胺以1∶5(摩尔比)混合,在80℃下150mL 耐压瓶中搅拌直到形成均一透明的液体,冷却至室温后,转移至血清瓶内置于干燥器内室温保存。
1.2.2 ChCl-M预处理中药渣
将上述制备好的DES 和甘草渣底物按照一定比例加入到100mL 的高温反应釜内,加热搅拌(500r/min)使之充分混合并反应一定时间后,固液分离,用100mL G3 砂芯漏斗过滤出固相底物,收集滤液和底物用于分析。DES预处理主要考察了反应温度(80℃、100℃、120℃)、固液比(1∶10、1∶15、1∶20)和反应时间(1h、2h、3h、4h)对底物组分变化和酶解效果的影响,以期获得较优的DES预处理体系。
1.3 酶解糖化
将1g(绝干物料)未处理或预处理后的甘草渣装于50mL 具塞三角瓶中,加入一定量pH 为4.8的柠檬酸-柠檬酸钠缓冲溶液和0.3%抗生素以抑制杂菌生长,反应底物浓度为50g/L,总体积20mL,纤维素酶添加量为20FPU/g 绝干底物,在50℃、150r/min 摇床酶解96h。反应过程中定时取样,样品在12000r/min 离心10min 后取上清液,用高效液相色谱仪(HPLC)测定水解液中葡萄糖、木糖等单糖含量。酶解效率计算如式(1)所示。
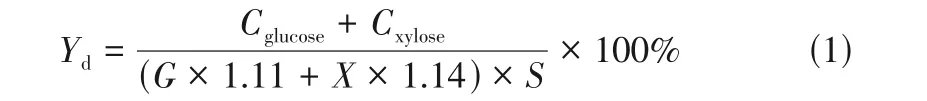
式中,为酶解效率,%;、分别为水解液中葡萄糖和木糖浓度,g/L;、分别为原料中葡聚糖和木聚糖质量分数,%;为绝干物料底物浓度,g/L;1.11和1.14分别为葡萄糖转换为葡聚糖的脱水系数和木糖转换为木聚糖的脱水系数。
1.4 分析方法
1.4.1 原料组分分析
甘草渣预处理前后原料化学组分变化根据美国可再生能源实验室(NREL)标准分析方法进行测定。首先称取150mg±5mg待测样品于2mL离心管内,加入1.5mL 72%硫酸摇匀并置于30℃、150r/min 摇床下水解1h,待反应结束后用42mL去离子水将水解产物完全洗涤至75mL 耐压瓶中(此时硫酸质量分数为4%)。然后将洗涤完的水解产物盖紧瓶塞,放入高压灭菌锅于121℃反应1h充分水解,待反应结束后冷却至室温。在烘干至恒重的砂芯漏斗中进行固液分离。固相部分于105℃烘箱烘干至恒重,计算酸不溶木质素含量。滤液用碳酸钙中和、离心并用2.5mL 注射器取1mL 上清液经过0.22μm 滤膜转移至液相瓶中,置于高效液相色谱(HPLC)中检测葡萄糖、木糖浓度,再计算出原料中多糖的含量。固体回收率、纤维素保留率、半纤维素和木质素去除率按照式(2)~式(5)进行计算。

1.4.2 糖浓度分析
酶水解液中单糖浓度采用HPLC waters2695进行检测,色谱柱为Shodex sugar SH-1011 糖柱,温度为50℃,流动相为0.5mmol/L HSO,流速为0.5mL/min,检测器为RI(refractive index),检测器温度为50℃。
1.4.3 表征与结构分析
(1)扫描电镜(SEM)分析 称适量干燥后的样品在真空条件下喷金,通过SEM(Hitachi,S-4800)在2.0kV加速电压下获取样品形貌变化的电镜图。
(2)结晶指数XRD 分析 采用荷兰帕纳科公司X’Pert Pro MPD(PW3040/60)型X 射线衍射仪进行分析测定,测定条件为:反射法、Cu 靶、电压40kV、电流40mA、扫描范围为5°~80°。结晶指数(crystallinity index,CrI)计算为式(6)。

式中,为002 衍射面的结晶强度(2=22.5°);为基线的衍射强度(2=18.4°)。
(3)傅里叶变换红外光谱FTIR 分析 将样品于60℃烘箱烘干至恒重,取1mg样品与150mg左右溴化钾混合,充分研磨后,用压片机压制,制好后的样品放入检测器检测。检测器采用德国布鲁克(Bruker)公司Nicolet IS 50型FTIR分析仪,测量波长范围为4000~600cm,扫描次数为32次。
1.5 类分形动力学模型
不溶性纤维底物的酶解过程是复杂的固-液两相催化过程,往往还发生在分形表面上,随着反应进行,底物变得越难酶解,使得反应速率常数随着反应的进行不断减小,故研究者通过假定速率常数与时间的关系提出了类分形动力学,且该模型具有方程简单、参数少及易确定等优点。据此,本文根据类分形理论,假定速率常数与时间呈幂函数关系,建立了葡聚糖和木聚糖水解的类分形动力学模型,分别如式(7)和式(8)所示。
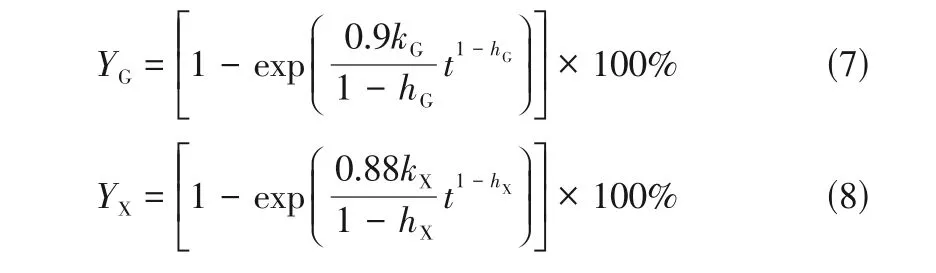
式中,和分别为酶解过程的葡萄糖和木糖的得率;和分别和为底物葡聚糖和木聚糖水解反应速率常数;和分别为底物葡聚糖和木聚糖的分形维数;0.9 为葡萄糖换算为葡聚糖的转换系数;0.88为木糖换算为木聚糖的转换系数。
2 结果与分析
2.1 DES体系预处理条件的优化
2.1.1 预处理温度对残渣化学组分影响
反应温度是影响DES 体系预处理效果的关键因素,本研究在固液比为1∶20、反应时间为3h条件下,考察DES体系不同反应温度(80℃、100℃、120℃)对甘草渣化学成分的影响。预处理前后甘草渣各组分质量分数的变化见表1。
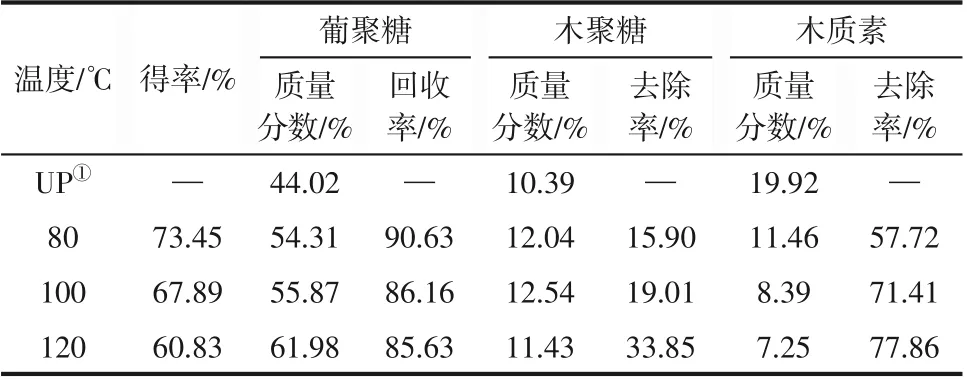
表1 ChCl-M体系不同预处理温度对底物组分的影响
由表1可以看出,相比于未处理的甘草渣,DES体系预处理温度为120℃时,甘草渣中大部分的木质素和小部分的半纤维素被去除(去除率分别为77.86%和33.85%);葡聚糖质量分数从44.02%增加到61.98%,木质素质量分数从19.92%下降到7.25%,木聚糖质量分数基本保持不变。可能原因是随着反应温度的升高,DES预处理液中的氢键作用增强,其选择性与半纤维素和木质素组分反应并打破其结合键,使木质素和半纤维素的去除率增加,ChCl-M体系预处理对原料脱木质素效果更好;另外,温度的升高,使得部分纤维素溶解在DES中,由表1也可看出,木质素去除率随温度升高而增加,而葡聚糖的回收率随温度升高而降低,120℃时纤维素保留率已经降低到85.63%,为了最大限度去除木质素并回收纤维素,以利于底物后续的酶催化降解过程,超过120℃的实验结果本文就不作比较,因此在实验温度范围内选择120℃作为后续反应条件。
2.1.2 预处理固液比对残渣化学组分影响
在以上实验基础上,研究预处理固液比对原料组分的影响。实验过程预处理温度选择120℃,反应时间为3h,考察DES和底物不同固液比(1∶10、1∶15、1∶20)对甘草渣化学组分的影响,预处理后甘草渣各组分变化见表2。
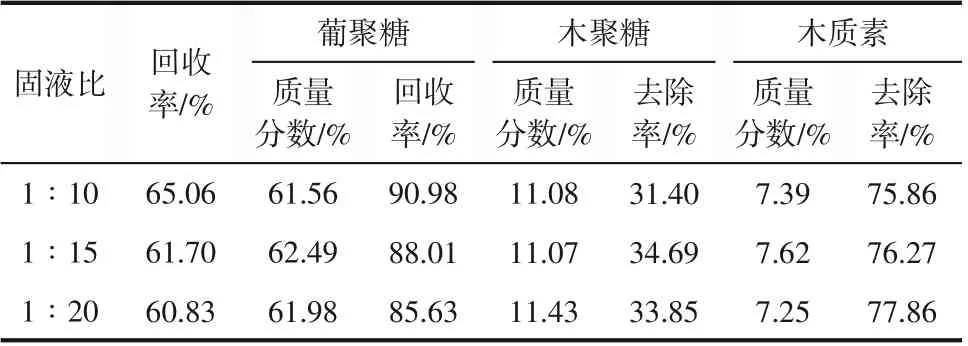
表2 ChCl-M体系下不同固液比对底物组分的影响
由表2可以看出,随着DES和底物固液比的降低,物料回收率随之降低,固液比为1∶20时,预处理效果较好,半纤维和木质素去除率可分别可达到33.85%和77.86%,而纤维素回收率也在85.63%,相对较高。相反,在固液比为1∶10时,半纤维素和木质素的去除率相对较低,分别为31.40%和75.86%。
可能原因是在DES 和底物固液比1∶10 条件下,DES体系整体黏度较大,底物浓度较高,传质传热可能受限,影响了原料表面和DES 溶剂组分的充分接触,造成其对半纤维素和木质素的降解能力下降,纤维素组分也保留率较高。总体上ChCl-M体系预处理对原料脱木质素效果更好,推测是预处理液中某些组分更易与通过碳碳键和醚键连接而成的苯丙烷单体分子结合反应,使其化学键断裂进而去除。另外,随着固液比的降低,纤维素组分在DES中溶解的越多,由表2也可看出,葡聚糖的回收率随固液比的降低而降低。为了最大限度去除木质素,保留纤维素组分,选择1∶20进行后续实验。
2.1.3 预处理时间对残渣化学组分影响
反应时间是影响DES 体系催化反应的另一重要因素。本文在以上实验基础上,在预处理温度120℃、固液比1∶20 的条件下,考察不同预处理时间(1h、2h、3h、4h)对甘草渣化学组分的影响,实验结果见表3。
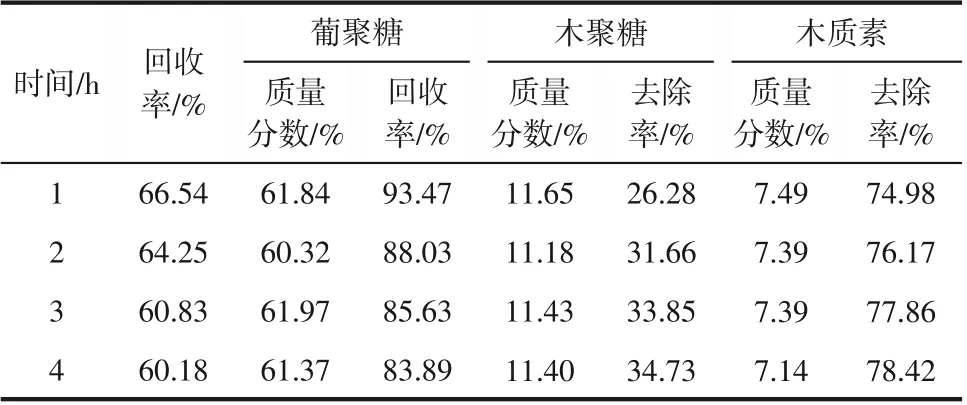
表3 ChCl-M体系下不同预处理时间对底物化学组分的影响
由表3可以看出,当预处理时间为4h时木质素去除率最高,达到78.42%;预处理时间为1h 时,葡聚糖回收率最高,为93.47%。在预处理时间为2h 后,物料回收率和半纤维素去除率的差别并不大。可能原因是随着反应时间的延长,部分底物降解之后,预处理溶剂DES 和未反应底物之间得到充分接触,反应更完全,因此,底物中的半纤维素和木质素在预处理4h后其去除率相对较高。由表2也可看出,葡聚糖的回收率随反应时间的增加而降低,综合考虑最大限度去除木质素和回收葡聚糖(葡聚糖回收率大于83%),选择预处理时间4h 为本实验范围内较优预处理时间。
2.2 不同预处理残渣对酶解效果影响分析
为进一步评价预处理效果,对ChCl-M 体系不同预处理条件所得底物及未处理原料进行酶水解实验,考察DES 体系预处理对甘草渣酶水解效果的影响,结果见图1。
由图1(a)可看出,随着预处理温度的升高,底物水解液中葡萄糖、木糖浓度和纤维素酶解率均呈现明显的增加趋势。可能原因是随着温度升高,木质素去除率升高,导致酶解效率增加。在120℃条件下,葡萄糖、木糖浓度和纤维素酶解率均有最大值,分别为23.65g/L、6.40g/L 和72.42%。由图1(b)可以看出,DES 和底物的固液比对底物酶水解影响不太大。结合表2 分析推测,可能是底物组分的含量变化不大所导致。由图1(c)可以发现,随着预处理时间的延长,水解液中葡萄糖、木糖浓度和纤维素酶解率均略有增加趋势。由表3分析可知,预处理时间增加,木质素去除率随之升高,因此酶解效率也随着增加。在预处理时间为4h 时,葡萄糖、木糖浓度和纤维素酶解效率达到最大,分别为25.17g/L、6.71g/L和78.57%;较未处理中药渣酶解得率(30.40%)提高了1.58 倍。经过底物酶水解过程分析,可推测预处理条件对底物酶水解效果的影响为预处理温度>预处理时间>固液比。

图1 酶解96h后DES体系预处理条件对甘草渣酶解效果的影响
2.3 类分形动力学分析
为进一步分析验证不同预处理条件对酶水解效果的影响,将酶水解实验数据代入分形动力学式(7)和式(8)进行拟合。结果见图2。由图2 可以看出,试验点和拟合曲线非常接近,表4~表6中的相关系数均在0.94 以上,也证明了拟合程度非常好。这表明类分形理论能够充分地研究纤维素酶水解动力学。

图2 类分形动力学拟合值和实验值比较
由表4看出,不同预处理温度葡聚糖水解的值差别不大,值差别不大;木聚糖水解的值均差别较大。底物颗粒不规则性可用分形维数衡量。原料经过不同温度预处理后,在表观上颗粒尺寸大小和尺寸分布相似,这可由表中葡聚糖值接近得到证实。表4中结果可看出,不同预处理温度所得底物与纤维素酶的有效吸附性差别较大,这与底物酶水解结果一致;不同预处理时间对半纤维素的降解影响比较大,这与表4 中的木聚糖值差别比较大结果一致。
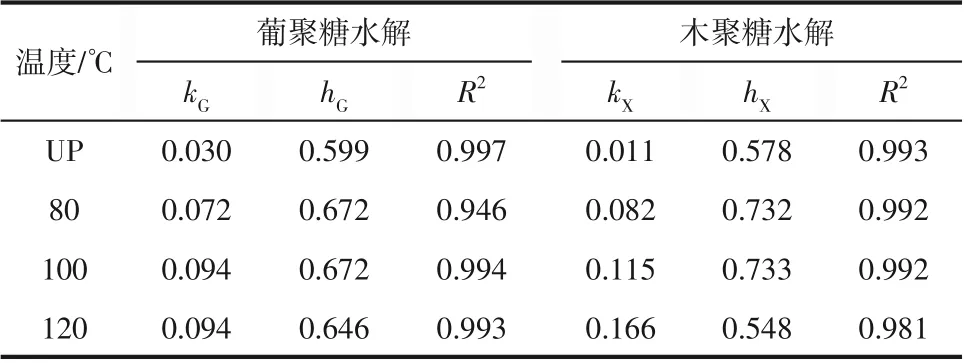
表4 不同预处理温度类分形动力学拟合得到的速率常数和分形维数
由表5可以看出,不同固液比的葡聚糖水解和木聚糖水解的值差别不大。结合表2 分析,同样原料经不同固液比预处理后,木质素去除率和半纤维去除率差别不大,这与表5中葡聚糖水解和木聚糖水解的值差别不大结论相一致;由底物酶水解结果也验证了不同原料脱木质素效果,底物与纤维素酶之间的有效吸附性差别不大这一结论。

表5 不同预处理固液比类分形动力学拟合得到的速率常数和分形维数
由表6看出,不同预处理时间对葡聚糖水解的值影响不大,值略有差别;木聚糖水解的值差别较大。由表2 发现,原料在预处理2h 后,半纤维素和木质素含量差别不是很大,这与表6葡聚糖值差别不大结果一致。在预处理时间4h时,半纤维含量较低以及残渣与酶的吸附性较强,因此预处理时间为4h 时,酶水解效果较好,这与表中预处理时间为4h 时,葡聚糖和木聚糖较大,值较小结果一致。
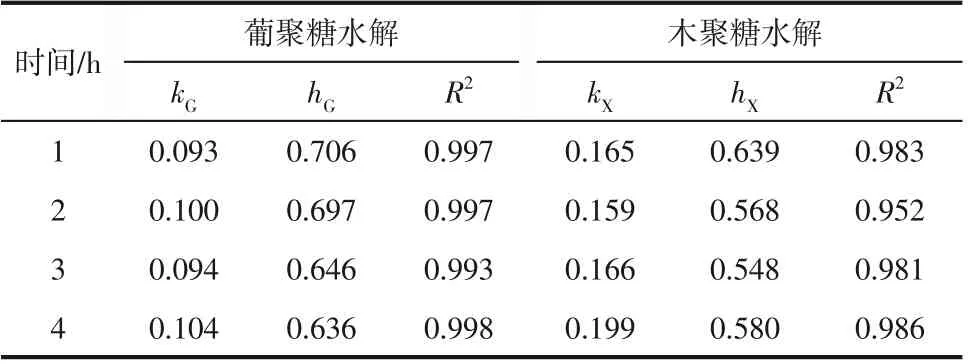
表6 不同预处理时间类分形动力学拟合得到的速率常数和分形维数
2.4 残渣表面结构分析
对较优条件下甘草渣ChCl-M 预处理前后底物表面形貌变化进行了分析,结果见图3。由图3 可以清楚地看到,未处理原料结构紧密,表面平整光滑,结构紧实。与原料相比,ChCl-M 体系预处理后物料表面出现明显的裂痕、沟壑和大量的孔洞,纤维表面无序化,这样更加有利于酶分子与底物接触,经过ChCl-M 体系预处理,原料化学组分改变导致表面形貌变化很明显。

图3 预处理前后底物的表面形貌变化(SEM)(1000倍和11000倍)
2.5 残渣的XRD和FTIR分析
ChCl-M 体系较优条件预处理前后底物X 射线衍射图谱和红外光谱图见图4(a)和(b)。由图4(a)可以看出,未处理和预处理后的底物XRD分析显示,底物中纤维素的结构为典型的Ⅰ型纤维素,说明经过ChCl-M 体系处理后并未改变纤维素的晶型,这与FTIR 图谱结果相吻合。甘草渣原料中纤维素的CrI 为30.76%,当用ChCl-M 预处理后,底物中纤维素的CrI增加至40.89%。其中有两个相互竞争的因素决定了原料和底物的结晶度:①微晶纤维素部分的溶胀和溶解;②无定形木质素和木聚糖的去除。CrI 值的增加表明无定形组分的去除,超过了纤维素的溶胀。这些结果表明,ChCl-M 体系预处理是有利于木质素和木聚糖的去除,从而导致更高的CrI。ChCl-M预处理后,底物结晶指数明显升高,推测原因为预处理后底物中纤维素含量明显比原料中高。
根据文献[17],纤维素的CrI 还可以通过FTIR图谱中1430cm的谱带与898cm处谱带的吸收强度表示。图4(b)为ChCl-M 预处理前后底物的FTIR图,由图中可以发现,1430cm(纤维素Ⅰ)处的谱带吸收强度增加,而在898cm(纤维素Ⅱ)处的谱带吸收强度减弱,表明预处理后底物中纤维素的CrI增加ChCl-M预处理后样品在3415cm(纤维素O—H 拉伸振动)和2923cm(C—H 拉伸振动),说明预处理打破了纤维素分子内和分子间的氢键以及甲基/亚甲基结构;1049cm和1155cm处的红外吸收强度减弱,其分别代表半纤维素中乙酰基的C═O的拉伸和C—O键,表明预处理过程中半纤维素部分被降解;同时,代表木质素特征吸收峰的谱带1319cm(紫丁香基缩合木质素)、1552cm(苯环)和1608cm(木质素C═O 的拉伸振动)处的红外吸收强度也减弱,表明预处理过程中木质素被脱除。这些结构变化和上述XRD 分析结果一致,也进一步说明了DES 预处理对甘草渣组成的影响有利于酶解效果的提高。

图4 预处理前后底物的X射线衍射图和FTIR吸收光谱图
3 结论
DES具有优良的分离木质素的能力,相比于传统脱木质素工艺,DES 绿色环保成本低且易回收。本文在前期优化的DES 体系基础上,考察了DES预处理温度、反应时间和固液比对甘草渣组分和酶解效果的影响。在实验条件范围内,得到120℃、1∶20、反应4h 的较优预处理条件,并通过酶水解效果分析和类分形动力学机理研究,探讨了DES 预处理效果;最后,对较优条件下底物进行了表征分析,为DES 的广泛应用奠定理论基础。未来在提高DES 脱木质素的效率、降低生产成本方面,可采用联合预处理技术,以及开发新型高效的二元和三元DES。

