LMTIA技术检测HPV核酸的可行性研究
孔爱华,艾旭光,王德国
(1.菏泽定陶区人民医院,山东 菏泽 274100;2.许昌学院 食品与药学院;河南省食品安全生物标识快检技术重点实验室,河南 许昌 461000)
人乳头瘤病毒(HPV)是乳多空病毒科的球形DNA病毒,能够引起宫颈癌[1],因此快速检测并诊治HPV就至关重要.目前常用的聚合酶链式反应(PCR)方法,需要热循环仪,不适合基层筛查[2].而梯型熔解温度等温扩增(LMTIA)是一种新型核酸等温扩增技术[3],通过借鉴PCR技术[2]、环介导等温扩增(LAMP)[4]、滚环扩增(RCA)[5]与交叉引物扩增(CPA)[6]等技术的反应机理,利用引物与靶序列的熔解温度(Tm)差实现了聚合酶链式反应的等温反应.借鉴环介导等温扩增的引物设计方法,通过反向引物可以将PCR反应时间由1.5 h缩短到25 min以内.梯型熔解温度等温扩增技术改变了人们三十年来对PCR反应的认知,打破基层部门使用聚合酶链式反应技术必须采购热循环仪的门槛[7],解决了现有核酸等温扩增技术存在的反应时间长、非特异性扩增等缺点,具有反应机理简单、引物设计简单、反应时间短、特异性强、灵敏度高、对靶序列长度要求低、适用范围广等优点[8].因此探究LMTIA方法检测高危型HPV16、HPV18、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56和HPV58核酸的可行性,为适于基层的高危型HPV筛查提供新思路.
1 材料与方法
1.1 材料、试剂与仪器
材料试剂:10×LMTIA反应液(200 mmol·L-1Tris-HCl,pH 8.8,100 mmol·L-1KCl,100 mmol·L-1(NH4)2SO4,60 mmol·L-1MgSO4,1% Triton X-100,3.2 U Bst DNA polymerase μL-1),德歌生物技术(山东)有限公司;dNTP(10 mmoL·L-1),通用生物系统(安徽)有限公司;DEPC水(500 mL),生工生物工程(上海)股份有限公司;SYBR GreenI荧光染料,赛默飞世尔科技.
仪器:Eppendorf移液枪,德国艾本德股份公司;Mixer-3000s涡旋混匀仪,杭州茂丰仪器有限公司;PGspin(PRF CGF)离心机,宁波拓普森科学仪器有限公司;1-14K高速冷冻离心机,德国 SIGMA公司;Gentier 96E/96R全自动医用PCR分析系统,西安天隆科技有限公司;NanoDrop One/OneCN微量核酸蛋白浓度测定仪,美国赛默菲世尔公司.
1.2 试验方法
1.2.1 靶序列筛选
根据GenBank数据库中HPV16(登录号:FJ006723)、HPV18(登录号:AY262282)、HPV35(登录号:HQ537722)、HPV39(登录号:KC470249)、HPV45(登录号:EF202162)、HPV51(登录号:KU298904)、HPV52(登录号:AB819274)、HPV56(登录号:EF177181)和HPV58(登录号:AB819276)的基因组,通过BLAST在线比对软件选取保守序列,并使用Oligo 7软件(美国Molecular Biology Insights有限公司),选取LMTIA方法所要求的溶解温度曲线呈人字梯型、半人字梯型、直梯型的靶序列[3],引物序列如表1所示.并且这些靶序列满足LMTIA方法的另外两个要求:GC含量为40%~80%;序列特异性高.
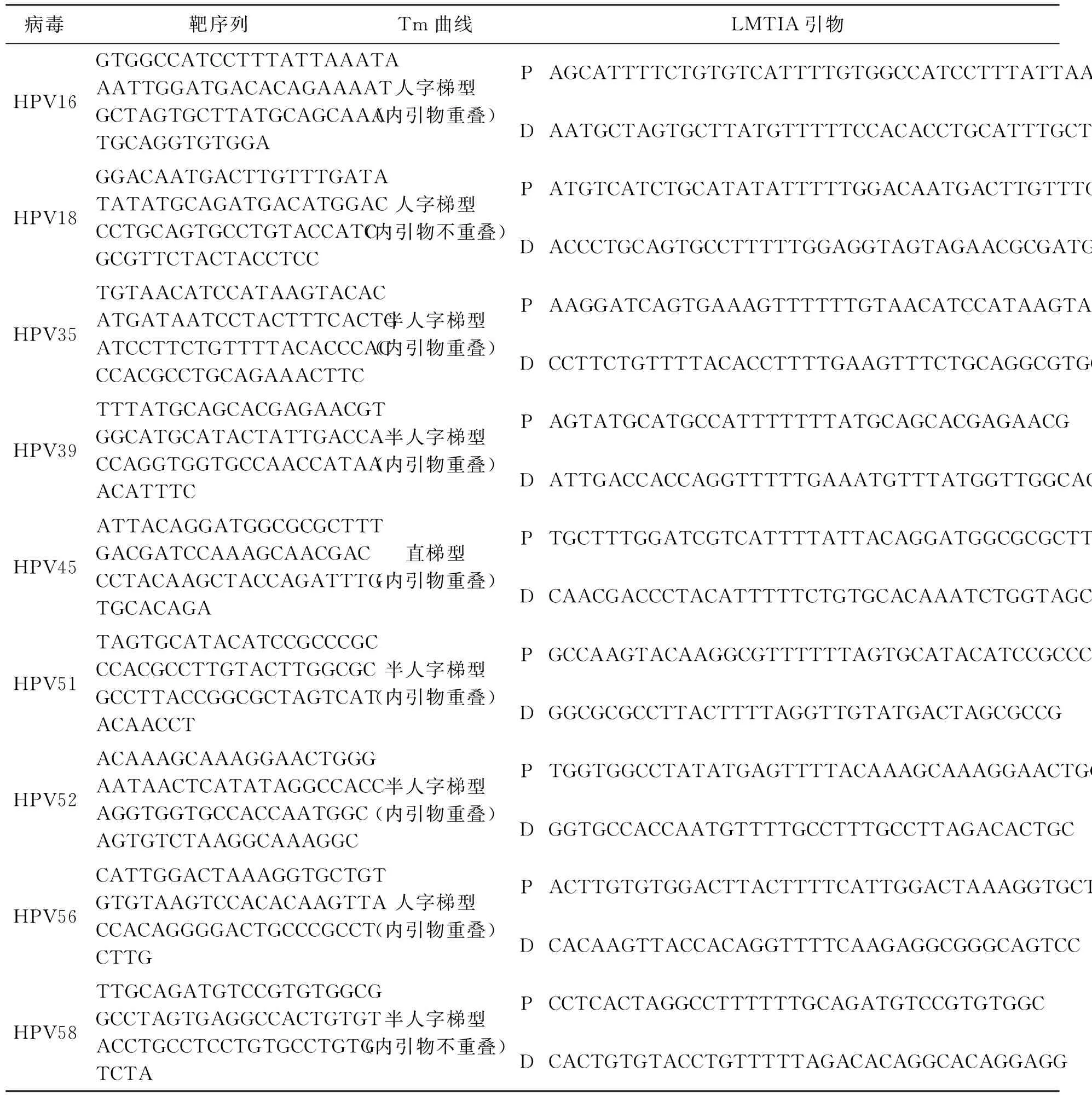
表1 高危型HPV病毒的靶序列筛选与LMTIA引物设计
1.2.2 LMTIA引物设计
使用在线软件Primer3Plus(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)设计LMTIA引物.将Tm值范围设置为59~63 ℃,引物长度设置为18~25 nt,设计一对外引物P1和D1;将Tm值范围设置为35~85 ℃,引物长度设置为12~16 nt,设计一对外引物P2和D2.将P2引物的反向序列与P1引物通过四个碱基T连接成为引物P,将D2引物的反向序列与D1引物通过四个碱基T连接成为引物D,引物P和引物D作为LMTIA扩增引物[3],HPV16、HPV18、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56和HPV58的LMTIA检测引物序列如表1所示.
1.2.3 靶序列合成与克隆
合成表1中HPV16、HPV18、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56和HPV58的LMTIA检测靶序列,并将合成靶序列克隆到pUC57载体上,基因序列合成与克隆委托通用生物系统(安徽)有限公司完成,将含有靶序列的pUC57载体作为模板进行温度优化、稳定性与灵敏度测试.
1.2.4 温度优化
用10 μL的反应体系进行LMTIA反应温度优化,反应体系为:1.3 μmol的引物P和引物D,1.0 mmol的dNTP,1×LMTIA反应液(20 mmol Tris-HCl,pH 8.8,10 mmol KCl,10 mmol (NH4)2SO4,6 mmol MgSO4,0.1% Triton X-100,0.32 U Bst DNA polymerase μL-1),1× SYBR GreenI,1pg含靶序列的pUC57载体模板,加ddH2O至10 μL,然后加20 μL的液体石蜡以防止气溶胶污染[3].将Gentier 96E/96R全自动医用PCR分析系统的反应温度设置分别为49、50、51、52、53、54、55、56、57、58 ℃,加热1 h.
1.2.5 LMTIA检测方法稳定性测试
采用上述10 μL的反应体系和选定的最优温度,1 pg含靶序列的pUC57载体模板为阳性对照,ddH2O为阴性对照,通过4个阳性对照和4个阴性对照测试高危HPV病毒LMTIA检测方法的稳定性[3].
1.2.6 LMTIA检测方法灵敏度测试
将含靶序列的pUC57载体模板分别稀释为100、10、1、0.1、0.01 fg,用上述反应体系在优选温度下测试所建LMTIA检测方法的灵敏度[3].
2 结果与讨论
2.1 LMTIA反应温度优化结果
由表2所示,HPV16、HPV18、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56和HPV58的LMTIA方法的最优温度差别较大,HPV16的最优反应温度为50 ℃,HPV51的最优反应温度为57 ℃,由此可见,温度对LMTIA扩增效率的影响较大,因此建立理想的LMTIA检测方法首先需要优选温度.
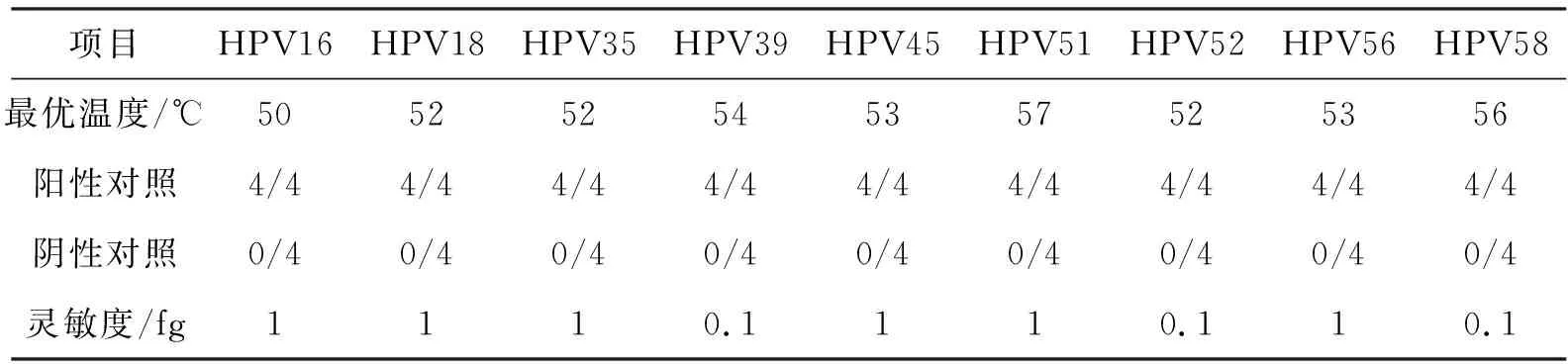
表2 高危型HPV病毒的LMTIA检测方法的测试结果
2.2 HPV的LMTIA检测方法的稳定性
由表2可以看出,高危型HPV16、HPV18、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56和HPV58病毒LMTIA检测方法的稳定性测试中,所有的阳性对照均为阳性,所有的阴性对照均为阴性,说明LMTIA方法检测HPV病毒稳定性高,可重复性强.
2.3 HPV的LMTIA检测方法的灵敏度
由表2所示,LMTIA方法检测HPV16、HPV18、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56和HPV58的灵敏度分别为1,1,1,0.1,1,1,0.1,1,0.1 fg/reaction,相当于30~300 copies/reaction.如再加FRET荧光探针,可进一步提高灵敏度与特异性[9],因此LMTIA方法的灵敏度高,适合用于高危型HPV病毒检测.
3 结论
筛选高危型乳头瘤病毒HPV16、HPV18、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56和HPV58基因组上呈人字梯型、半人字梯型、直梯型的特异性序列设计LMTIA引物,建立LMTIA检测方法.结果表明,温度对LMTIA扩增效率影响显著,在最优温度下,LMTIA方法检测高危型HPV病毒特异性基因的重复性强、灵敏度高.研究案例证实了梯型熔解温度等温扩增(LMTIA)反应中单链模板供应机理是准确的.LMTIA技术相对于LAMP技术具有性能优势,所以LMTIA方法对于高危型HPV病毒检测具有广阔的应用前景.

