漆酶基因OsLAC6 在水稻应答亚砷酸盐胁迫中的作用
徐逸群,郭 瑶,刘庆坡
(浙江农林大学现代农学院,浙江 临安 311300)
砷及砷化合物是重要的环境污染物[1]。高浓度的砷可严重影响植物的生长发育,导致产量和品质下降[2]。与旱粮作物相比,水稻由于独特的生理特性及种植方式具有更强的砷吸收与富集能力[3]。由此引发的水稻砷污染问题亟待解决。提高水稻的耐砷性有助于解决水稻砷污染问题。目前,已有少数水稻耐砷基因和miRNA被陆续鉴定[4-6]。但是,水稻的耐砷性是受多基因控制的。因此,迫切需要挖掘新的基因,并深入揭示它们在水稻响应砷胁迫中的生物学功能。
漆酶(EC 1.10.3.2;LAC)是一类多铜氧化酶,能够催化多种芳香族和非芳香族底物的氧化,广泛分布于植物[7-13]、真菌[14]、细菌[15]和昆虫[16]中。植物基因组中编码漆酶的基因数量众多[7-8,10-11,17],它们具有不同的基因结构和时空表达模式,暗示漆酶基因已发生了明显的功能分化[17]。目前,大多数漆酶基因的功能尚未知。研究发现,漆酶影响植物的生长发育和逆境胁迫应答[7,9,12-13]。拟南芥AtLAC4、AtLAC11、AtLAC17,白梨PbLAC1,竹子PeLAC10,棉花GhLAC1、GhLAC15等基因主要参与木质素的合成[8-13]。其中,超表达GhLAC1和GhLAC15基因显著增强了转基因棉花对真菌病害和虫害的耐受性[12-13]。
水稻(Oryza sativaL.)中共有30 个漆酶基因[7],但目前仅有少数漆酶基因的功能被鉴定。YU 等[18]研究发现,OsLAC13基因通过调节蔗糖运输和过氧化氢生成影响水稻的结实率。LIU 等[7]研究发现,OsLAC10基因受激素、干旱、高盐和重金属胁迫诱导表达,超表达该基因明显提高了转基因拟南芥对铜离子的耐受能力。此外,miR397/OsLAC在控制水稻产量形成和除草剂抗性等方面具有重要作用[19-20]。但是,漆酶基因是否参与水稻砷胁迫应答尚不清楚。为此,在水稻中超表达OsLAC6基因,分析转基因株系在正常及亚砷酸盐处理下的表型、生理生化指标等,探讨其在水稻亚砷酸盐胁迫应答中的作用,为深入分析漆酶基因调控水稻耐砷性的分子机制奠定基础。
1 材料和方法
1.1 试验材料
水稻材料为粳稻品种日本晴,由中国水稻研究所提供。植物表达载体为pCAMBIA1300,由浙江省农业科学院提供。
1.2 转基因植株的获得及阳性鉴定
利用CTAB 法提取水稻叶片基因组DNA[21]。利用引物(5′-GGTACCATGGGCACTCCCCGTGGCCT-3′和5′-CCCGGGGCACTTGGGAAGATCCGACG-3′)从日本晴基因组中扩增出OsLAC6基因的编码区序列(CDS)。使用KpnⅠ和SmaⅠ对PCR 产物进行酶切,然后连接至pCAMBIA1300 载体,采用热激法将其转化至大肠杆菌DH5α。经PCR 扩增及测序正确后,将阳性质粒转入农杆菌,再次PCR 检测正确后,利用农杆菌介导法将阳性质粒转入日本晴愈伤组织,经潮霉素抗性筛选后获得超表达OsLAC6基因的转基因植株。
利用OsLAC6基因特异引物(5′-AGCCCTGCCTTCATACGCTATTT-3′)结合载体特异引物(5′-CCAGTGGAACGAGACGTTGTA-3′)对转基因水稻植株进行阳性鉴定。PCR 反应程序为:94 ℃5 min;94 ℃30 s,58 ℃30 s,72 ℃30 s,35 个循环;72 ℃7 min。
1.3 OsLAC6基因的表达模式分析
分别收获水稻幼苗期、分蘖期和成熟期的根系、茎、叶片,幼苗期根茎结合部,分蘖期节,孕穗期和抽穗期小穗,开花期颖壳和花。各时期每种材料分别取0.5 g,采用TRIzol 法提取各材料的总RNA,使用反转录试剂盒(Invitrogen)将RNA 反转录成cDNA,然后在BIO-RAD CFX96 荧光定量PCR 仪上进行扩增。OsLAC6基因荧光定量PCR 引物序列为5′-GTTCGGTTCCTCGCCGACAATC-3′、5′-CACTTGGGAAGATCCGACGGC-3′。反应程序如下:95 ℃5 min;95 ℃30 s,58 ℃30 s,72 ℃30 s,40个循环;72 ℃7 min。以UBQ(Ubiquitin)基因(正向引物:5′-AACCAGCTGAGGCCCAAGA-3′,反向引物:5′-ACGATTGATTTAACCAGTCCATGA-3′)为内参,采用2-ΔΔCT法计算OsLAC6基因在不同时期各组织部位的相对表达量。
1.4 漆酶活性检测
参照BERTHET 等[22]的方法进行漆酶活性检测。取生长7 d 的转OsLAC6基因水稻幼苗叶片0.8 g,用液氮充分研磨,加入植物蛋白质提取液(1∶99,含Protease Inhibitor Cocktail)剧烈振荡后,置于冰上孵育20 min,并在4 ℃条件下13 400×g离心20 min,收集上清液待用。将漆酶底物2,2′-叠氮基双-(3-乙基苯并噻唑啉-6-磺酸)(ABTS)用二甲基亚砜(DMSO)溶解,配制成终质量浓度为11 g/L 的溶液,于-20 ℃保存。反应体系包含100 mmol/L 乙酸盐缓冲液(pH 值5.0)、1 mmol/L ABTS 和20 μL 蛋白质提取物,总反应体积为200 μL。待混合液在30 ℃反应0.5 h 后,在420 nm 处测定吸光值,根据ABTS 氧化生成稳定阳离子自由基情况来评估漆酶的活性。
1.5 幼苗培养及亚砷酸盐胁迫处理
选取野生型(WT)日本晴和超表达OsLAC6基因水稻株系的健康饱满的种子,用5 g/L NaClO 溶液消毒15 min,然后用纯净水漂洗3~5 次,浸泡24 h。将种子转移至添加适量5 g/L CaCl2溶液的发芽盒中,置于光照培养箱中进行催芽,培养条件设为30 ℃光照16 h/25 ℃黑暗8 h。待幼苗长至约4 cm,挑选长势一致的幼苗置于营养液[0.091 mmol/L KNO3、0.183 mmol/L Ca(NO3)2、0.274 mmol/L MgSO4、0.1 mmol/L KH2PO4、0.183 mmol/L (NH4)2SO4、0.5 μmol/L MnCl2、3 μmol/L H3BO3、0.1 μmol/L(NH4)6Mo7O24、0.4 μmol/L ZnSO4、0.2 μmol/L CuSO4、40 μmol/L NaFe(Ⅲ)-EDTA、2 mmol/L 2-吗啉磺酸,pH值5.5]中培养,每3 d换一次营养液。待苗龄21 d时,分别用0(对照,CK)、25 μmol/L 亚砷酸钠[As(Ⅲ)]进行处理。
1.6 根系相对伸长量及生理生化指标的测定
1.6.1 根系相对伸长量 在As(Ⅲ)处理0 d 和7 d
时,测定WT 和超表达OsLAC6基因水稻株系幼苗的根长,计算根系相对伸长量。
1.6.2 叶绿素含量 As(Ⅲ)处理7 d后,取WT和超表达OsLAC6基因水稻株系叶片0.2 g,剪成1 cm 大小,随后加入10 mL乙醇和丙酮混合液(1∶1)避光萃取,每隔3 h 晃动一次,待叶片完全变成白色后,分别在663 nm 和645 nm 处测定吸光值(A663和A645)。叶绿素a、b 含量按以下公式进行计算:叶绿素a 含量=(12.72A663-2.59A645)×10/200,叶绿素b 含量=(22.88A645-4.67A663)×10/200。
1.6.3 过氧化氢含量 As(Ⅲ)处理后7 d,取WT 和超表达OsLAC6基因水稻株系相同部位的叶片,立即置于含有二氨基联苯胺(Diaminobenzidine,DAB)染液的离心管中,在室温下进行黑暗处理,直至出现明显表型。然后,将染色后的叶片置于70%乙醇中保存,在体式显微镜下观察染色情况并拍照。
1.6.4 木质素含量 根据胡琴等[23]的方法,选取WT和转OsLAC6基因水稻株系相同部位的根系,浸没于30 g/L 间苯三酚溶液(将3 g 间苯三酚溶于100 mL 95%乙醇)中,抽真空10 min,使染液充分渗入根系组织中。随后,将染色的根系取出转移至20%盐酸溶液中浸泡10 min,置于体式显微镜下观察染色情况并拍照。
1.7 统计分析
采用SPSS 22.0 中的最小显著性差异法(LSD)进行方差分析。
2 结果与分析
2.1 OsLAC6基因的表达模式分析
从图1 可见,OsLAC6基因在水稻不同生长发育阶段的组织中具有不同的表达模式,在分蘖期和成熟期的根系、茎、叶片以及分蘖期的节中表达量比较高;而在幼苗期的茎、叶片、根茎结合部以及孕穗期和抽穗期的小穗、开花期的颖壳和花中表达量较低。此外,与幼苗期的茎和叶片相比,OsLAC6基因在水稻幼苗期根系中的表达量相对较高。

图1 OsLAC6基因在水稻不同生长发育阶段各组织中的表达水平Fig.1 Expression level of OsLAC6 gene in tissues at different growth stages in rice
2.2 阳性转OsLAC6基因水稻植株的鉴定
共获得30 个转OsLAC6基因T0植株。使用OsLAC6基因和载体的特异引物进行PCR 检测(图2),发现24个为转基因阳性植株(OE-OsLAC6),阳性率达80%。

图2 部分转OsLAC6基因水稻植株的PCR检测Fig.2 PCR detection of partial transgenic rice plants overexpressing OsLAC6 gene
运用实时荧光定量PCR(qRT-PCR)分析OsLAC6基因在阳性转基因水稻幼苗叶片中的表达情况,发现OsLAC6基因在各转基因株系中均上调表达,特别是在OE-OsLAC6-4、OE-OsLAC6-20株系中的表达量分别极显著上调了约5 458、1 236 倍(图3)。综合考虑各转基因株系的种子量及OsLAC6基因的表达水平等,选择上述2 个株系进行后续研究。
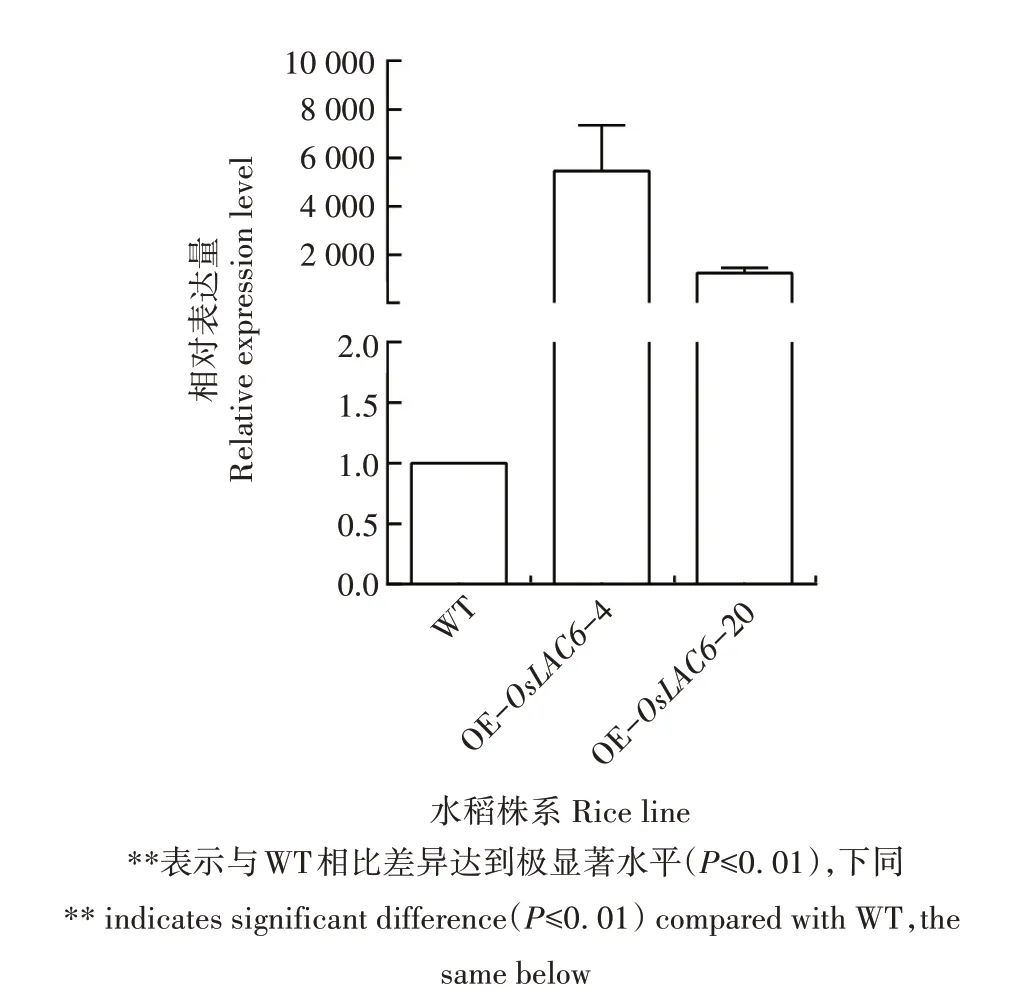
图3 转OsLAC6基因水稻株系叶片中OsLAC6基因的表达分析Fig.3 Expression of the OsLAC6 gene in the leaves of transgenic rice lines overexpressing OsLAC6 gene
2.3 转OsLAC6基因水稻植系漆酶活性分析
从图4 可以看出,转基因株系OE-OsLAC6-4 和OE-OsLAC6-20 叶片中漆酶活性分别比WT 极显著增加13.8%和23.9%,表明超表达OsLAC6基因显著提高了转基因水稻漆酶活性。
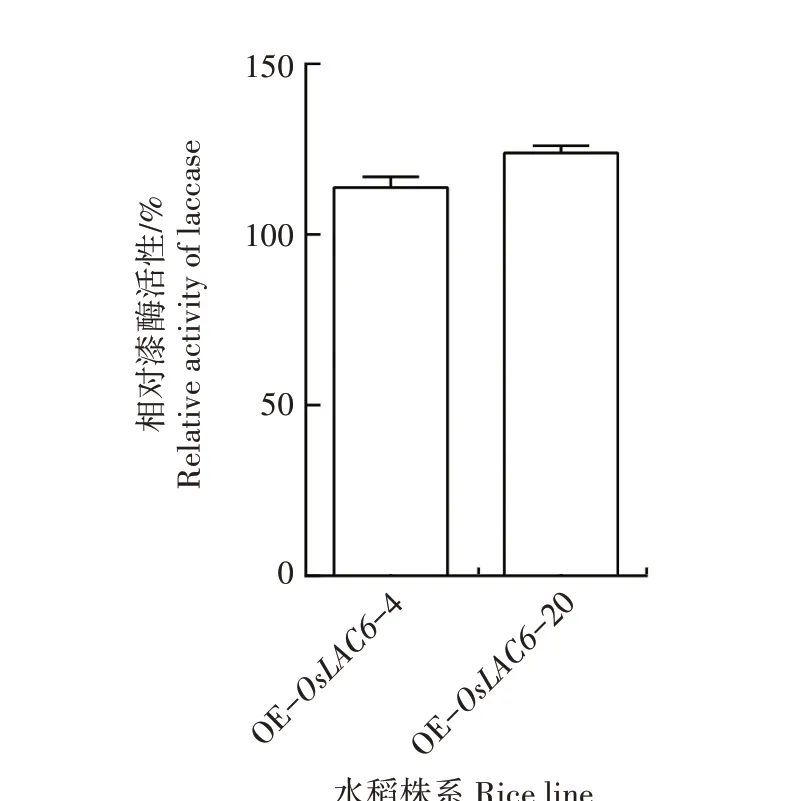
图4 转OsLAC6基因水稻株系漆酶活性分析Fig.4 Analysis of laccase activity of transgenic rice lines overexpressing OsLAC6 gene
2.4 转OsLAC6基因水稻株系的亚砷酸盐耐受性分析
与WT 相比,经25 μmol/L As(Ⅲ)处理3 d,转OsLAC6基因水稻株系的叶片出现明显卷曲,低叶位叶片开始黄化,并且随着处理时间的延长,其叶片枯黄程度加剧。至处理7 d 时,WT 叶片仅轻微卷曲,而2个转OsLAC6基因水稻株系的叶片大部分已枯萎(图5);且2个转基因水稻株系的根系相对伸长量显著低于WT(图6),表明其根系的生长受到严重抑制。综上,超表达OsLAC6基因明显降低了转基因水稻对亚砷酸盐的耐受性。

图5 As(Ⅲ)处理7 d后WT和转OsLAC6基因水稻株系的表型Fig.5 Phenotypes of WT and transgenic rice lines overexpressing OsLAC6 gene after As(Ⅲ)treatment for 7 days
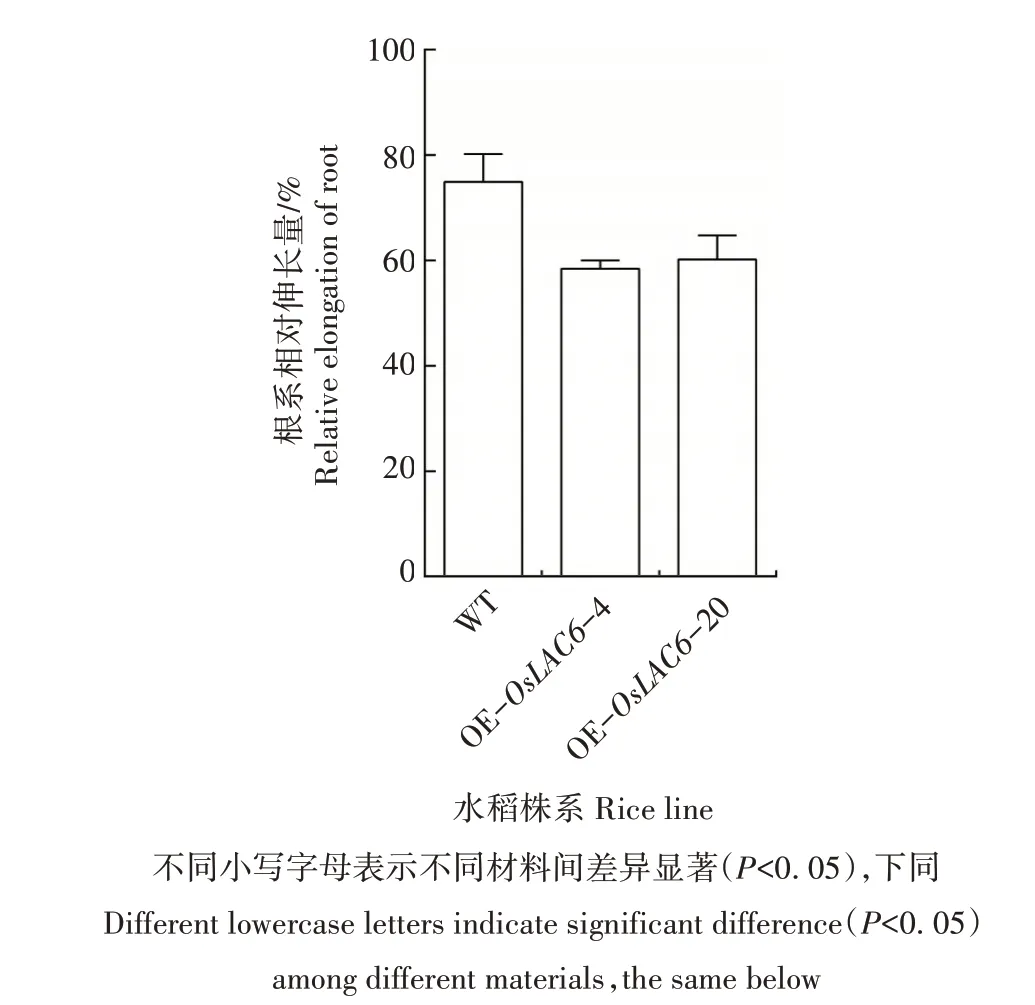
图6 As(Ⅲ)处理7 d后WT和转OsLAC6基因水稻株系根系相对伸长量的比较Fig.6 Comparison of relative root elongation of WT and transgenic rice lines overexpressing OsLAC6 gene after As(Ⅲ)treatment for 7 days
2.5 亚砷酸盐胁迫条件下转OsLAC6基因水稻株系生理生化指标分析
2.5.1 叶绿素含量 叶片枯黄是水稻砷中毒的主要症状之一,这主要是因为叶绿素含量的改变[24]。从图7 可以看出,在正常生长条件下,WT 和转OsLAC6基因水稻株系叶片的叶绿素含量并无明显不同。As(Ⅲ)处理后,WT 和转OsLAC6基因水稻株系叶片的叶绿素含量均出现不同程度的下降。其中,WT未达到显著水平,而2个转OsLAC6基因水稻株系均达到显著水平。
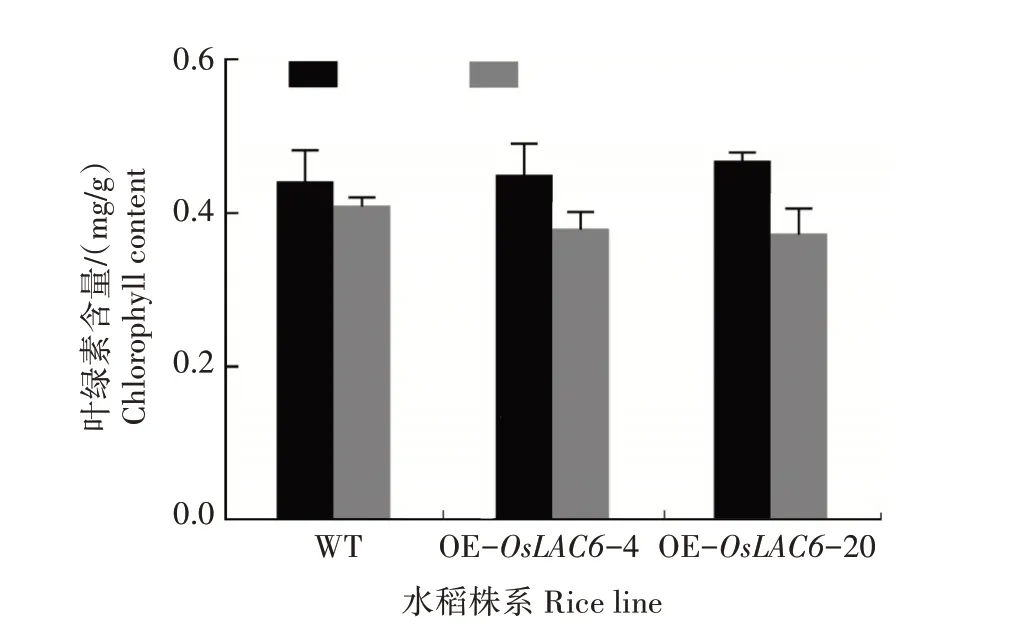
图7 As(Ⅲ)处理后WT和转OsLAC6基因水稻株系叶绿素含量的比较Fig.7 Comparison of chlorophyll content of WT and transgenic rice lines overexpressing OsLAC6 gene after As(Ⅲ)treatment
2.5.2 过氧化氢含量 在砷胁迫条件下,水稻体内会产生大量活性氧,使氧化还原平衡遭到破坏,对植株造成过氧化损伤[24]。DAB 可被过氧化氢氧化形成沉淀。因此,可通过DAB 染色推断各水稻材料所受氧化胁迫的程度。从图8 可以看出,在对照条件下,WT 和转OsLAC6基因水稻株系间并无明显差异;As(Ⅲ)处理7 d 后,相较于WT,转OsLAC6基因水稻株系叶片的染色程度更深且范围更广,表明亚砷酸盐胁迫下转OsLAC6基因水稻比WT 遭受了更严重的氧化伤害。

图8 As(Ⅲ)处理后WT和各转OsLAC6基因水稻株系叶片的DAB染色Fig.8 DAB staining in the leaves of WT and transgenic rice lines overexpressing OsLAC6 gene after As(Ⅲ)treatment
2.6 转OsLAC6基因水稻植株根系木质素含量分析
从图9 可以看出,在正常生长条件下,WT 植株的根系染色较深,呈现出明显的红色,而2 个转OsLAC6基因水稻株系的根系染色明显较浅,表明超表达OsLAC6基因使转基因水稻根系中的木质素含量大幅度减少。

图9 WT和转OsLAC6基因水稻株系根系木质素含量比较Fig.9 Comparison of lignin content in the roots of WT and transgenic rice lines overexpressing OsLAC6 gene
3 结论与讨论
近年来,有关水稻耐砷性基因的鉴定及耐砷机制解析等方面取得了重要进展[4-5,25-28]。研究发现,超表达磷酸盐转运蛋白基因OsPT4和OsPT8会显著降低转基因水稻的耐砷性[25-26];相反,超表达砷酸还原酶基因OsHAC1;1、OsHAC1;2和OsHAC4以及C 型ATP 结合盒转运蛋白基因OsABCC1的转基因植株的耐砷性显著增强[5,27-28]。这些基因主要负责水稻中As(Ⅴ)和As(Ⅲ)吸收、As(Ⅴ)还原以及阻隔砷向籽粒转移等。此外,miRNA 也参与调控水稻应答砷胁迫的生物学过程[6,29]。在水稻中,超表达miR528可致使转基因植株对砷的敏感性增强[6]。本研究发现,OsLAC6基因可负调控水稻对亚砷酸盐的耐受性,这不仅丰富了对水稻漆酶生物学功能的认识,更扩展了对水稻应答砷胁迫机制的理解。
木质素在植物应对生物和非生物胁迫过程中发挥着重要作用,而漆酶可通过调控植物木质素代谢影响其生长发育和逆境胁迫应答。ZHAO 等[9]研究发现,在拟南芥Atlac4、Atlac11和Atlac17三突变体的根系中几乎检测不到木质素,表明上述漆酶基因正调控木质素的合成。水稻OsLAC10和棉花GhLAC1等基因通过促进木质素合成而增强植物对铜离子、病原菌和虫害胁迫的耐受能力[7,12]。但是,超表达拟南芥AtLAC2基因可降低转基因植株地上部木质素含量,从而负调控植物的生长发育[30]。同样地,本研究发现,超表达OsLAC6基因会大幅降低转基因水稻根系木质素含量。因此,OsLAC6基因可能与漆酶家族中其他成员如OsLAC10基因等具有相反的生物学功能。推测超表达OsLAC6基因所出现的耐砷性下降也许与转基因植株中木质素含量减少有关,但具体的作用机制还需进一步研究。

