“自身清”双向调节JAK2/STATs信号通路抑制系统性红斑狼疮小鼠肺间质病变的研究❋
谈欣怡, 谭奚扬, 曹左媛, 陈晓云
(上海中医药大学附属龙华医院, 上海 200032)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫应答异常,多种自身抗体产生累及多器官多系统的免疫疾病,女性的发病率为男性的10倍[1]。肺脏是SLE常易侵犯的器官,其中间质性肺病(interstitial lung disease,ILD)发病率高达50%,是SLE的主要并发症之一[1]。目前SLE-ILD的发病机制尚不明确,且缺乏有效的治疗药物。有研究表明,酪氨酸激酶2/信号传导与转录激活子(janus kinase 2/signal transducer and activator of transcriptions,JAK2/STATs)信号通路可以刺激辅助性T细胞17(helper T cells 17,Th17)分化,诱导多种炎症细胞因子释放,促进肺纤维化[1]。因此,纠正Th17和调节性T细胞(regulatory T cell,Treg)平衡可能具有改善SLE-ILD的作用。中医药治疗ILD具有一定的优势,已成为近年来研究的热点[2,3]。上海市名中医陈湘君教授根据SLE肝肾亏虚、热毒内蕴的基本病机研发出经验方“自身清”,治疗SLE及其并发症效果显著[4-6]。前期研究发现,该方具有控制炎症、调节细胞免疫等作用[7-9],临床发现其对抑制SLE-ILD有良好效果。本研究通过观察“自身清”对SLE-ILD模型小鼠肺组织病理学、Th17/Treg平衡及白细胞介素17A(interleukin-17A,IL-17A)、 转化生长因子(transforming growth factor-β1,TGF-β1)表达水平影响,探讨其对SLE-ILD抗炎及抗纤维化作用机制,为今后治疗SLE-ILD提供依据。本研究通过上海中医药大学附属龙华医院实验动物伦理委员会批准(批号LHERAW-19011)。
1 材料
1.1 动物
SPF级11周龄雌性MRL/lpr小鼠40只和MRL/MpJ小鼠8只,体质量20~23 g,购自上海斯莱克实验动物有限公司,实验动物许可证号SCXK(沪)2017-0005。饲养于上海中医药大学附属龙华医院SPF级实验动物中心,温度(23±3) ℃,相对湿度35%~45%,光照12 h昼夜循环,自由摄食饮水。
1.2 药物
“自身清”组成:黄芪15 g,白术6 g,白芍15 g,地黄15 g,山茱萸9 g,白花蛇舌草15 g,牡丹皮15 g,丹参15 g,青蒿15 g,赤芍15 g,制何首乌12 g,甘草5 g,重楼15 g,由上海中医药大学附属龙华医院新药颗粒剂药房提供并制备。枸橼酸托法替布片(批号CG3062)尚杰,规格5 mg/片,由辉瑞公司提供。
1.3 主要试剂
苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒、BCA蛋白浓度测定试剂盒、RIPA裂解液、蛋白酶磷酸酶抑制剂混合物、SDS-PAGE凝胶快速配制试剂盒、BeyoECL Star(特超敏ECL化学发光试剂盒),均购自上海碧云天生物技术有限公司(货号分别为C0105 S、P0010 S、P0013B、P1046、P0012 AC、P0018 AS);改良马松(Masson)三色染色试剂盒,购自北京索莱宝科技有限公司(货号G1346);JAK2抗体、磷酸化JAK2(phosphorylated-JAK2,P-JAK2)抗体、STAT3抗体、磷酸化STAT3(phosphorylated-STAT3,P-STAT3)抗体、STAT5抗体、磷酸化STAT5(phosphorylated-STAT5,P-STAT5)抗体,均购自CST公司(货号分别为3230、4406、30835、9145、94205、9359);叉头状螺旋转录因子3 (fork-head box p3,Foxp3)抗体、维甲酸相关核孤儿受体γt(retinoid-associated orphan receptor γt,RORγt)抗体,购自英国Abcam公司(货号分别为ab215206、ab207082);小鼠IL-17A高敏ELISA试剂盒、人/小鼠/大鼠TGF-β1 ELISA试剂盒,购自杭州联科生物技术股份有限公司(货号分别为70-EK217HS-96、70-EK981-96)。
1.4 仪器设备
多样品组织研磨机(上海净信科技有限公司,型号Tissuelyser-24);PowerPac 基础电泳仪、Mini-PROTEAN Tetra电泳槽、小型Trans-Blot转印槽(伯乐生命医学产品有限公司,型号分别为164-5050、165-8001、170-3930);凝胶成像系统(上海勤翔科学仪器有限公司,型号CHEMISCOPE 6300);离心机(德国Eppendorf公司,型号5242R);全自动组织脱水机、组织包埋机、轮转切片机、组织摊片机(德国Leica公司,型号分别为TP1020、EG1150、RM2235、H11210);正置显微镜(日本Nikon公司,型号ECLIPSE Ci);酶标仪(美国伯腾仪器有限公司,型号Synergy H1MF)。
2 方法
2.1 分组与干预
适应性喂养1周后,随机抽取2只MRL/lpr小鼠肺组织行HE和Masson染色,验证模型建立。将40只MRL/lpr小鼠按体质量随机分为模型组、低剂量组、中剂量组、高剂量组、托法替布组每组8只,另将8只MRL/MpJ小鼠作为野生型对照组。中药根据实验动物与人体表面积折算[10,11],即单位体质量小鼠日给药剂量为单位体质量成人日处方量的9.1倍作为中剂量组小鼠日灌胃剂量,高剂量组为中剂量组2倍,低剂量组为中剂量组0.5倍。以蒸馏水溶解,最终制备成浓度为0.962 g/(kg·d)、1.925 g/(kg·d)、3.849 g/(kg·d)浓缩液,即低、中、高剂量组给药浓度。以蒸馏水溶解托法替布,配制成终浓度为10 mg/(kg·d)的混悬液。模型组和野生型对照组给予0.9%氯化钠溶液灌胃。各组小鼠每日灌胃1次,每次灌胃体积为0.2 mL/20 g,连续灌胃4周。
2.2 样本采集
以2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉小鼠后打开小鼠胸腔,用0.9%氯化钠溶液进行心脏灌注。完成灌注后,取小鼠左肺叶置于4%多聚甲醛中固定,常温固定48 h,备石蜡切片用。取小鼠右肺上叶、中叶分别放入事先分组标记好的冻存管中,-80 ℃备用。
2.3 病理学染色
取小鼠固定后的左肺叶行石蜡包埋并切片,切片厚度4 μm,每组各取4只小鼠分别进行HE和Masson染色,中性树胶封片,晾干后置于显微镜下观察拍照。
2.4 蛋白免疫印迹
每组各取4只小鼠-80 ℃冰箱中保存右肺上叶组织,20 mg加入100 μL裂解液,并按照说明书加入一定量的PMSF和蛋白酶磷酸酶抑制剂,匀浆后取上清,BCA法测定蛋白浓度。取待检测蛋白样品上样量30 μg电泳、转膜、封闭、洗膜。将膜放入孵育盒中分别加入兔源一抗P-STAT3(1∶2000)、STAT3(1∶1000)、P-JAK2(1∶1000)、JAK2(1∶1000)、P-STAT5(1∶1000)、STAT5(1∶1000)、Foxp3(1∶1000)、RORγt(1∶1200)和β-actin(1∶2000),4 ℃孵育过夜,二抗室温孵育2 h。洗膜后加入化学发光检测试剂,用凝胶成像系统显影分析。
2.5 ELISA检测
每组各取4只小鼠右肺中叶组织50 mg,按照ELISA试剂盒说明书测定肺组织中IL-17A和TGF-β1含量。
2.6 统计学方法

3 结果
3.1 “自身清”对MLR/lpr小鼠肺脏组织病理学影响
图1示,HE和Masson染色显示,野生型对照组MRL/MpJ小鼠肺组织结构完整,肺泡结构正常,未见淋巴细胞浸润和胶原纤维沉积。模型组和“自身清”低剂量组小鼠肺组织结构明显破坏,肺泡结构紊乱,肺泡壁断裂,肺泡间隔明显增宽,伴大量淋巴细胞浸润,胶原纤维沉积,部分可见肺实变。“自身清”中、高剂量组和托法替布组小鼠肺组织结构部分破坏,肺泡结构较紊乱,少量肺泡壁断裂,肺泡间隔部分增宽,淋巴细胞浸润和胶原纤维沉积较模型组和“自身清”低剂量组减少。
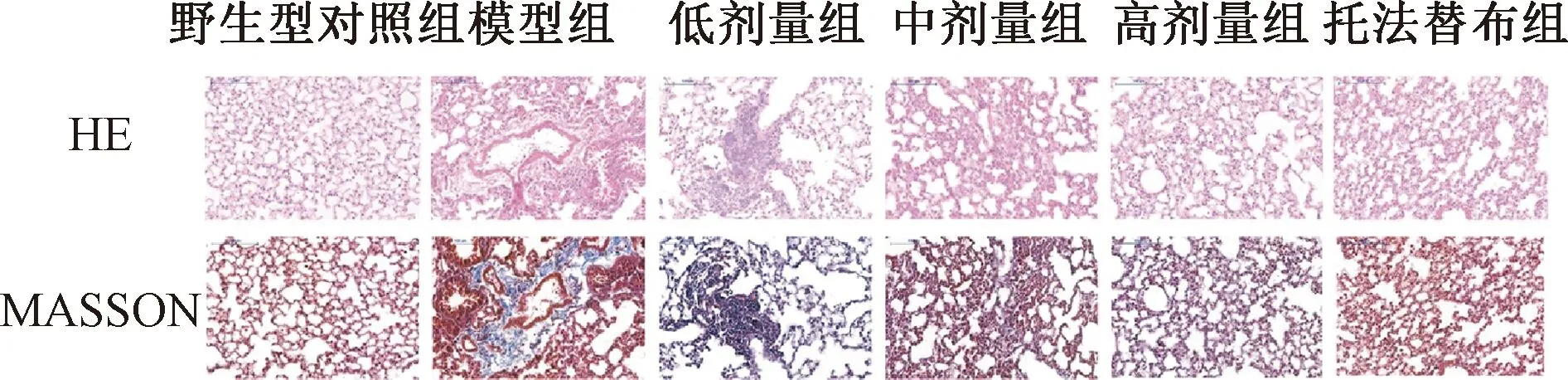
图1 各组小鼠肺组织HE和MASSON染色病理结果比较(×200)
3.2 “自身清”对各组小鼠肺组织JAK2/STATs信号通路相关蛋白的影响
表1图2示,与野生型对照组比较,模型组小鼠肺组织中p-STAT3、p-STAT5蛋白相对表达显著降低(P<0.05),p-JAK2、RORγt、Foxp3蛋白相对表达显著升高(P<0.05)。与模型组比较,“自身清”低、中、高剂量组小鼠肺组织中p-STAT3、p-JAK2、RORγt蛋白相对表达显著降低(P<0.05),p-STAT5、Foxp3蛋白相对表达显著升高(P<0.05);托法替布组小鼠肺组织p-STAT3、p-JAK2、RORγt蛋白相对表达显著降低(P<0.05)。与托法替布组比较,“自身清”低剂量组小鼠肺组织中p-STAT5、Foxp3蛋白相对表达显著升高(P<0.05)。
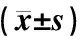
表1 各组小鼠肺组织p-JAK2、p-STAT3、p-STAT5、RORγt、Foxp3蛋白表达结果
3.3 “自身清”对各组小鼠肺组织细胞因子IL-17A和TGF-β1含量的影响
表2示,与野生型对照组比较,模型组小鼠肺组织中IL-17A含量显著升高(P<0.05),TGF-β1含量显著降低(P<0.05)。与模型组比较,“自身清”低、中、高剂量组和托法替布组小鼠肺组织中IL-17A含量显著降低(P<0.05),TGF-β1含量显著升高(P<0.05)。
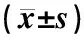
表2 各组小鼠肺组织细胞因子IL-17A和TGF-β1水平比较
4 讨论
SLE-ILD是继发于SLE的一种以肺部慢性炎症及肺纤维化为主要病理改变的疾病。根据临床表现,其属于中医学“肺痹”“肺痿”等范畴。SLE日久,素体亏虚,湿热与热毒久伏于内侵袭肌表,流注筋骨关节发为五体痹。五体痹者易受外邪侵袭,若风寒湿等邪气杂至,外邪引动伏邪则致病情进展,五体之痹内舍于肺发为肺痹。肺痹日久,耗伤肺阴致使“肺热叶焦”,肺叶萎弱不用发为“肺痿”[12],其病机总属本虚标实,肺肾亏虚为本,肺络痹阻、痰瘀互结为标。前期研究已发现,“自身清”中方药组成通过益气、活血、化瘀等作用可以有效治疗风湿性肺间质病变[13]。

注:A.野生型对照组;B.模型组;C.低剂量组;D.中剂量组;E.高剂量组;F.托法替布组;磷酸化STAT3(phosphorylated-STAT3,p-STAT3),磷酸化JAK2(phosphorylated-JAK2,p-JAK2),磷酸化STAT5(phosphorylated-STAT5,p-STAT5),叉头状螺旋转录因3(fork-head box p3,Foxp3),维甲酸相关核孤儿受体γt(retinoid-associated orphan receptor γt,RORγt)图2 各组小鼠肺组织p-JAK2、p-STAT3、p-STAT5、RORγt、Foxp3免疫印迹条带
自身免疫性疾病MRL/MpJ小鼠及其Faslpr基因敲除MRL/lpr小鼠组织病理学及血清学表现与人SLE发病相似,常用于SLE及其相关疾病研究。与MRL/MpJ小鼠比较,MRL/lpr小鼠因Faslpr基因突变,抑制T淋巴细胞凋亡,加速小鼠免疫损伤形成和进展[14,15]。且已有研究发现,MRL/lpr小鼠在8周龄时肺泡壁出现淋巴细胞浸润,14周龄发生严重肺纤维化[16],其ILD的发生相较于其他肺纤维化小鼠模型更符合SLE-ILD发病机制。因此,本实验选用MRL/lpr小鼠作为模型鼠,MRL/MpJ作为野生型对照组。本实验结果发现,12周龄MRL/MpJ小鼠肺组织结构完整,肺泡壁连续未见淋巴细胞浸润;MRL/lpr小鼠肺组织已出现肺泡结构紊乱,肺泡间隔增宽,大量淋巴细胞浸润,部分胶原纤维沉积等病理表现,基本符合SLE-ILD病理表现,说明模型成功。在本实验中,经“自身清”治疗后小鼠肺组织肺泡炎症及肺纤维化明显减轻,并具有剂量依赖性,提示“自身清”可以减少SLE-ILD小鼠肺组织炎症细胞浸润,促进肺组织修复,延缓肺纤维化进程,说明“自身清”对SLE-ILD具有一定的治疗作用。
SLE-ILD的发生与自身免疫系统紊乱密切相关[17],其中JAK2/STATs信号通路介导Th17/Treg失衡是其发病机制之一。生理状态下,Th17/Treg处于动态平衡状态,维持机体免疫稳态。当肺组织损伤时,炎症因子IL-6联合TGF-β激活JAK2/STAT3信号通路,促使CD4+T细胞向CD4+Th17细胞分化,增加IL-17分泌,诱导上皮细胞凋亡、纤维细胞活化和增生、胶原蛋白沉积,加速肺纤维化进展[18,19]。Chen[20]等研究发现,在病原体攻击肺组织时,Th17细胞可以分泌大量IL-17A,加重肺组织损伤,导致肺纤维化形成。独立存在的TGF-β可以诱导CD4+T淋巴细胞向CD4+CD25+Foxp3+Treg细胞分化[21]。IL-2亦可联合TGF-β激活STAT5,诱导CD4+CD25+Foxp3+Treg细胞的分化[22]。当机体Treg细胞占优势时,可以抑制Th17的分化及炎症反应,延缓ILD进程[23]。由此可见,单一抑制Th17细胞分化或促进Treg细胞分化并不是控制CTD-ILD的最佳途径,纠正Th17/Treg失衡状态才是治疗CTD-ILD的关键。
本实验结果发现,经“自身清”治疗后小鼠肺组织中p-JAK2、p-STAT3、RORγt蛋白表达呈剂量依赖性降低,p-STAT5、Foxp3蛋白表达明显升高,低剂量组尤甚,且IL-17A水平明显低于模型组,TGF-β1水平明显高于模型组,表明“自身清”对SLE-ILD小鼠肺组织中JAK2/STAT3信号通路具有抑制作用,减轻肺部炎症及纤维化;此外“自身清”可以活化STAT5/Foxp3相关信号通路,纠正Th17/Treg失衡,延缓肺纤维化进展。由此可见,不同浓度的“自身清”可以选择性调控JAK2/STATs信号通路,双向调节Th17/Treg分化,温和抑制SLE-ILD进展。在本实验中,经托法替布治疗后小鼠肺组织中各蛋白均出现明显降低,IL-17A分泌较模型组减少,说明托法替布可以完全抑制SLE-ILD小鼠肺组织中JAK2/STATs信号通路,控制SLE-ILD发展,提示托法替布作为JAK抑制剂可以非选择性地抑制JAK2/STATs信号通路,在疾病的急性期可以快速阻断炎症进展,然而长期使用会导致机体细胞免疫功能低下,增加感染的风险[24]。可见,两类药物对JAK2/STATs信号通路的影响不同,结合本实验结果可以推测,急性期二者联合使用可以有效控制疾病进程,缓解期小剂量维持使用 “自身清”对控制疾病复发更具优势。
综上所述,“自身清”通过选择性调控JAK2/STATs信号通路,一方面抑制JAK2/STAT3活化,抑制Th17分化及IL-17A分泌,减轻肺部炎症及纤维化;另一方面小剂量使用“自身清”,可以活化STAT5/Foxp3相关信号通路,促进Treg细胞分化,纠正Th17/Treg失衡,恢复免疫稳态,且由此导致TGF-β1分泌适量增加,不影响SLE-ILD病情缓解。本研究只是初步探讨“自身清”对SLE-ILD的治疗作用及JAK2/STATs信号通路的调控作用,关于JAK/STATs信号通路完整的调控机制,如对JAK1、JAK3等作用尚须进一步研究。

