Ti/SnO2-Sb-Yb电极电催化氧化吡啶废水的研究
胡 馨,王春荣,*,李海燕,2
(1.中国矿业大学(北京) 化学与环境工程学院,北京 100083;2.贵州工程应用技术学院 土木建筑工程学院,贵州 毕节 551700)
0 引 言
随着钢铁行业的发展,焦炭的需求激增,到2020年,中国焦炭产量将超过4亿吨[1]。在焦炭生产过程中产生的高浓度焦化废水具有毒性大、性质不稳定、污染环境等特点[2],且焦化废水难以生物降解,经过厌氧-好氧联合处理后,大部分烯烃和炔烃能够降解,但如吡啶、吲哚等生化性质较差的物质经生化处理后仍有很大的残留[3]。吡啶具有强刺激性,能够引发多发性神经病,且具有致癌风险,对人类健康和生存环境都存在极大的威胁[4]。电化学氧化技术具有氧化性能强、处理条件温和、环境相容性好等优点,是一种有效的深度处理难降解有机污染物的技术[5]。目前电化学氧化技术处理难降解废水所用的电极主要有非金属电极、金属电极及金属氧化物电极。其中非金属电极导电性高,但其硬度小、机械强度差、电流矿化效率低;金属电极机械强度大但易钝化;Ti/SnO2-Sb电极是一种金属氧化物电极,由于阳极表面相互作用力小,所以有机物去除率相对较高,但其稳定性较差。大多数稀土元素没有5d电子,可以提供良好的电子转移轨道,为“催化作用”作电子转移站,因此,稀土元素及其化合物具有较高的催化活性[6]。本文采用Ti/SnO2-Sb-Yb阳极电催化氧化吡啶废水,分析阳极氧化体系中运行参数对吡啶以及TOC降解效率的影响,并以Ti/SnO2-Sb阳极为对比,进行电化学反应动力学以及能耗分析。
1 试验材料和方法
1.1 试剂与材料
Ti/SnO2-Sb-Yb阳极与Ti/SnO2-Sb阳极(50 mm×50 mm×1 mm)均由本课题组制备,制备方法为热分解法。首先将钛板进行打磨、碱洗、酸蚀,然后将经过预处理后的钛板放入制备好的前驱体溶液中进行涂膜,经过多次涂膜、热处理、焙烧工艺,最终制得电极。甲醇为高效液相色谱(HPLC)级,吡啶、硫酸钠、氢氧化钠和硫酸(95%~98%)均为分析级,所有溶液均在去离子水中配制。
1.2 实验装置
分别以Ti/SnO2-Sb-Yb与Ti/SnO2-Sb两种电极为阳极,相同面积的钛板作为阴极,外接直流电源用来控制电流,电解槽容积为50 mL,实验装置如图1所示。

图1 反应装置图Fig.1 Reaction device diagram
1.3 测试方法
吡啶浓度采用带有C-18色谱柱(250 nm × 4.6 nm × 5 nm)的高效液相色谱仪(Ultimate 3000)进行测定,检测波长λ=254 nm,柱温为35 ℃,流动相为甲醇和水的混合液(体积比为70∶30),流速为1.0 mL/min,进样量为20 uL。TOC的浓度采用总有机碳分析仪进行测定。本试验设置3组平行试验、1组对照试验、1组空白试验并且在每次试验前均进行仪器的校准来减少实验误差。
2 结果与分析
2.1 Ti/SnO2-Sb-Yb阳极电催化氧化吡啶的研究
2.1.1 电流密度的影响
污染物的去除率在一定范围内随着电流密度的增加而快速增加,所以增加电流密度可以缩短反应时间,但缩短反应时间的同时也会加剧副反应发生,造成电极使用寿命的减少及电能损失;当电流密度低时,则需要通过增大极板面积或延长反应时间来增加去除率,导致处理周期及成本的增加,所以选择适宜的电流密度可以确保反应经济有效地运行。本文在电解质浓度为40 mmol/L,极板间距为10 mm,初始pH为7,吡啶初始浓度为50 mg/L的条件下探究了10、15、20、25、30 mA/cm2五种电流密度影响因素对电化学降解吡啶效果的影响,试验结果如图2所示。


图2 不同电流密度对吡啶和TOC去除效果图Fig.2 The effect of different current density on the removal of indole and TOC
2.1.2 电解质浓度的影响
电解质能够增加溶液导电率,节省电能消耗。有机废水导电性较弱,添加一定量电解质可以增加反应体系的导电性,降低槽电压。Cl-在弱碱性条件下容易形成次氯酸而有助于氧化反应的进行,但由于在活性电极电催化氧化有机物的体系中,·OH发挥主要作用,而Cl-被氧化为Cl2会消耗大量·OH以及电子,从而影响电流效率,故实验中选取Na2SO4为电解质。在电流密度为20 mA/cm2,极板间距为10 mm,初始pH为7,吡啶初始浓度为50 mg/L的条件下,设置了10、20、30、40、50 mmol/L五种不同水平的Na2SO4浓度,对吡啶去除效果进行探究,试验结果如图3所示。
由图3可知,当电解质浓度由10 mmol/L增加到50 mmol/L时,吡啶去除率呈现先增加后降低的趋势。电极分散层的分散性随电解质浓度的增加而减小,所以去除率在一定程度上随电解质浓度的增加而增加。但当电解质浓度增加到一定程度时,吡啶去除率反而有所下降,TOC的去除也不能得到有效提高。原因有二:一是由于随着电解质浓度逐渐增大,去除率主要取决于反应体系中有机物到阳极表面的扩散速度,大量电解质电解产生的阴阳离子以及反应过程中产生的中间产物都会增大污染物向阳极附近迁移的传质阻力,在高电解质浓度溶液中,随着反应的进行,催化层附近的吡啶浓度逐渐降低,而更多远处的污染物便因不能克服这些传质阻力而无法到达催化层参加反应导致去除率降低。二是由于电解质浓度增加到一定程度时,通过溶液的电流会超过其限制电流,离子扩散效应降低,传质恶化[9],去除率下降。相比其它因素,电解质浓度对吡啶降解效果的影响不是很明显。所以本试验电解质浓度选取40 mmol/L较为合适。
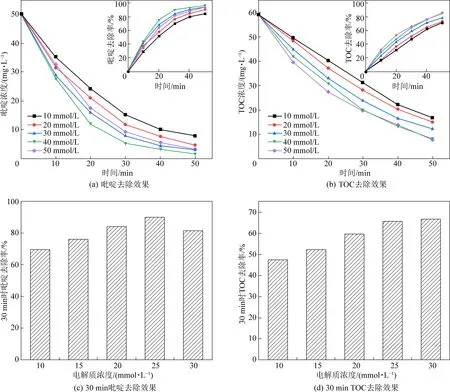
图3 不同电解质浓度对吡啶和TOC去除效果图Fig.3 The effect of different electrolyte concentrations on the removal of pyridine and TOC
2.1.3 极板间距的影响
在实际工程应用中,极板间距不仅影响反应器占地面积和运行成本,而且还会对电化学反应体系的传质产生影响[10]。在电流密度为 20 mA/cm2,初始pH为7,电解质浓度为40 mmol/L,初始吡啶浓度为 50 mg/L的试验前提下,设置了5、10、15、20、25 mm五种不同水平的极板间距,探究其对吡啶去除效果的影响,试验结果如图4所示。
由图4可知,吡啶与TOC的去除率均随极板间距的增大而降低,这是由于反应体系的电阻随极板间距的增大而增大,电阻的增大导致电流效率降低、槽电压升高,从而使得去除效果变差。极板间距由10 mm减小到5 mm时,TOC与吡啶去除效果不会得到明显改善,这是因为极板间距过小时,溶液的扩散速度远小于电解速度,浓差极化现象严重,电子的传递速率降低。除此之外,阴阳两极析出的离子也可构成与外加电场方向相反的原电池,极板间距过小,阴阳两极析出离子较多,原电池电势差较高,使得电流效率降低,污染物降解效果得不到有效提高。因此,本试验选用极板间距为10 mm较为合理。
2.1.4 初始pH值的影响
吡啶在溶液中的形态、电极的电化学性质和析氧电位等均会受到pH值的影响,从而使得吡啶在溶液中的吸附甚至污染物的降解路径发生改变,在电流密度20 mA/cm2,极板间距为10 mm,电解质浓度为40 mmol/L,吡啶初始浓度为50 mg/L的试验前提,设置了3、7、11三种不同水平的初始pH值,探究其对吡啶去除效果的影响,试验结果如图5和表1所示。
由表1可知,吡啶的去除率在pH为7时最高,pH为3时最低。这是因为在酸性条件下会加剧析氢反应的发生,使得电流效率降低。此外,强酸性条件也会使得电极活性层的金属氧化物流失,从而影响电极使用寿命。据文献报道,在中性或碱性条件下, HO-更易失去电子转化成·OH,
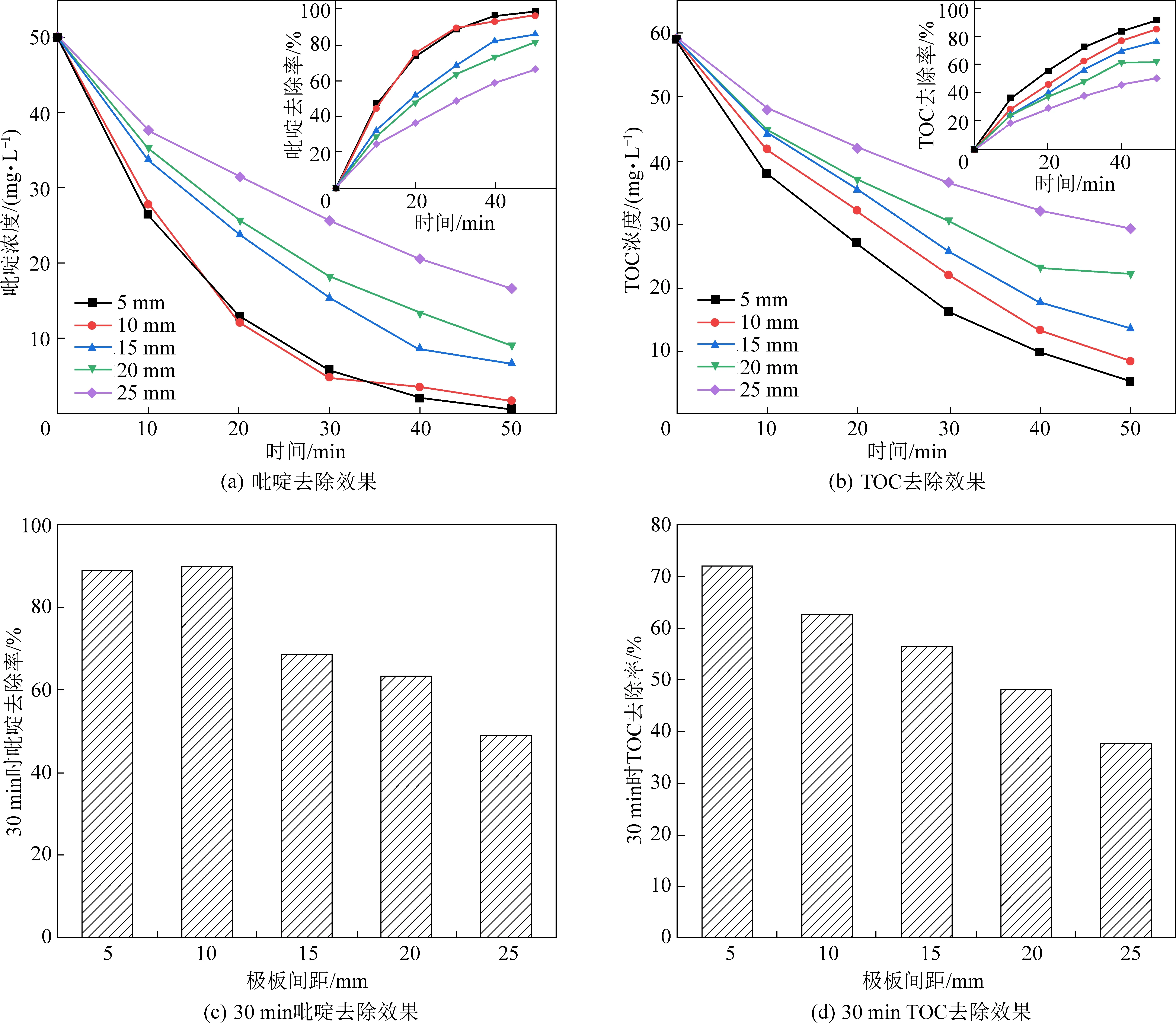
图4 不同极板间距对吡啶和TOC去除效果图Fig.4 The effect of different electrode spacings on the removal of pyridine and TOC
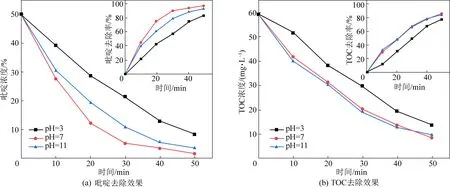
图5 不同pH对吡啶和TOC去除效果图Fig.5 The effect of different pH on the removal of pyridine and TOC

表1 不同pH体系反应30 min时的吡啶以及TOC去除率Table 1 Pyridine and TOC removal rates whendifferent pH systems react for 30 min
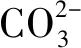

(1)

(2)
η=ε-ε0=ε-0.961-0.059pH
(3)
2.1.5 吡啶初始浓度的影响
在电流密度为20 mA/cm2,电解质浓度为40 mmol/L,极板间距为10 mm,初始pH为7的条件下,选取吡啶初始浓度为30、50、80、120 mg/L这4个水平,研究不同初始浓度下电催化氧化吡啶的降解效果。试验结果如图6和表2所示。
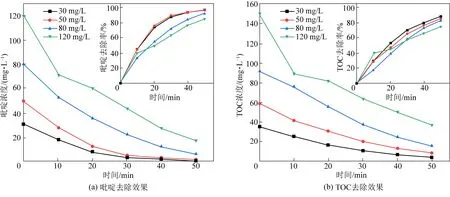
图6 不同初始浓度对吡啶和TOC去除效果图Fig.6 The effect of different initial concentrations on the removal of pyridine and TOC

表2 不同吡啶初始浓度体系反应30min时的吡啶以及TOC去除率Table 2 Pyridine and TOC removal rates when differentpyridine initial concentration systems react for 30 min
由表2可知,吡啶初始浓度由30 mg/L增加到120 mg/L时,吡啶去除率分别为97.37%、96.8%、92.56%、85.41%,TOC去除率分别为88.53%、85.62%、83.09%、75.17%,吡啶去除量从29.83 mg/L增加到102.49 mg/L,TOC去除量从31.18 mg/L增加至112.64 mg/L。 吡啶和TOC的去除率都随着初始浓度的增加而降低,这是由于当电流密度一定时,产生活性基团的量大致相等,活性基团是吡啶被降解的必要条件,浓度低时,吡啶可以与电极迅速接触而被氧化。另外发现,初始浓度高时吡啶和TOC的去除量比初始浓度低时要大得多。这是由于在低初始浓度的溶液中,较少的有机物量会加剧析氧副反应的发生。反应时间一定时,较高的有机物浓度会提高活性基团的利用率,减少析氧反应的发生,吡啶去除的绝对量较大。另外还发现,TOC与吡啶的去除速率都呈现先增加后减少的趋势,在120 mg/L的高初始浓度条件下更为显著。这是由于电解在刚开始的一段时间内,中间产物会大量产生并附着在电极表面,阻碍有机物与催化层的接触,使催化层不能有效发挥作用。在120 mmol/L的高初始浓度中,有机物与活性基团发生碰撞的概率很大,故开始阶段降解速率很高,然而也会有大量的中间产物积累,使其后续反应速率降低。杨耀辉[13]在铈掺杂的Ti/SnO2-Sb阳极电催化氧化苯酚的研究中也出现了类似的结果。
2.2 Ti/SnO2-Sb-Yb阳极电催化氧化吡啶反应动力学分析
在上文所示的最佳试验条件下,分别以Ti/SnO2-Sb与Ti/SnO2-Sb-Yb作为阳极,电化学处理初始浓度为50 mg/L的吡啶废水,对试验数据进行拟合发现吡啶的降解基本符合拟一级动力学,反应动力学各参数可由式(4)计算。
(4)
式(4)中:C代表不同时刻反应体系中的吡啶浓度;C0代表初始吡啶浓度;K为拟一级反应表观速率常数;Km为表观传质系数;S为有效电解面积;V为电解液体积。拟合结果如图7与表3所示。

图7 吡啶降解的伪一级反应动力学拟合曲线Fig.7 Pseudo first-order reaction kinetics fitting curve of pyridine degradation
两条拟合线的R2均在95%以上,说明拟合效果良好,线性关系明显。相同条件下,反应速率与表观速率常数成正比,而且传质系数越大,传质效果越好。Ti/SnO2-Sb-Yb阳极的表观传质系数与表观速率常数均大于Ti/SnO2-Sb电极,这表明稀土Yb的掺杂有利于反应速率的增加。曾雪媛[14]在以Ti/SnO2-Sb-Er为阳极电化学降解初始浓度为50 mg/L啶虫脒废水的试验中,计算发现其反应体系的表观速率常数为0.007 25,低于本实验中的表观速率常数,这也说明Ti/SnO2-Sb-Yb阳极对吡啶有着很好的降解效果。李国华[15]在以Ti/SnO2-Sb-Nd为阳极电催化氧化苯酚废水的试验中,计算发现其反应体系中的表观速率常数为0.096,是本实验中Ti/SnO2-Sb-Yb阳极电化学降解吡啶废水反应体系中表观速率常数的2.5倍,这是由于苯酚这种有机物比较容易被降解。
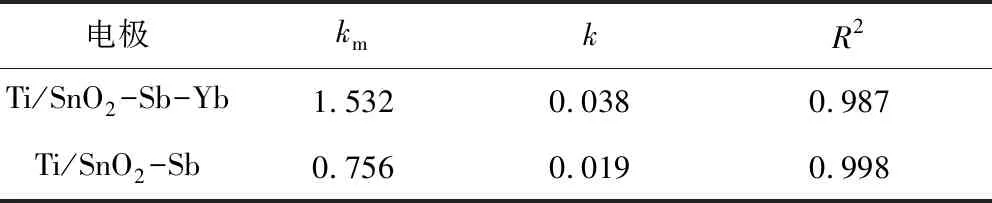
表3 不同电极电催化氧化吡啶的反应动力学常数
2.3 Ti/SnO2-Sb-Yb阳极电催化氧化吡啶废水能耗分析
为了评估Ti/SnO2-Sb-Yb电极的经济性,本试验在上文确定的最佳试验条件下,分别用Ti/SnO2-Sb与Ti/SnO2-Sb-Yb阳极处理吡啶废水,计算反应过程中的电流矿化效率(MCE)与电能消耗,并进行比较分析。电能消耗(以TOC计)如(5)所示,电流矿化效率如式(6)所示,其结果如图7所示。
(5)
(6)
式(5)中:E为电能消耗,kW·h/kg TOC;Ucell为槽压,V;I为电流,A;t为电解时间,h;ΔTOC为t时间内TOC去除量,mg/L。式(6)中: MCE 表示电流矿化效率,%;F为法拉第常数,96 487 C/mol;Vs为电解液体积,L;ΔTOCexp为TOC变化,mg/L;m为有机污染物中碳原子数量,吡啶(C5H5N)分子中m为5;I为电流,A;t为处理时间,h;n为每个污染物分子转化成CO2和H2O 所需的电子,每个吡啶分子完全矿化需要22个电子。
由图8中可以看出,反应进行50 min时,Ti/SnO2-Sb与Ti/SnO2-Sb-Yb阳极的TOC去除率分别为74.46%、85.73%,稀土Yb的掺杂使得TOC的去除率提高了11.27%。为了使电流矿化效率的变化趋势更明显,延长反应时间至90 min。电流矿化效率随着反应时间延长而降低,反应90 min 后,Ti/SnO2-Sb与Ti/SnO2-Sb-Yb阳极的电流矿化效率分别从反应10 min时的7.23%、10.11%降低至3.63%、3.71%,后者的MCE值均高于前者。延长反应时间后,TOC的降解速率与MCE值的变化均不明显,说明本反应体系并未使吡啶完全转变为CO2、H2O等无机物,有一部分以小分子有机羧酸等含碳有机物的形式存在。耿聰[16]在Ti/SnO2-Sb-Mo阳极电催化氧化苯酚废水的研究中表明,与Ti/SnO2-Sb阳极相比,其电流矿化效率可以提高4%,这与本文的研究结果也相符合。
经过计算可得,反应时间为50 min时,Ti/SnO2-Sb与Ti/SnO2-Sb-Yb阳极处理吡啶废水的能耗分别为719.69 kW·h/kg TOC和559.28 kW·h/kg TOC,后者能耗更低。Yb的掺杂增加了表观传质系数,使得电流效率有效提高,而且稀土元素的掺杂还可以降低电极的电阻,使得有机物降解速率加快[17],从而导致反应能耗降低。

图8 TOC浓度与矿化电流效率(MCE)比较Fig.8 Comparison of TOC concentration and mineralization current efficiency (MCE)
3 结 论
本文系统研究了Ti/SnO2-Sb-Yb阳极在不同运行条件下对吡啶的降解效果,讨论了电流密度、电解质浓度、pH值、极板间距以及初始污染物浓度对阳极氧化效果的影响,并以Ti/SnO2-Sb阳极为对比,对反应过程中的能耗以及反应动力学各参数进行比较分析。实验结果表明:
(1)在一定范围内,吡啶降解效果随着电流密度和电解质浓度的增加而增强;在中性条件下,吡啶降解效果更好;该阳极对于低浓度及高浓度的吡啶都有很好的降解效果,在吡啶初始浓度低时,其降解效果更好。
(2)在吡啶初始浓度为50 mg/L,电流密度为20 mA/cm2,电解质浓度为40 mmol/L,极板间距为10 mm,初始pH为7的条件下反应50 min,吡啶和TOC的去除率分别为96.8%、85.62%。
(3)在Ti/SnO2-Sb-Yb和Ti/SnO2-Sb电极电催化氧化吡啶的反应体系中,吡啶的降解基本符合拟一级动力学,与Ti/SnO2-Sb阳极相比,稀土Yb的掺杂使得反应体系中表观速率常数与表观传质系数、TOC去除率以及电流矿化效率得以增加,电能消耗得以降低。

