VPAHPND 拮抗菌筛选鉴定及其活性物质的初步研究
冯艳琴,沈辉,王兴强,蒋葛,乔毅,李吉云,3
(1.江苏海洋大学,江苏 连云港 222000;2.江苏省海洋水产研究所,江苏 南通 226007;3.南京师范大学,江苏 南京 210000)
近年来,对虾急性肝胰腺坏死病(Acute hepatopancreas necrosis disease,AHPND)自2009 年暴发以来,相继在越南、马来西亚、泰国以及菲律宾等国家流行[1,2]。该病感染凡纳滨对虾(Litopenaeus vannamei)引起对虾空肠空胃、肝胰腺萎缩及糜烂,短时间内出现较高的致死率,具有较强传染性[3]。2011年该病使越南约70%的凡纳滨对虾养殖受到损失,我国华南地区凡纳滨对虾产量也下降80%以上,泰国凡纳滨对虾产量减半。该病原为携带PriA 和PriB二元毒力蛋白的一类弧菌,以副溶血性弧菌(Vibrio parahaemolyticus,VP)最为常见[4,5]。
目前,针对AHPND 没有非常有效的防控措施,养殖过程中常以水体消毒、抗生素和蛭弧菌使用为主[6,7]。相关研究表明,氟苯尼考对AHPND 有短期抑制效果[8],但抗生素的使用会破坏虾体肠道菌群稳定性,迅速诱导细菌产生耐药性[9]。目前,关于AHPND 的研究主要集中在病理方面,其防治措施的研究还较少。近年来,利用拮抗菌抑制及防治病原菌逐渐成为新的生态防控趋势[10,11],主要利用微生物产生特殊的代谢产物或改变环境条件来抑制,甚至杀死另一种微生物的机制,在病害防治中发挥重大作用[12]。邓书香[13]发现,当斑马鱼(Danio rerio)受到副溶血性弧菌急性感染时,地衣芽孢杆菌具有一定的保护效果。乳酸片球菌(Pediococcus acidilactici)可针对细角滨对虾(Litopenaeus stylirostris)的夏季弧菌性败血症,使虾体中的弧菌数量明显降低[14]。
本研究拟从江苏沿海海域海水、沉积物及海洋生物体中筛选鉴定出对致急性肝胰腺坏死病的副溶血性弧菌(VPAHPND)具有抑制作用的拮抗菌,研究其拮抗能力及其活性物质,以期为AHPND 防控提供新的思路。
1 材料与方法
1.1 材料
实验用VPAHPND菌株采自2017—2020 年患该病的南美白对虾肝胰腺组织,快速取出后,超低温冻存(-80℃),对其感染的VPAHPND分离鉴定后保存于江苏省海洋水产研究所菌库中。2018 年采集江苏沿海海域水样、沉积物及海洋生物体等样品,分离、筛选及鉴定拮抗菌。
细菌微量生理生化反应鉴定管购自杭州滨河微生物试剂有限公司;16S rDNA 扩增通用引物27F/1492R、gyrB 引物up-1s/up-2Sr 等由上海生工生物有限公司进行基因合成。
1.2 方法
1.2.1 拮抗菌的分离筛选与保存
用LB、2216E、高氏一号三种培养基分离细菌,固体平板于28℃恒温培养24 h,液体纯化培养后加入无菌甘油至终浓度20%,-80℃冻存。通过抑菌圈法并做微调后筛选拮抗菌的活性[15]。具体操作如下:将筛选得到的菌株于液体培养基中培养至对数生长期,取5 μL 菌液滴加至无菌空白药敏纸片中,4℃保存待用,以滴加5 μL 灭菌生理盐水制作的纸片作为空白对照;将VPAHPND复苏调至菌体浓度为5.0×106cfu·mL-1,用无菌脱脂棉蘸取菌液涂布于琼脂培养基平皿表面,待其晾干备用;将制备好的药敏纸片贴在涂有VPAHPND的琼脂培养基表面,每组三个重复,28℃倒置培养24 h 后观测抑菌圈,筛选拮抗菌株。
1.3 拮抗菌的鉴定
1.3.1 细菌形态学特征观察和生理生化鉴定
对筛选后的拮抗菌进行革兰氏染色,显微观察菌体的结构特征。参照《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》对筛选的菌株进行生理生化鉴定。
1.3.2 分子生物学鉴定
采用煮沸法提取菌株基因组DNA,通过PCR扩增其16S rDNA 和gyrB 基因,引物信息见表1,扩增产物经1%浓度琼脂糖电泳检测。挑选具有目标条带同等大小的产物外送测序,获得的序列进行Blast 同源性比对分析,并使用MEGA7.0 构建系统发育树。

表1 实验用引物详细信息Tab.1 Primer details used in the experiment
1.4 拮抗试验及活性物质初步研究
1.4.1 活性物质来源定位
按照表2 进行处理分组[18],每组三个重复,各处理组以28℃、150 r·min-1培养24 h。取不同处理组的液体开展拮抗实验,观察记录不同菌株对VPAHPND的拮抗活性。

表2 不同处理组VPAHPND 拮抗菌活性物质来源定位Tab.2 The sources of active substances of VPAHPND antagonistic bacteria in different treatment groups
1.4.2 活性物质成分分析
按照表3 对H36 的上清液进行分组处理[18],每组三个重复。将筛选获得的拮抗菌用相应的液体培养基在28℃、150 r·min-1下培养24 h 后,取不同处理组的液体测定对VPAHPND的抑菌活性,测试拮抗能力并记录拮抗效果。

表3 不同处理组活性物质成分分析Tab.3 Different treatment groups for active substance composition analysis
1.4.3 活性物质粗提
分别取10 mL 拮抗菌发酵上清液处理组2,加入硫酸铵,使上清液硫酸铵饱和度分别达20%~80%,静置沉降过夜。10 000 r·min-1离心10 min,收集絮状沉淀,100 μL 无菌水溶解沉淀并测定其抑菌活性。选择以上最适硫酸铵饱和度分离活性物质,用无菌水溶解得到抗菌活性物质粗提物。
1.5 数据分析
试验数据采用IBM SPSS 26.0 软件、Excel 软件和Origin 2019 软件统计分析,采用单因素方差分析(ONE-WAY ANVOA)进行统计分析,采用Duncan氏新复极差法进行差异性检验分析。
2 结果与分析
2.1 拮抗菌的抑菌活性测定
本实验从多批样品中分离获得152 株细菌,其中编号为H36 的菌株对VPAHPND菌的抑菌活性较高。H36 对五株不同来源的VPAHPND具有不同效果的拮抗作用(表4)。

表4 菌株H36 对五株VPAHPND 的抑菌效果Tab.4 Antibacterial effect of strain H36 on VPAHPND
2.2 拮抗菌的鉴定
2.2.1 菌株的形态特征观察及生理生化鉴定
H36 菌株在固体LB 培养基上的菌落为圆形淡黄色或乳白色、边缘有褶皱、表面粗糙不光滑且不透明(图1-a);在液体培养基中静止培养时有菌膜形成。H36 为革兰氏阳性、长杆菌(图1-b)。菌株H36 生理生化实验结果见表5,根据《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》,初步鉴定为芽孢杆菌属(Bacillus)。

图1 菌株H36 的形态特征观察(a)及革兰氏染色图(b)Fig.1 Observation of the morphological characteristics(a)and Gram stain of strain H36(b)

表5 生理生化鉴定Tab.5 Biochemical identification of strain H36 in the test
2.2.2 16S rDNA 基因序列分析以及系统发育树构建
将测得的序列提交到NCBI 数据库中,登录号为MW007833。序列经比对产物大小为1 451 bp,发现其与枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)和特基拉芽孢杆菌(Bacillus tequilensis)等同源性为99%,基于16S rDNA 基因构建系统发育树(图2-a)。H36 与枯草芽孢杆菌、地衣芽孢杆菌和特基拉芽孢杆菌等聚为一支。

图2 基于16S rDNA(a)和gyrB(b)的菌株H36 的系统发育树Fig.2 Phylogenetic tree of strain H36 based on 16S rDNA sequence and gyrB sequence
2.2.3 gyrB 基因序列分析以及系统发育树构建
扩增H36 的gyrB 基因,获得了分子量约1 200 bp 的产物,序列经Blast 比对并构建系统发育树(图2-b)。结果显示:拮抗菌H36 与枯草芽孢杆菌(CP002183.1)聚类为一支。结合菌落形态特征、生理生化鉴定、16S rDNA 基因和gyrB 基因扩增分析,H36 菌株鉴定为枯草芽孢杆菌。
2.3 拮抗菌抑菌物质的定位及活性成分的初步判断
2.3.1 拮抗菌H36 抑菌物质的来源定位
拮抗菌H36 菌液拮抗能力如图3-a 所示。处理组2 和处理组3 与阳性对照组具有明显抑菌圈,处理组4 和处理组5 未出现抑菌圈。由此表明,H36 菌株对VPAHPND 具有良好的拮抗效果,其拮抗活性物质主要存在细菌胞外发酵产物中。
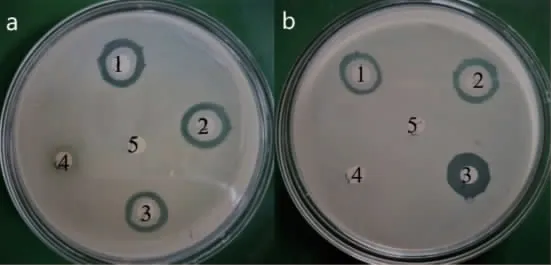
图3 拮抗菌H36 上清液不同处理组对VPAHPND 的抑制作用(序号对应不同处理组)Fig.3 Inhibition of different treatment groups of antagonistic H36 supernatant on VPAHPND(serial number corresponds to different processing groups)
2.3.2 拮抗菌H36 抑菌物质活性成分的初步判断
拮抗菌H36 发酵上清液不同处理组的抑菌结果如图3-b 所示。不同处理组的抑菌活性明显不同,经95℃高温处理后(处理组3)仍具有明显的抑菌活性,处理组4 经蛋白酶K 处理后抑菌活性丢失,表明抑菌活性物质以蛋白类为主。
2.4 拮抗菌H36 产生的活性物质的粗提取
H36 发酵上清液随着硫酸铵饱和度的增大,沉淀的抗菌活性逐渐增强(图4)。在20%饱和盐浓度下抗菌蛋白就开始部分析出,当饱和度为70%时,沉淀的抑菌活性达到最高,表明抗菌活性物质在70%硫酸铵饱和度时几乎达到了最佳沉淀度。

图4 拮抗菌H36 上清液在不同浓度硫酸铵沉淀后沉淀溶解液的抑菌活性Fig.4 Antibacterial activity of antagonistic H36 supernatant after precipitation with different concentrations of ammonium sulfate
3 讨论
本研究中筛选到一株编号为H36 对VPAHPND具有较高抑菌活性的拮抗菌,经形态学及生理生化鉴定初步认定为一类能产芽孢的革兰氏阳性细菌。16S rDNA 基因序列分析表明,H36 与枯草芽孢杆菌、特基拉芽孢杆菌(Bacillus tequilensis)等有较高相似性。在菌种鉴定研究中,16S rDNA 基因序列分析较难区别亲缘关系接近的菌种[19]。Wang 等[20]比较了16S rDNA 基因gyrB 基因序列,发现枯草群各种、亚种的gyrB 基因相似性在75%~95%之间,表现出比16S rDNA 有更好的区分效果。本研究采用编码蛋白gyrB 基因[17,21],鉴定菌株H36 的分类地位,发现其为枯草芽孢杆菌(Bacillus subtilis)。
Balcazar 等[22]从凡纳滨对虾肠道分离到对副溶血性弧菌有抑制作用的枯草芽胞杆菌UTM126。该菌对溶藻弧菌(Vibrio alginolyticus)和哈氏弧菌(V.harveyi)也有明显的拮抗作用。杨胜远等[23]筛选出的一株枯草芽胞杆菌JNT02。该菌株在改良兰迪培养基中24 h 可完全杀灭共培养的副溶血性弧菌,其培养液的抗菌物质对其拮抗作用有累积效应。本研究中,拮抗菌株H36 的发酵菌液离心后的沉淀无明显抑菌活性,而上清液以及滤过液都有抑菌活性,说明其抑菌作用的活性物质为胞外产物。韦露等[24]研究发现,加入等量短小芽胞杆菌(Bacillus pumilus)B1 的细菌胞外产物可显著抑制副溶血性弧菌的生长,这与本实验结论一致。刘雪飞[25]通过分离、筛选和鉴定,获得两株对副溶血性弧菌有拮抗作用的潜在益生菌—短小芽胞杆菌和莫海威芽胞杆菌(Bacillus mojavensis),这两株拮抗菌都能分泌胞外酶,抗菌谱广,抑菌试验效果良好。
枯草芽孢杆菌具有数十种抗菌物质,主要有抗菌肽(bacitracin)[26]、大环脂(cycleopetite)[27,28],不同成分组成的蛋白性的抗菌物质[29]。本研究中,经蛋白酶K 处理后,明显丧失对VPAHPND的抑菌活性,表明H36 的抗菌物质为蛋白类活性物质。在已有的研究中,枯草芽孢杆菌大部分活性物质都耐高温[30]。郝彦利等[31]对枯草芽孢杆菌的粗提液进行5 种蛋白酶处理,发现经木瓜蛋白酶、蛋白酶K 处理后,菌株粗提液的抑菌活性完全消失,初步鉴定此粗提液为蛋白质性质。关于细菌分泌到胞外的抑菌活性成分的分离纯化及性质的研究报道有很多[32,33]。本实验结果发现,在饱和度70%时抑菌效果最高。洒荣波[34]的研究也验证了这一点,用70%饱和度的硫酸铵盐析枯草芽孢杆菌,上清液的抗菌活性极低,说明绝大部分抗菌活性物质已经被沉淀下来,这与本实验结果一致。本研究中H36 初步分析结果与以上研究较为类似,但其活性物质的鉴定还需要进一步分析。
枯草芽孢杆菌是一种应用十分广泛的益生菌,能维持机体肠道微生态平衡,提升机体免疫水平[35]。目前关于拮抗菌的研究主要集中在对病原菌具有显著抑制作用的益生菌筛选研究上,但是,在基于AHPND 原菌拮抗菌的活性物质还没有广泛深入的研究[36]。本实验明确枯草芽孢杆菌H36 对VPAHPND有明显抑菌活性,H36 产生的活性物质耐高温,且包含蛋白质类。该结果丰富了VPAHPND的拮抗菌的研究。发酵也是微生物获得活性物质的重要途径,因此下一步将研究拮抗菌发酵液的发酵条件。该拮抗菌的具体活性物质及其活性物质耐受条件还有待于探索。

