手控注射萃取-光谱多元校正同时测定多组分金属离子
齐国敏
(福州大学化学学院,福建 福州 350108)
0 引言
重金属离子具有较强的生物毒害作用,对生态环境和人类具有严重潜在危害,开展重金属离子检测是水质监测中的重要要求[1]. 目前重金属测定方法主要包括原子吸收[2]、电化学[3]、电感耦合等离子体-质谱[4]、分光光度[5-6]等. 其中分光光度法操作简单快速、仪器设备要求低、重现性好,普遍用于基层实验室的金属离子定量分析; 然而,多种金属离子共存时,不同金属反应物的光谱会发生重叠而难以直接分辨识别[7-8],往往需要引入大型色谱分离或其他仪器进行组分分离,常规分光光度法的直接应用难以同时测定多组分金属离子.
化学计量学技术采用数学方法分辨光谱,无需化学或物理分离可以直接测定混合多组分[9]. 研究人员采用偏最小二乘-紫外可见光度法、或将正交信号校正、小波包变换法和偏最小二乘法相结合,同时测定了Fe (III)等金属多组分, 或基于NMF-PLS实现了对土壤重金属含量反演模型[10-12]. 化学计量学-可见光谱联用技术已广泛应用于多组分同时测定. 但是紫外可见光谱法测定金属离子的灵敏度不高,如何高灵敏地同时检出多组分,有待进一步完善.
本研究提出一种简易的快速萃取和光谱同时识别模式. 将手控注射式固相柱萃取、可见光谱和计量分析相结合,以Pb(II)、Cd(II)和Cu(II) 离子为例,开展巯基葡聚糖凝胶微柱手控注射萃取; 以4-(2-吡啶偶氮)间苯二酚(PAR)为指示剂测量金属的吸收光谱,结合偏最小二乘方法进行多组分计量分析和同时测定. 实验进行柱萃取参数优化,研究不同组分的相关系数、模型主成分数优化和准确性预测,实现水中Pb(II)、Cd(II)和Cu(II)多组分同时测定,并与经典的原子吸收法比较. 本研究有助于为痕量重金属离子的多组分同时测定提供技术支持.
1 实验部分
1.1 仪器和试剂
紫外-可见分光光度计(UV-2450型,日本岛津公司); 精密酸度计(PHS-3C型,上海大普仪器有限公司); 原子吸收分光光度计(TAS-986型,北京普析通用有限公司); 注射式萃取柱为实验室自制.
硝酸铅(分析纯(AR))购自上海化学试剂公司; 硫酸铜(AR)、氯化镉(AR)购自上海勤工化工厂; 甲醛溶液(质量分数37%)、冰醋酸(AR)、4-(2-吡啶偶氮)间苯二酚(质量分数90%)购自天津市福晨化学试剂厂; 葡聚糖凝胶Sephadex G-15(AR)购自上海泽叶生物科技有限公司); 实验用水为二次蒸馏水.
1.2 吸附剂合成及手控萃取装置制备
参照文献[13]合成巯基葡聚糖凝胶(SDG): 在圆底烧瓶中分别加入10 mL硫代乙醇酸和四氢呋喃,调节为弱酸性; 加入10.0 g 葡聚糖凝胶Sephadex G-15,40 ℃下反应48 h,产物用二次蒸馏水多次洗涤、无水乙醇抽滤; 所得产物35 ℃干燥备用.
注射式萃取装置由3个部分组成: 一次性注射器、接口和萃取柱. 将上述合成的巯基葡聚糖凝胶(SDG)装入4 mm×75 mm 长度聚乙烯微柱,通过接口与注射器连接,两端各装上中央多孔筛板的垫片,以15 mL·min-1速度进行样品的萃取富集.
1.3 光谱相关系数R和预报残差平方和(PRESS)计算
根据文献[14],不同组分光谱相关系数R和预报残差平方和(predicted residual sum of squares, PRESS)计算公式如下:
C(i,j)=E{[X(i, :)-E(X(i, :))]×[X(j, :)-E(X(j, :))]}
其中:C是一个[i,j]的协方差矩阵,i,j都是列向量;E是期望值;X(i,:),X(j,:)为i,j组分的光谱值.
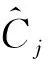
1.4 样品分析
待测样品采用手控注射萃取方法进行富集. 调整待测液的pH值,采用一次性注射器吸取待测液,15 mL·min-1流速进行注射,重复上述操作进行富集(视样品溶液体积而定). 采用少量二次水洗涤没有被吸附的金属离子,以相同流速用5 mL 2.0 mol·L-1硝酸溶液洗脱,适当浓度的NaOH溶液调节pH值并定容至6 mL. 将标准金属离子溶液、PAR指示剂和硼酸缓冲溶液混合显色,在460~700 nm区间进行谱图扫描,将数据导入所建的数学模型中, 采用Matlab分析软件(R2008a型,美国MathWorks公司)计算分析,实现混合物中各组分特征谱学分辨和含量同时测定.
2 实验结果与分析
2.1 手控注射萃取参数
在金属离子(Pb(II)、Cd(II) 和Cu(II)) 质量浓度均为0.40 μg·mL-1,洗脱溶液为 5.0 mL 2.0 mol·L-1硝酸溶液的条件下,采用装有SDG吸附剂的萃取柱对Pb、Cd和Cu进行手控注射萃取,如图1(a)所示,在溶液pH>3.50时,Pb(II)、Cd(II)和Cu(II)离子有效吸附在SDG上(三者回收率均可以达到90%以上); 考察Pb(II)、Cd(II)和Cu(II)在固相萃取柱的洗脱条件,如图1(b)所示,保持Pb(II)、Cd(II)和Cu(II)质量浓度为0.40 μg·mL-1,进样溶液体积200~800 mL时,Pb(II)、Cd(II)和Cu(II)均能得到有效的吸附,当进样体积大于800 mL时,Cd离子回收率发生下降,主要是由于Cd离子水溶性较大,较低浓度样品大体积富集处理时可能发生Cd离子流失,导致萃取效率降低; 图1(c)、(d)表明,随着硝酸溶液浓度的增大,H+与SDG柱上金属离子的离子交换作用增强,洗脱作用增强,当采用5.0 mL 2.0 mol·L-1硝酸溶液,Pb(II)、Cd(II)和Cu(II)离子可以被有效地洗脱,三者回收率分别为97.5%、95.0%和96.1%. 通过以上参数优化,手控注射SDG柱可以实现Pb(II)、Cd(II)和Cu(II)的快速萃取和富集.
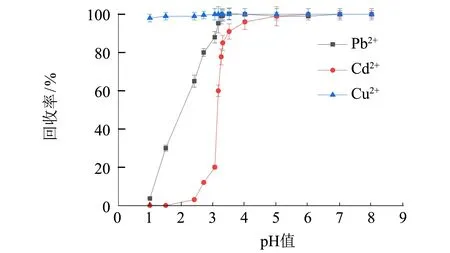
(a) 样品溶液pH值的影响

(b) 样品溶液体积的影响

(c) HNO3浓度的影响

(d) HNO3体积的影响
2.2 光谱多元校正分析2.2.1 可见光谱加和性
多金属离子体系与PAR反应后的吸收光谱是由多个单一金属离子-PAR络合物的吸收光谱叠加而成,混合光谱代数和理论上A′ =A1+A2+…+An. 如图2(a)所示,Cd(II)、Cu(II)和Pb(II)离子与PAR显色反应,生成物的可见光吸收特征峰分别为490、508和527 nm(曲线1~3),三组分光谱的加和值A′与混合光谱(曲线4)吸光度A的差值在450~565 nm区间随着吸收光谱波长的增大而降低(见图2(b)),并在565 nm波长处两者数值最为接近; 在560~680 nm以后两者偏差急剧增大. 当(A-A′)/A<±10%,混合光谱测定值和代数和差值在10%范围内,混合光谱在波长480~600 nm之间的吸光度与代数加和值一致性良好.

(a) 金属离子吸收光谱

(b) 不同波长区间吸光度加和性变化曲线
2.2.2组分相关性分析
为减小混合体系中不同组分间的干扰,考察溶液pH值为3.5~9.0时不同组分在480~600 nm波段的吸收光谱,进行相关系数测算和相似度评价. 如图3所示,在pH=8.0条件下,混合体系中任意两组分之间的相关系数R(A, B)、R(A, C)和R(B, C)达到理想值,该条件下Cd(II)、Cu(II)和Pb(II)三者之间任意两组分间的相关系数小,光谱吸收峰差异性大、特征性明显,有利于预测模型的建立和准确识别.
2.2.3PLS模型建立及主成分数优化
基于偏最小二乘法PLS,采用正交表L25(53) 建立Pb(II)、Cd(II)和Cu(II)离子三组分分析模型,Pb(II)、Cd(II) 和Cu(II)3个组分分别在0.5~2.0、0.1~1.0和0.1~0.8 μg·mL-1区间选取5个质量浓度水平,在480~600 nm波长段对25组混合样进行光谱扫描和数据采集,进行PLS计算. 采用预报残差平方和PRESS对主成分数进行优化,如图4所示. 当主成分数为3时,Pb(II)、Cd(II) 和Cu(II)组分的PRESS趋于平稳,多金属混合物PLS分析模型的主成分数选择为3.

图3 不同pH条件下的各组分之间的相关性系数Fig.3 Correlation coefficients between two components under different pH conditions

图4 预报残差平方和PRESS随主成分数的变化曲线Fig.4 Variation curve for PRESS with principal component numbers
2.2.4模型预测性能和稳定性
应用所建立的PLS模型对Pb(II)、Cd(II) 和Cu(II)混合样品进行运算,实际测算值与预测值之间的相对误差RE,结果列于表1. Pb(II)、Cd(II)和Cu(II)的浓度预测误差范围分别为: -3.1%~7.1%、-7.8%~3.6%、-2.4%~11.2%,PLS模型预测性能良好.
为检验Pb(II)、Cd(II)和Cu(II)的PLS模型稳定性,实验对预测数据进行连续100次的模拟计算运算,所建立的模型对Pb、Cd和Cu三组分预测稳定性良好,Pb(II)、Cd(II)和Cu(II)的质量浓度预测误差范围在-4.2%~3.1%、-7.7%~5.1%和-5.1%~14.3%.

表1 模型预测性能的一次运算分析
2.2.4离子干扰分析

2.3 分析应用
在最优条件下,通过手控注射柱萃取、酸溶液进行洗脱和PLS分析测定,Pb、Cd、Cu的线性质量浓度范围分别为0.50~20.00、0.10~5.00和0.10~3.00 μg·mL-1,线性系数R2分别为0.999 2、0.999 2及0.997 5,Pb、Cd和Cu的理论最低检测限LOD (3倍的空白溶液测试标准偏差除以校正曲线斜率, 即3σ/k,再除以溶液的富集因子133) 分别达到0.6、0.2、0.2 ng·mL-1.
实验开展样品分析,通过在空白溶液中加入Pb、Cd和Cu金属离子制备模拟样品,Pb、Cd和Cu的质量浓度25~55、15~25和30~40 ng·mL-1,经手控注射萃取富集后,分别采用PLS与经典的火焰原子吸收FAAS方法进行分析,结果列于表2. 与FAAS技术比较,Pb、Cd和Cu的PLS测定结果相对误差(RE)在-8.2%~1.8%,-2.0%~-12.9%和-1.5%~8.4%. 为进一步验证该模型的适用性,采用PLS测定方法对两种排水口水样进行检测分析,结果列于表3. 富集后水样中Pb、Cd和Cu组分均能得到良好的检测,检测回收率为82.5%~112.5%,结果良好.

表2 模拟水样中Pb、Cd和Cu组分的PLS与FAAS方法分析对比

表3 水样中Pb、Cd和Cu的测定分析
3 结语
针对水中痕量重金属多组分快速同时测定的需求,本研究基于简易的手控注射萃取和偏最小二乘方法PLS光谱分辨技术,建立快速萃取-可见光谱多元校正分析,实现痕量Pb(II)、Cd(II)和Cu(II)离子的同时测定. 在最佳条件下,Pb(II)、Cd(II)和Cu(II)离子可以实现同时测定,理论最低检出限分别可达0.6、0.2和0.2 ng·mL-1; 水样中痕量Pb、Cd和Cu富集后可以采用所建立的PLS模型有效识别,与FAAS法比较,测定结果偏差在-8.2%~1.8%,-2.0%~-12.9%和-1.5%~8.4%,水样富集后Pb、Cd和Cu组分检测回收率为82.5%~112.5%,结果良好.

