miR-106a靶向调控TIMP2对人胃癌细胞增殖、转移及EMT的影响
张宁 蔺刘亚 李思繁 朱萌
胃癌是消化系统最常见的恶性肿瘤之一。宁夏地处我国西北部,是胃癌高发区,该地区胃癌诊疗现状具有就诊率低、分期晚、转移率高和预后差等特点[1-2],深入研究胃癌发病机制和基因表达异常对提升该地区胃癌的临床治疗效果具有重要意义。近年来,微小RNA(miRNA)分子的研究显示其可能参与包括胃癌在内的多种恶性肿瘤的发病过程,可以作为肿瘤早期发现的生物标志物或药物治疗的分子靶点[3-4]。本文通过实验研究检测miR-106a分子在胃癌组织和细胞中的表达,在细胞水平考察异常表达的miR-106a是否与肿瘤细胞的异型增殖和侵袭转移相关,并进一步探讨miR-106a参与胃癌转移的机制,旨在从体外细胞水平阐明miR-106a在人胃癌中的表达和意义。
1 材料与方法
1.1 标本收集
本研究所用胃癌及癌旁配对福尔马林固定-石蜡包埋(Formalin-fixed and paraffin-embedded,FFPE)样本收集自宁夏医科大学总医院病理科2020年6月—2021年6月存档标本,共50例,男性34例,女性16例,平均年龄59.45±9.58岁。所有癌组织均经病理学确诊为胃腺癌,癌旁组织距癌灶中心≥5 cm,组织学未见癌细胞浸润。本研究经宁夏医科大学伦理委员会批准(批号:2021-N0049)。
1.2 细胞培养
人低分化胃腺癌细胞系SGC-7901、BGC-823、MKN-45,永生化人胃黏膜上皮细胞GES-1购自中国科学院上海细胞库。以上细胞在含10%胎牛血清(杭州四季青公司)的RPMI-1640培养基(Gibco公司)中于37℃、5% CO2恒温培养箱中常规培养,细胞在对数生长期进行实验。
1.3 核酸抽提
组织标本采用Total Nucleic Acid Isolation Kit(Ambion公司)提取RNA。主要步骤为:10 μm切片脱蜡,蛋白酶K消化4 h,核酸沉淀后离心吸附,DnaseI 37℃ 30 min灭活DNA酶,洗涤离心后纯化核酸,分装15 μL检测核酸纯度,剩余样本于-80℃冰箱保存备用。细胞标本采用Roche High Pure miRNA Isolation Kit(Roche公司)提取RNA。主要步骤为:150 μL细胞裂解液中加入Binding Buffer和Binding Enhancer,混匀离心,经多次洗涤后,加入洗提液孵育1 min,离心纯化得到总RNA,分装备用。
1.4 Real-time PCR检测miR-106a表达
采用Small RNA Assays,Universal Master Mix II进行PCR检测。主要步骤为:组织标本取10 ng RNA,细胞标本取1 μg RNA用于反转录。使用茎环状RT引物合成cDNA,反转录体系:100 mM dNTP 0.33 μL,MultiScribeTM逆转录酶2.2 μL,10×逆转录缓冲液3.3 μL,RNase抑制剂0.42 μL,无酶水9.15 μL,RNA样本11 μL;反转录条件:16℃ 30 min、42℃ 30 min、85℃ 5 min、4℃终止。扩增体系:Small RNA Assay 3.6 μL,RT产物4.8 μL,Universal PCR Master Mix II 36.0 μL,无酶水27.61 μL,共72.01 μL;扩增条件:95℃ 10 min、95℃ 15 s、60℃ 60 s,共40个循环。U6 snRNA为内参基因。每组样本重复三次。miR-106a相对表达量采用2-△△Ct表示,△Ct=Ct目的基因-Ct内参基因。
1.5 MTT检测胃癌细胞增殖
胃癌细胞SGC-7901、BGC-823置于96孔培养板,细胞密度6 000个/孔,常规培养24 h后分组处理:阴性对照组、miR-106a inhibitor处理组,于处理后24h、48 h、72 h、96 h加入10% 5 mg/mL MTT液200 μL,避光孵育4 h,弃上清,加入DMSO,摇床震荡,置于酶标仪(PerkinElmer公司)于490 nm 处测定吸光度值。
1.6 Transwell检测胃癌细胞迁移、侵袭
胃癌细胞BGC-823置于6孔板,细胞密度2×105个/孔,常规培养24 h后分组处理:阴性对照组、miR-106a inhibitor处理组,于处理后24 h收集细胞接种于插入24孔培养板中的Transwell小室,迁移实验直接接种细胞,侵袭实验在小室中铺Matrigel基质胶(BD bioscience公司),Transwell小室下室加入完全培养基,常规培养48 h后取出小室,4%多聚甲醛固定20 min,0.1%结晶紫染色10 min,置于倒置光学显微镜下观察,计数互不重叠的5个高倍视野下穿膜细胞平均数。
1.7 双荧光素酶报告基因实验
生物信息学分析miR-106a靶基因TIMP2,构建包含miR-106a结合位点的TIMP2 3′-UTR野生型和突变型报告基因,由广州锐博生物技术有限公司设计合成。HEK-293T细胞常规培养于96孔板,100 ng pmiR-RB-ReportTMTIMP2野生型(WT)或突变型(Mut)报告基因与50 nM miR-106a mimic或阴性对照共转染,48 h后使用Dual-Glo Luciferase Assay System检测荧光素酶活性,以萤火虫荧光素酶为报告基因,以海肾荧光素酶为内参基因。
1.8 Western blot检测靶蛋白TIMP2、MMP2、MMP9、E-cadherin、N-cadherin表达
BGC-823细胞接种于6孔培养板,细胞密度5×105/mL,实验分组:阴性对照组、miR-106a inhibitor处理组,培养48 h后抽提总蛋白,BCA蛋白定量后取20 μg置入SDS-PAGE凝胶电泳,100 V恒压,待样品进入分离胶之后,升高电压至120 V,随后300 mA恒流转膜,抗体稀释比例TIMP2(1∶2 000),MMP2(1∶2 000),MMP9(1∶2 000),E-cadherin(1∶2 000),N-cadherin(1∶1 000),GAPDH(1∶10 000),将PVDF膜放入辣根过氧化物酶标记的山羊抗兔二抗(1∶20 000)孵育后,进行化学发光、显影和定影。
1.9 统计学分析
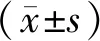
2 结果
2.1 miR-106a在人胃癌组织中的表达
Real-time PCR法检测50例人胃癌和癌旁配对组织样本,结果显示miR-106a在胃癌组织中的相对表达量高于癌旁组织(2.82±1.90vs.1.03±1.17,t=-7.821,P<0.001)(图1)。
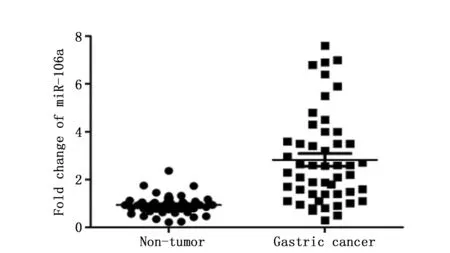
图1 Real-time PCR法检测miR-106a在人胃癌组织中的表达Figure 1 The expression of miR-106a was detected in gastric cancer tissues by Real-time PCR
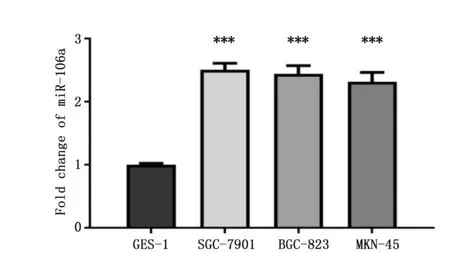
图2 Real-time PCR法检测miR-106a在人胃癌细胞中的表达Figure 2 The expression of miR-106a was detected in gastric cancer cells by Real-time PCRNote:***P<0.001,when compared with the GES-1 cells.
2.2 miR-106a在人胃癌细胞中的表达
Real-time PCR法检测结果显示miR-106a相对表达量在GES-1细胞和3株人胃癌细胞SGC-7901(2.51±0.64)、BGC-823(2.44±0.78)和MKN-45(2.32±0.13)中存在统计学差异(F=223.844,P<0.001),两两比较显示,相对于GES-1,miR-106a在人胃癌细胞中的表达升高(P<0.001)(图2)。
2.3 miR-106a对人胃癌细胞增殖的影响
MTT检测结果显示抑制miR-106a后各时间点人胃癌细胞SGC-7901和BGC-823增殖均减慢(P<0.001),说明抑制miR-106a的表达可以抑制胃癌细胞增殖(图3)。
2.4 miR-106a对人胃癌细胞迁移、侵袭的影响
Transwell检测人胃癌细胞BGC-823,结果显示抑制miR-106a后,与NC组相比,anti-miR-106a组迁移细胞数显著下降(94.23±18.36vs.18.70±17.23,t=99.445,P<0.001),侵袭细胞数也显著下降(83.00±43.55vs.16.15±8.53,t=18.122,P<0.001)。说明抑制miR-106a的表达后胃癌细胞迁移和侵袭数量减少,miR-106a的异常表达对胃癌细胞的迁移和侵袭能力有影响(图4)。
2.5 miR-106a靶基因TIMP2的鉴定与分析
双荧光素酶报告基因检测结果显示,TIMP2野生型和突变型报告基因与miR-106a mimic共转染后,组间比较差异有统计学意义(F=33.995,P<0.001)。两两比较显示,当TIMP2野生型报告基因与miR-106a mimic共转后,WT/miR-106a荧光素酶报告基因较活性WT/NC明显下降(P<0.001),但TIMP2突变型报告基因Mut/miR-106a与Mut/NC相比无统计学差异(P>0.05),提示miR-106a直接调控靶基因TIMP2表达(图5)。
2.6 miR-106a对靶蛋白TIMP2、MMP2、MMP9、E-cadherin、N-cadherin表达的影响
观察到miR-106a靶基因TIMP2,结合miR-106a对胃癌细胞侵袭转移能力的影响,有必要进一步观察肿瘤转移相关因子。Western blot检测结果显示,当抑制miR-106a后,TIMP2表达升高,MMP2、MMP9表达下降;与此同时,E-cadherin表达升高,N-cadherin表达下降,提示miR-106a的异常表达可能参与调节上皮-间质转化(Epithelial-mesenchymal transition,EMT)(图6)。

图3 MTT法检测胃癌细胞增殖Figure 3 MTT method for the detection of gastric cancer cell proliferationNote:***P<0.001,**P<0.01,compared with control group at the same time.
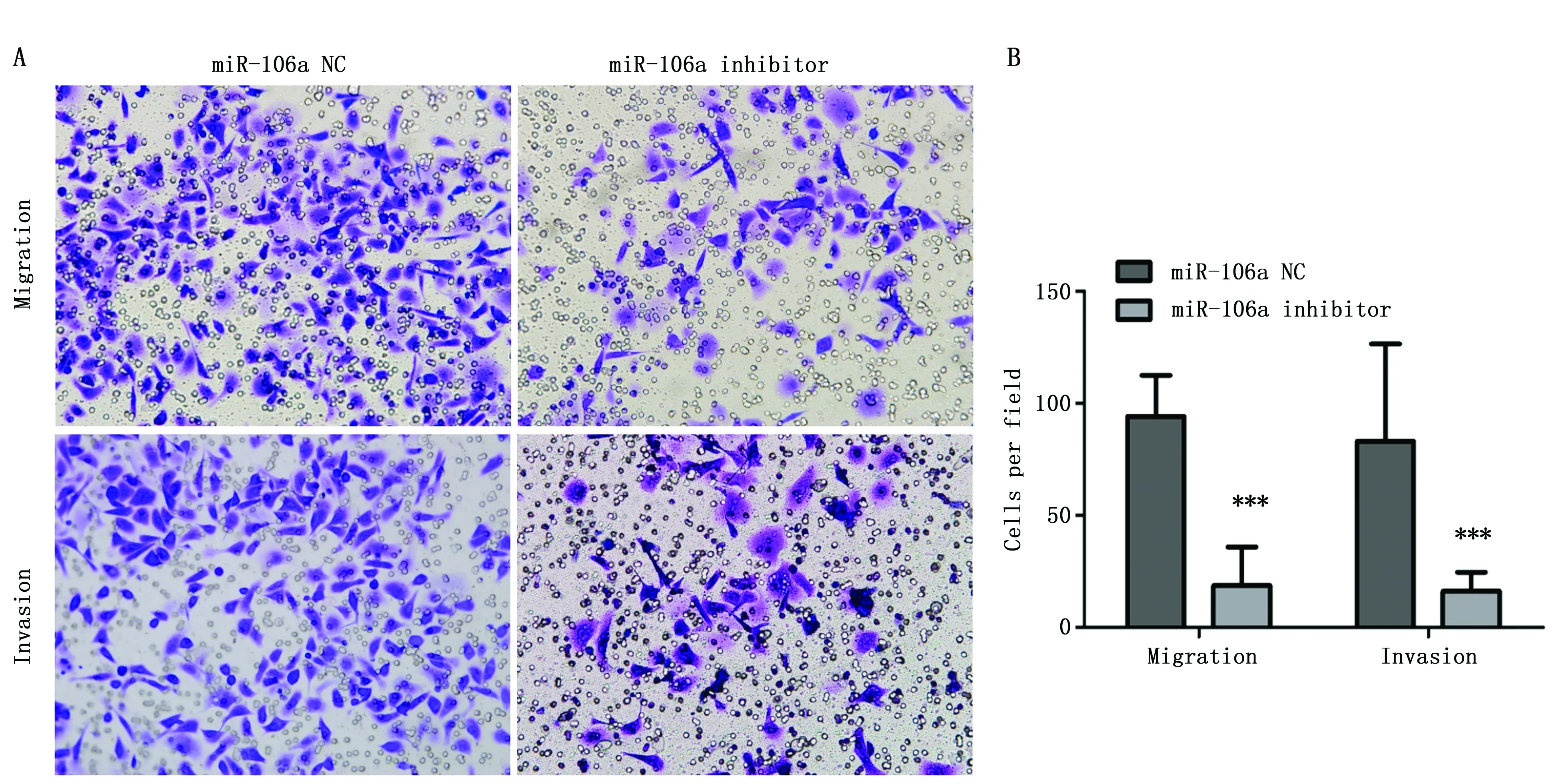
图4 Transwell法检测胃癌细胞迁移和侵袭Figure 4 The migration and invasion of miR-106a inhibitor were detected in BGC-823 cells by Transwell assayNote:A.Transwell assay results(×200);B.Trans-membrane cells were counted,***P<0.001.
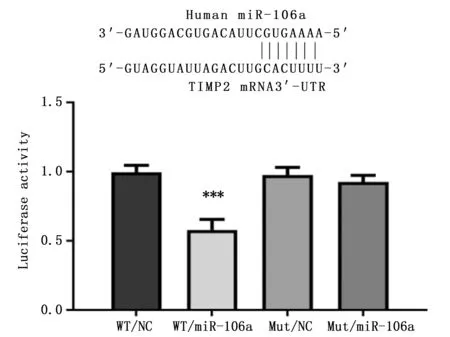
图5 双荧光素酶报告基因检测miR-106a与TIMP2 3′-UTR的直接结合Figure 5 The direct binding of miR-106a and TIMP2 3′-UTR was detected by dual luciferase reporter gene assayNote:***P<0.001,when compared with the WT/NC group.
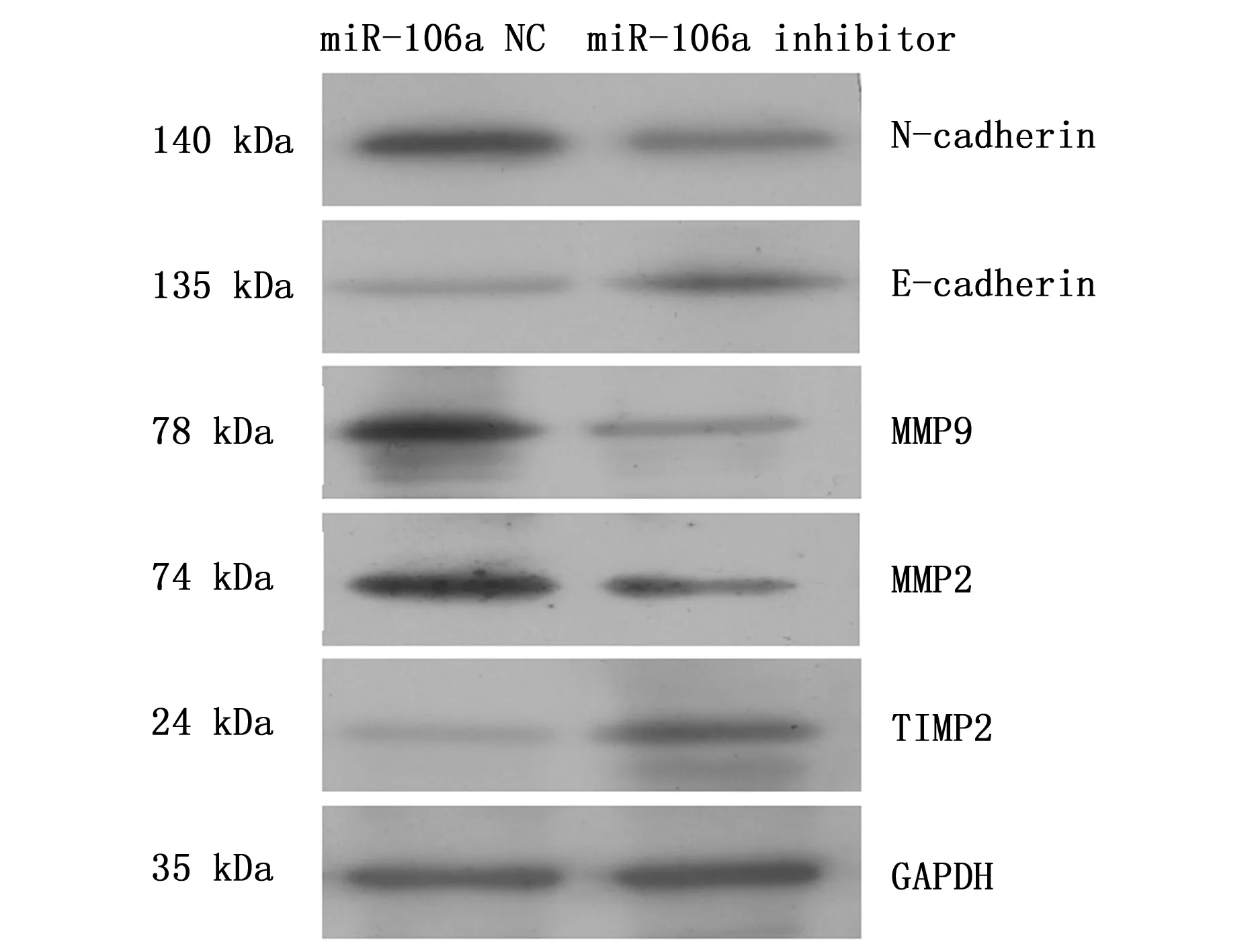
图6 Western blotting检测miR-106a靶蛋白表达Figure 6 miR-106a target proteins were detected by Western blot
3 结论
miRNA编码基因以单拷贝、多拷贝或基因簇等多种形式存在于基因组DNA上,定位于基因间隔区,生物发生过程不同于其他基因,转录后并不翻译生成蛋白质。其生物学功能在于miRNA以完全或不完全互补的方式结合到靶mRNA的3′-非翻译区(3′-UTR),发挥RNAi的作用降解信使(mRNA)或抑制mRNA的翻译,导致靶基因表达下降,在转录后水平对细胞生物学功能进行负性调控[5-6]。本研究考察miR-106a分子,组织学采用FFPE样本,该样本具有确定的病理组织学诊断,能够为分子检测用于回顾性研究在基因表达领域提供很好的平台。检测结果显示miR-106a在胃癌组织中高表达,说明至少对胃癌组织而言,miR-106a的表达出现异常,而高表达的miR-106a很有可能参与到胃癌的发病机制中。细胞学检测发现miR-106a在胃癌细胞中同样出现高表达。因本研究所选择的胃癌细胞株均为低分化,说明至少人低分化胃癌细胞具有高水平表达的miR-106a分子。因此,miR-106a在胃癌中的异常表达就有可能会影响胃癌细胞的生物学行为。
细胞异型增殖是肿瘤细胞的标志。肿瘤细胞的快速增殖和异常的血管构成是导致肿瘤明显异质性的重要原因,也是构成肿瘤微环境的重要成分。即便是在缺氧微环境中,休眠的肿瘤细胞也可以在条件改善时恢复或保持旺盛的增殖能力[7]。研究显示,miR-106a可能通过增强PI3K/AKT通路活性而在肿瘤的发生中发挥促进作用[8]。PI3K/AKT通路活性的上调已在多种癌症中得到证实与导致细胞凋亡障碍和细胞增殖增强有关[9]。本研究考察细胞增殖,发现抑制miR-106a后,胃癌细胞的增殖能力在各个时间节点均有所下降,结合上述报道,本研究同样说明胃癌中异常表达的miR-106a与癌细胞增殖具有相关性。
随后考察胃癌细胞转移能力,发现抑制miR-106a促进胃癌细胞迁移和侵袭。为进一步分析其可能的作用机制,我们筛选并分析与肿瘤转移相关的基质金属蛋白酶抑制物TIMP2,经双荧光素酶报告基因证实二者的直接结合关系。因此可以考虑miR-106a对胃癌细胞生物学行为的影响可能是通过直接靶位点TIMP2而起作用。癌细胞转移是一种阶段性过程,其中基底膜的降解是癌细胞能够脱离原发癌灶形成游离癌细胞的起始阶段。在此阶段中,EMT转化是肿瘤细胞获得转移动力的必需[10-12]。而MMP/TIMP是维持ECM完整性并调节ECM重塑的关键[13-14]。为明确miR-106a异常表达对ECM的作用,经蛋白检测发现除TIMP2在miR-106a抑制后表达增高外,MMP2、MMP9的表达均下降;同时伴随着上皮性标记物E-cadherin表达升高,间质性标记物N-cadherin表达降低,说明miR-106a的异常表达可以导致胃癌细胞获得间质样表型,有EMT转化的趋势;MMP2/9与TIMP2比例失调,基底膜有可能在miR-106a的作用下得以降解;这两方面的作用共同促进胃癌细胞侵袭转移。结合miRNA的作用机制,miRNA不直接翻译生成蛋白,但却可以通过调控靶基因mRNA的表达而发挥抑制作用。
综上所述,本研究结果初步揭示miR-106a可能具有癌基因样的作用,通过靶向TIMP2而促进并维持胃癌细胞的恶性行为。

