高剂量少分次放疗联合白蛋白结合型紫杉醇、替吉奥方案化疗在局部晚期胰腺癌患者中的临床疗效以及安全性评价
胡宗涛 刘演 高世乐 甘晨 张永康
胰腺癌是消化系统常见恶性肿瘤,发病率和死亡率逐年上升,全球范围均位居恶性肿瘤第4位[1],5年生存率约10%[2]。手术切除仍然是改善胰腺癌生存期的主要治疗手段[3],但80%~85%患者确诊时已为中晚期,失去手术根治机会[4]。晚期胰腺癌治疗以全身化疗为基石,吉西他滨是一线标准化疗方案[5],可提高晚期患者中位总生存期(Overall survival,OS)约6个月[6],但高耐药率导致预后仍然很差。白蛋白结合型紫杉醇以其独特的优势,在晚期胰腺癌取得了突破性进展,2013年9月6日,美国食品和药物管理局(Food and Drug Administration,FDA)批准白蛋白结合型紫杉醇用于晚期胰腺癌一线治疗[7]。局部精准放疗联合化疗较单纯放疗或单纯化疗具有潜在的生存获益,且放疗后化疗、放疗前后化疗均较放疗前化疗延长无进展生存期(Progression-free survival,PFS)[8]。随着放疗技术的提高,在保证危及器官安全前提下提高总剂量及单次治疗剂量,即高剂量少分次放疗可明显提高生物有效剂量,增加局部控制率,延长生存期,提高生活质量[9]。那么高剂量少分次放疗联合白蛋白结合型紫杉醇、替吉奥方案化疗对局部晚期胰腺癌患者疗效如何,目前尚无文献报道,本研究报道该治疗方案的临床疗效及治疗相关不良反应,旨在为临床诊疗提供新的思路。
1 资料与方法
1.1 一般资料
选择2018年9月—2020年11月在中国科学院合肥肿瘤医院经病理确诊的局部晚期胰腺癌患者72例,给予前瞻性研究,按照随机数字表法,分为对照组36例,实验组36例。纳入标准:(1)均为首次确诊;(2)发病年龄18~75岁;(3)病理活检证实为胰腺导管腺癌;(4)病史资料完整;(5)全身至少有一处可测量病灶;(6)预估生存期>3个月;(7)经多学科团队评估,无外科手术指征;(8)KPS评分>60分。排除标准:(1)其他部位远处转移者;(2)妊娠期和哺乳期女性;(3)精神异常不能合作者;(4)胰腺神经内分泌型或其他类型胰腺肿瘤;(5)合并其他二发肿瘤患者;(6)化疗禁忌症或药物过敏史者;(7)严重内科疾病患者;(8)腹水或晚期恶液质患者。本研究经医学伦理委员会批准(批号:PJ-KY2018-015),患者充分知晓并签署治疗知情同意书。
1.2 研究方法
对照组患者给予白蛋白结合型紫杉醇、替吉奥方案化疗,注射用紫杉醇(白蛋白结合型)(100 mg/支,国药准字H20183044,石药集团欧意药业有限公司)130 mg/m2,d1、d8;替吉奥胶囊(20 mg/粒和25 mg/粒,国药准字H20080802、H20080803,山东新时代药业有限公司)40~60 mg/次(根据体表面积),2次/d,d1~14,每3周为1个周期,共6个周期。实验组患者在对照组基础上,首次化疗第1 d给予胰腺癌病灶高能直线加速器(Sweden Elekta Co.Ltd.型号:ELEKTA AXESSE)高剂量少分次放疗,胰腺癌肿瘤靶区(Gross tumor volume,GTV)为腹部增强CT或MRI可见肿瘤病灶,临床靶区(Clincal target volume,CTV)为GTV外放5 mm,包括高危淋巴结引流区,计划靶区(Planning target volume,PTV)在CTV上下外放0.5 cm,前后左右外放0.5 cm,处方剂量GTV 65~70 Gy,CTV 55~60 Gy,PTV 45~50 Gy,1次/d,5次/周,共15~20次。并勾画胃、十二指肠、脊髓为危及器官,胃Dmax≤60 Gy,十二指肠Dmax≤55 Gy,脊髓Dmax≤45 Gy[10]。 对照组患者出现肝转移死亡1例,腹腔大量积液1例;实验组患者出现恶性肠梗阻1例,脑血管意外转科治疗1例,恶性梗阻性黄疸1例,均退出研究,最终对照组入组34例,实验组入组33例。
1.3 观察指标
1.3.1 疗效评价 每化疗2个周期后的第3周末,复查全腹部增强CT或MRI,按照Recist 1.1版标准[11]评价分为完全缓解(Complete response,CR)、部分缓解(Partial response,PR)、稳定(Stabilization,SD)和进展(Progressive disease,PD),并计算客观有效率(Objective response,ORR)和疾病控制率(Disease control rate,DCR)。ORR=(CR+PR)/总例数,DCR=(CR+PR+SD)/总例数。
1.3.2 实验室检查 按照试剂盒说明书,酶联免疫法检测血清肿瘤标志物CEA、CA19-9和CA724值;取外周血7.5 mL,循环肿瘤细胞检测仪[世联博研(北京)科技有限公司,型号:Cell Tracks®AutoPrep]进行细胞正性富集和免疫磁珠法分离,循环肿瘤细胞(Circulating tumor cell,CTC)检测结果经CellTracks Analyser Ⅱ系统分析[12]。
1.3.3 评价药物不良反应 按照不良事件通用术语标准(CTCAE)4.0版[13]评价治疗相关不良反应,分为1~5级,1级:轻度,无症状或轻微症状,无需治疗;2级:中度,需要较小、局部或者非侵入性治疗;3级:重度,但不会立即危及生命;4级:危及生命;5级:死亡。
1.4 随访
所有患者治疗后1个月由专人通过手机、微信随访,每月随访1次,随访截止时间为2021年5月31日,随访3.5~22.6个月,中位随访时间11.7个月。随访完成67例,失访0例。OS定义为临床研究随机化分组开始至任何原因引起死亡的时间,若截至随访结束研究对象仍存活,则统计为研究开始至随访结束时间;PFS定义为临床研究随机化分组开始至肿瘤发生进展或任何原因引起死亡的时间,若截至随访结束研究对象未发生进展,则统计为研究开始至随访结束时间。
1.5 统计学处
2 结果
2.1 入组临床资料
对照组与实验组间性别比、年龄、原发肿瘤位置、临床分期、血清CEA、CA19-9、CA724和CTC比较,差异无统计学意义(P>0.05)(表1)。
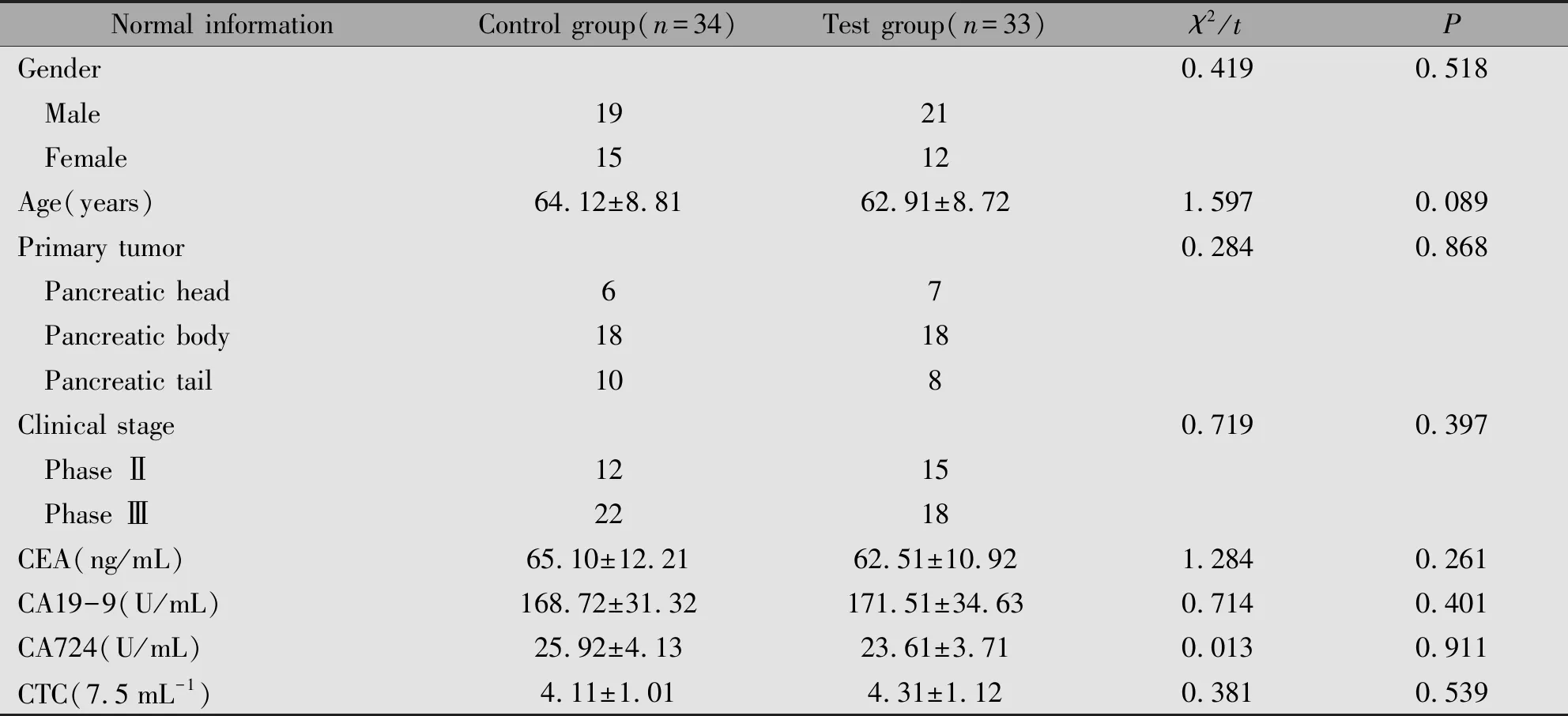
表1 两组患者入组资料比较
2.2 生存分析
随访结束后,实验组生存7人,死亡26人,无进展4人,进展29人;对照组生存5人,死亡29人,无进展3人,进展31人。实验组患者中位OS和中位PFS分别为 12.4个月(95%CI:10.5~14.3)和6.3个月(95%CI:5.2~7.4),长于对照组的中位OS 8.5个月(95%CI:6.7~10.3)(χ2=4.190,P=0.041)和中位PFS 4.2个月(95%CI:2.3~6.1)(χ2=4.052,P=0.044)(图1,图2)。
2.3 临床疗效评价
实验组患者ORR虽高于对照组,但差异不具有统计学意义(P>0.05);实验组患者DCR显著高于对照组,差异具有统计学意义(P<0.05)(表2)。
2.4 血清肿瘤标志物变化
两组患者治疗前血清CEA、CA19-9、CA724和CTC无统计学差异(P>0.05),治疗后实验组患者表达水平显著低于对照组,差异具有统计学意义(P<0.05),治疗后血清CEA、CA19-9、CA724和CTC均较治疗前不同程度下降(P<0.05)(表3,表4)。
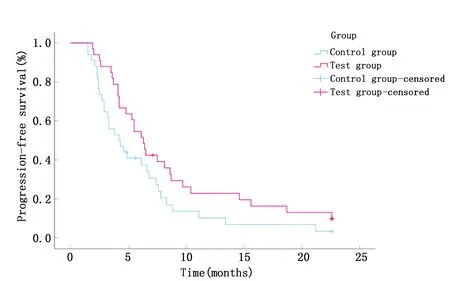
图1 两组患者无进展生存曲线Figure 1 Progression-free survival curves of patients in the two groups
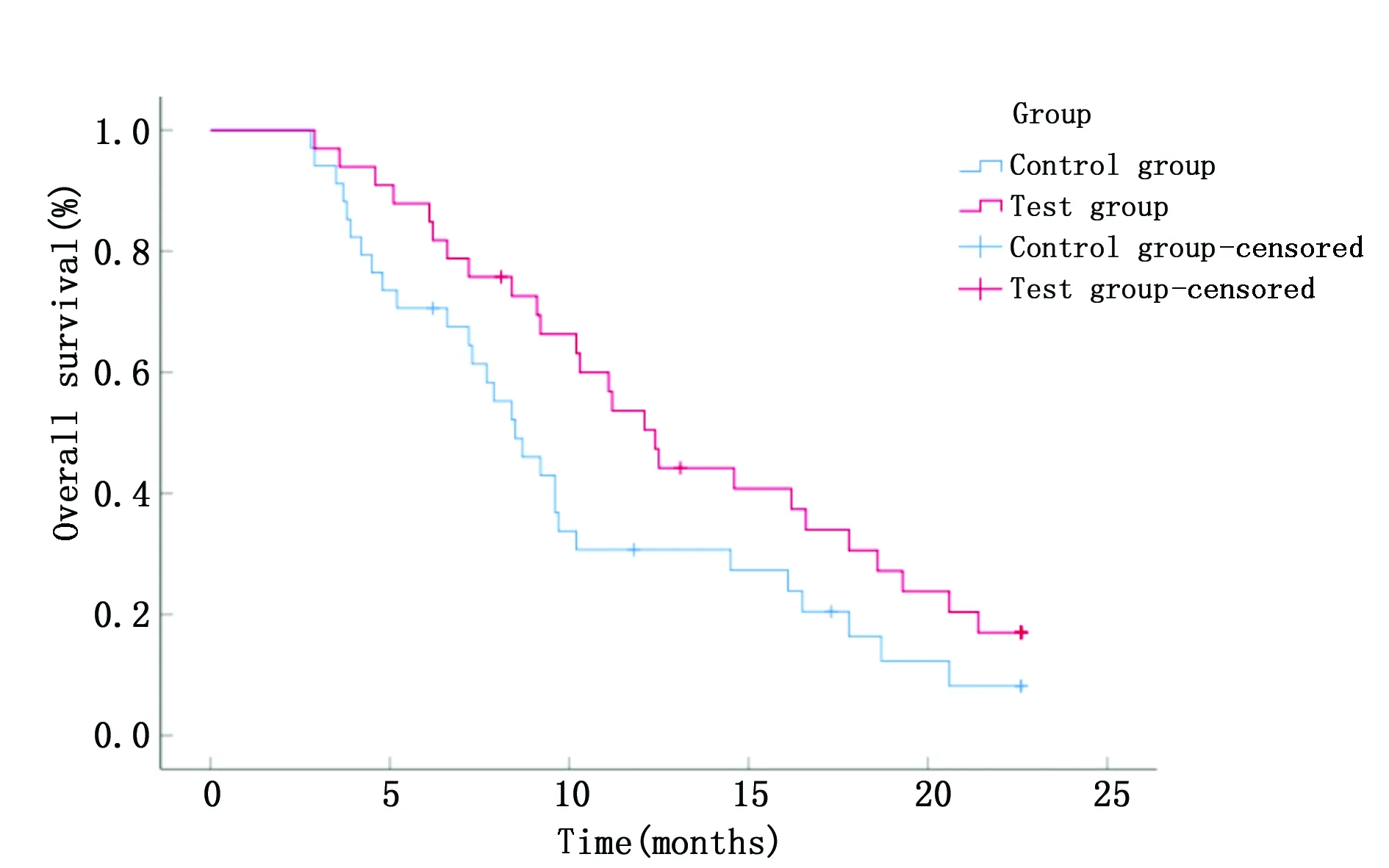
图2 两组患者总生存曲线Figure 2 Overall survival curves of patients in the two groups
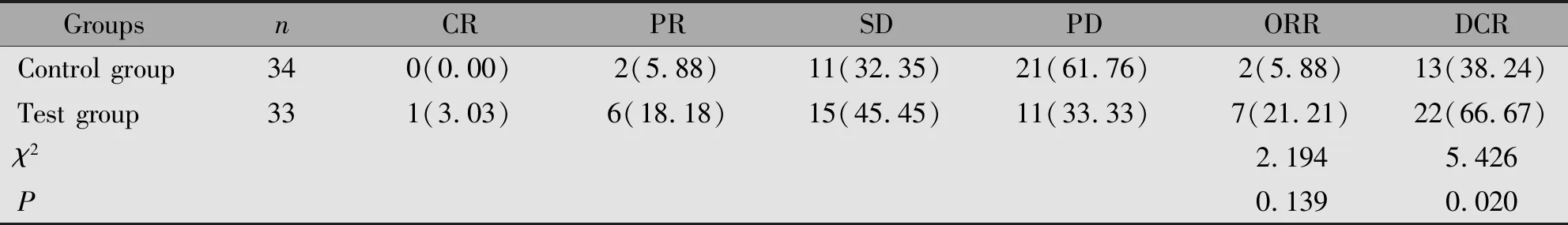
表2 两组患者临床疗效比较[n(%)]
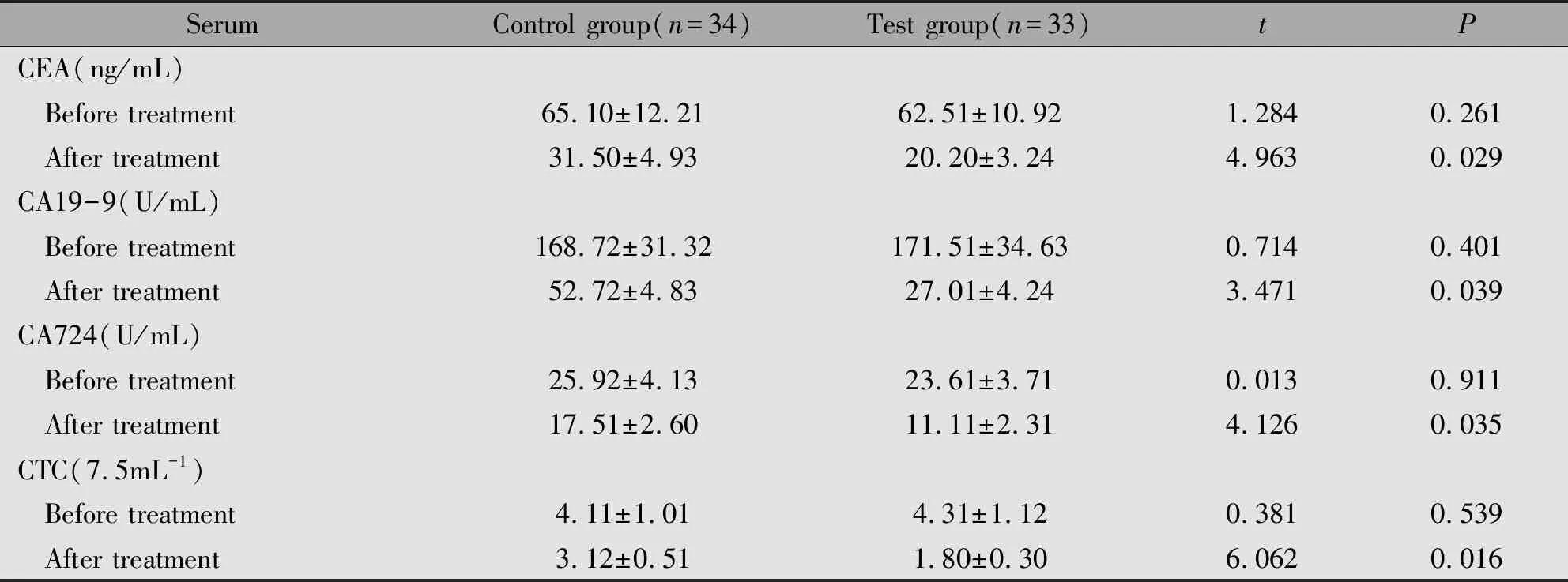
表3 两组患者治疗前后血清CEA、CA19-9、CA724和CTC比较

表4 两组患者治疗前后血清CEA、CA19-9、CA724和CTC差值比较
2.5 治疗相关不良反应比较
两组患者乏力、肝功能损伤、骨髓抑制、感觉神经毒性、关节痛/肌肉痛发生率相比较,差异不具有统计学意义(P>0.05);实验组患者胃肠反应发生率显著高于对照组,差异具有统计学意义(P<0.05)(表5)。

表5 两组患者治疗期间不良反应发生率比较[n(%)]
3 讨论
胰腺肿瘤组织为低氧和乏血供组织,传统放化疗有效率低。胰腺癌间质含有大量的成纤维细胞、肌纤维母细胞、胰腺星状细胞、内皮细胞、周细胞、炎症细胞和神经纤维等纤维结缔组织[14]。间质成分增加了胰腺癌的侵袭性,使癌细胞周围形成一层致密的物理屏障,阻碍了化疗药物的渗入,增加了化疗抵抗,且单纯药物化疗在晚期胰腺癌疗效有限。局部控制率低是晚期胰腺癌复发转移的主要原因,同步放化疗已成共识,高剂量少分次分割放疗应用特殊放射装置将多野、多源、多线束高能射线聚集在靶病灶,可达到高精度定位、高剂量分割照射,既能使靶病灶部位获得高剂量照射,同时避免胰腺周围正常组织辐射[15],提高生物有效剂量,诱导肿瘤内皮细胞血管凋亡,使肿瘤细胞缺氧而快速死亡。
本研究发现,对于局部晚期胰腺癌患者给予高剂量少分次分割,联合白蛋白结合型紫杉醇、替吉奥方案化疗后,实验组患者中位OS和中位PFS为12.4个月和6.3个月,长于对照组的8.5个月和4.2个月。本研究中位OS高于解放军总医院石燕教授2018年在ASCO报道的采用白蛋白紫杉醇联合S-1在晚期胰腺癌胰腺治疗获得的中位OS(10.7个月)[16],均说明放化疗生存期优于单独化疗。实验组患者ORR为21.21%,虽高于对照组的5.88%,但差异无统计学意义,DCR为66.67%,高于对照组的38.24%。说明联合治疗临床疗效优于单纯化疗,其作用机制可能为白蛋白结合型紫杉醇联合替吉奥不但可破坏肿瘤组织DNA复制,还可抑制肿瘤细胞在放疗后的加速增殖,使肿瘤细胞从放疗耐受周期进入放疗敏感周期,抑制亚致死性损伤修复,具有放疗增敏作用,两者联合治疗可有效控制局部病灶和杀灭血液中潜在的亚临床病灶,提高局部控制率,减少远处复发转移。研究结果在ORR上未显示出统计学差异,而DCR显著升高,可能为实验组患者相对对照组治疗后达到完全缓解和部分缓解病例较少,这也是晚期胰腺癌治疗的普遍难题,其优势多集中在控制局部病灶在一个稳态范围,降低肿瘤活性为主。此外,实验组患者治疗后血清CEA、CA19-9、CA724和CTC指标显著低于对照组患者,说明实验组患者高剂量少分割放疗联合化疗后局部肿瘤负荷减轻,释放入血液中肿瘤标志物测得值显著下降;而上述血清标志物又是胰腺癌预后和疗效判定的敏感标志物,进一步说明了本研究治疗方案的临床价值。
在治疗获益的同时,胰腺癌患者放化疗期间治疗相关不良反应是临床医师和患者关心的另一个热点。统计分析发现,两组患者治疗期间主要不良反应多集中在1~2级,两组患者在乏力、肝功能损伤、骨髓抑制、感觉神经毒性、关节痛/肌肉痛发生率相比较无统计学差异,实验组患者胃肠反应高于对照组,为消化道肿瘤放疗常见不良反应,给予止吐、促进消化,胃肠或静脉营养支持后均可耐受,能否给予预防性措施干预,进一步提高患者耐受性,减轻胃肠反应,是我们今后临床实际工作需要面对的问题。两组患者中途退出研究病例为肿瘤进展或者基础疾病导致治疗中断,未出现治疗相关致死病例。
综上所述,高剂量少分次放疗联合白蛋白结合型紫杉醇、替吉奥方案化疗在局部晚期胰腺癌患者中疗效确切,有效延长生存时间,临床获益明显,且不良反应可耐受,为今后此类患者治疗提供新的思路。

