壳聚糖/PVA/ZnO复合膜抗菌性能的检测方法比较研究
张瑶心, 刘煜东, 陈 曦, 侯文倩, 连小琴, 王兰金, 张 宇
(湖北第二师范学院化学与生命科学学院 植物抗癌活性物质提纯与应用湖北省重点实验室,湖北 武汉 430305)
0 引 言
微生物污染会使食品质量恶化,保质期缩短,采用具有抗菌性能的材料包装食物能够有效抑制细菌生长、提高食品货架期[1]。壳聚糖是自然界中含量丰富的天然多聚物,它不仅具有良好的生物可降解性、重金属离子吸附能力,生物相容性强且无毒性,还对各类微生物具有广泛的抗菌能力,可被制成粉末、珠、纤维和薄膜[2],因此可作为防腐材料应用于医药、食品、化妆品和农业等领域[3]。将氧化锌、氧化银等无毒的无机纳米粒子加入到壳聚糖中,能使抗菌材料在各方面的性能得到改善[4]。研究表明,加入ZnO后壳聚糖/ZnO复合材料的抗菌性能明显增强[5-6]。此外,在壳聚糖复合材料中添加聚乙烯醇(polyvinyl alcohol,PVA),还能改善材料的亲水性和耐污染性。
壳聚糖复合材料的抗菌性能对其应用极为重要,然而由于抗菌剂和辅料的多样性,很难用统一的测试方法来评价壳聚糖复合材料的抗菌效果。目前国内外还没有针对壳聚糖复合材料抗菌性能的通用的检测方法和标准,而且由于实验室环境、测试条件的差异,测试的结果差别较大。目前可通过平板扩散法[7]、摇瓶振荡法[8]、贴膜法[9]、激光共聚焦显微镜和扫描电子显微镜观察法[10]来检测复合材料的抗菌性能[11]。平板扩散法是检测复合材料抗菌性能最常用的方法,但只有金属离子等可溶出的成分才能在固体或半固体培养基内部扩散,而且平板扩散法产生的抑菌圈虽然直观地显示材料的抑菌性能,但灵敏度和准确性较差;贴膜法需要在复合材料表面滴加菌液,作用一段时间后洗脱残余细菌,观察细菌数量的变化,由于抗菌材料对微生物的吸附程度不同,而且作用时间、温度、湿度、洗脱条件都会导致结果产生明显差异,此方法的便捷性和准确性均不理想。电镜观察法主要观察供试菌接触抗菌材料后所产生的形态和结构变化,直观但无法进行定量分析,而且需要昂贵的大型精密仪器,不仅操作难度大还无法对大批量样品进行检测。摇瓶振荡法是在菌液和抗菌材料一起振荡培养后检测活菌数量的变化,能检测可溶和非溶出性抗菌材料,准确性和重复性好。摇瓶振荡法中活菌数最常用平板菌落计数法来检测,但该方法重复性和准确性都较差,操作耗时长、易污染且无法大批量检测样品。此外,MTT法和CCK-8法也能在一定程度上反映活细菌的数量[12]。活细胞中的脱氢酶将MTT还原为不溶于水的紫色结晶formazan甲臜,可被DMSO或异丙醇等有机溶剂溶解。CCK-8试剂中含有水溶性的 WST-8, 即 2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐),可被活细胞中的脱氢酶还原为水溶性的黄色甲臜。由于细菌中也存在脱氢酶,因此MTT法和CCK-8法也可用于测量菌液的细胞活力以评价药物的杀菌能力,这两种方法可利用96孔板和酶标仪进行检测,方便快捷,灵敏性和重复性均较高,适用于大批量样品的定量分析检测。近些年来,周立刚课题组利用MTT法检测了小檗碱和蓝桉醇等植物抗菌成分的抑菌活性[13],张扬课题组利用MTT法和CCK-8法检测了医用抗菌不锈钢材料的抗菌活性[12],均获得了较好效果。使用不同的检测方法对同一种抗菌材料进行检测会得出不同的结果,因此需要根据抗菌材料的特性选择合适的检测方法[14]。
在本研究中,我们通过平板扩散法和摇瓶振荡杀菌法检测了壳聚糖/PVA/ZnO复合膜对于大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抗菌性能。对摇瓶振荡杀菌的实验条件进行优化,并利用CCK-8法、MTT法和平板菌落计数法测量用复合膜处理前后的菌液,比较了这三种方法的灵敏性和准确性。这项工作可建立一种快速有效地评价复合材料抗菌性能的检测分析方法,为抗菌复合材料在食品、化妆品和污水处理等方面的应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种
大肠杆菌 Escherichia coli (CCTCC AB 93154)、金黄色葡萄球菌Staphylococcus aureus(CCTCC AB 91093)和枯草芽孢杆菌Bacillus subtilis(CCTCC AB 90008)购自中国典型培养物保藏中心。
1.1.2 主要试剂
壳聚糖(脱乙酰度85%)购自山东莱州海利生物制品有限公司;纳米ZnO颗粒(10~50 nm)购自阿法埃莎化学有限公司;聚乙烯醇PVA购自上海阿拉丁生化科技股份有限公司;胰蛋白胨和酵母提取物购自Oxoid公司;K2HPO4、KH2PO4、NaCl、NaOH、盐酸和琼脂粉等化学试剂购自国药集团化学试剂有限公司。噻唑蓝溴化四唑(MTT)购自上海阿拉丁生化科技有限公司;Cell Counting Kit-8(CCK-8试剂盒)购自碧云天生物技术有限公司。
1.1.3 主要仪器
气浴恒温振荡器(THZ-92B):上海博讯医疗生物仪器有限公司;紫外可见分光光度计(UV-5200PC):上海元析仪器有限公司;连续光谱光吸收酶标仪(Spectra Max Plus 384):Molecular Devices公司。
1.1.4 培养基及溶液
LB 培养基:NaCl 10 g,酵母粉 5 g,蛋白胨 10 g,蒸馏水 1 L,pH 7.0。
MTT 溶液:称取 50 mg MTT 粉末,用 10 mL PBS缓冲液溶解,0.22 µm滤膜过滤除菌。
1.2 方法
1.2.1 壳聚糖/PVA/ZnO 复合膜的制备
用8% 稀盐酸溶解纳米ZnO后,加入PVA粉末和壳聚糖粉末混合均匀,在密炼机中于90 ℃反应 15 min,再放入模具中,在 40 MPa的压力下 90 ℃热压5 min,然后通过水冷却将温度冷却到室温脱模取出即可得到壳聚糖/ PVA /ZnO复合膜(CPZ膜)。以数字1,3,5表示ZnO的质量占ZnO和壳聚糖总质量的百分比。作为对照,不加入ZnO,壳聚糖和PVA直接与8%的稀盐酸混合制备的复合膜,简称CP膜。样品名称及具体配方见表1。

表1 壳聚糖/PVA/ZnO复合膜样品制备配方及样品名称
1.2.2 MTT 法、CCK-8法和比浊法对不同浓度菌液的测量
将活化后的金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌菌液以5%接种量接入LB培养基,在180 r/min、37℃ 条件下振荡培养 3 h至对数生长期。通过平板菌落计数法检测菌液浓度,再将菌液进行倍比稀释,用MTT法和CCK-8法检测菌液的细胞活力,并测量菌液在600 nm处的吸光值。根据菌液浓度分别与MTT法和CCK-8法所得数值,以及菌液光吸收值OD600绘制曲线,确定各曲线的线性范围。
平板菌落计数法:用灭菌生理盐水对菌液进行10倍梯度稀释,然后分别取各稀释度的菌液100 µL,加入LB固体培养基平板,涂布平板,37 ℃培养12 h后数菌落数。
MTT 法:取100 µL 菌液至96孔板中,加入20 µL MTT 溶液,混匀后于 37℃ 静置反应 2 h。4000 r/min离心15 min并弃去上清,向沉淀中加入 100 µL DMSO并混匀,然后用酶标仪检测样品在490 nm和630 nm处的吸光值,计算其差值。
CCK-8法:取 100 µL菌液至 96孔板中,加入10 µL CCK-8试剂,混匀后于 37℃ 静置反应 1 h,用酶标仪检测样品在450 nm处的吸光值。
1.2.3 平板扩散法
将含有0.3%琼脂粉的LB半固体培养基加热融化后,分别与3种供试菌的菌液(枯草芽孢杆菌106cfu/mL,大肠杆菌和金黄色葡萄球菌 107cfu/mL)以1000∶1的比例混合均匀后倒平板。将直径4.5 mm的CP和CPZ膜圆片经紫外线照射除菌后,分别贴在混有3种供试菌的半固体LB平板上,在4 ℃静置 12 h 后,再于 37 ℃ 培养 24 h,最后测量抑菌圈和溶胀圈的直径。
1.2.4 温度,转速对细菌生长的影响
将活化后的3种供试菌菌液,以5%接种量接入LB液体培养基中,在180 r/min、37 ℃条件下振荡培养3 h至OD600≈1.0。将3种菌液用灭菌的1%NaCl溶液稀释10倍后,分别在转速为120 r/min和 240 r/min,温度为 25℃ 和 35 ℃ 条件下振荡培养3 h,分别用MTT法和CCK-8法检测菌液的细胞活力,并测量菌液的光吸收值OD600。以振荡培养前的光吸收值OD600或细胞活力作为百分之百,计算振荡培养后菌液的增长率,选取三种供试菌增长率最低的培养条件进行后面的摇瓶振荡杀菌法测定复合膜杀菌能力。



1.2.5 摇瓶振荡检测抗菌膜的杀菌能力
将活化后的3种供试菌菌液,以5%接种量接入LB液体培养基中,在180 r/min、37 ℃条件下振荡培养 3 h 至 OD600≈1.0。用灭菌后的 1%NaCl溶液将菌液稀释10倍后,取10 mL菌液和0.03 g复合膜一起加入锥瓶,对照组不加复合膜。将锥瓶在恒温气浴振荡器中按照前面实验中优化的温度和转速培养3 h,分别用CCK-8法、MTT和平板菌落计数法检测菌液,以不加膜对照组的活菌数量或细胞活力作为百分之百,计数杀菌率。


1.2.6 数据处理与统计分析
所有实验结果均为3次平行实验,数据以平均值±标准差的形式显示,并用Graphpad软件进行ANOVA单因素方差分析。
2 结果与讨论
2.1 平板扩散法检测抗菌膜的抑菌能力
复合材料中可溶成分的扩散范围随着培养基中琼脂浓度的增加而减小,因此我们选用在琼脂粉含量为0.3%的半固体培养基上进行平板扩散法。图1和表2结果表明,复合膜都有不同程度的溶胀,其中CP膜的溶胀最明显,CPZ膜溶胀较少。这可能是由于制备复合膜的过程中盐酸会将壳聚糖部分水解导致复合膜遇水溶胀,而ZnO消耗了部分盐酸,减少了壳聚糖的水解,导致CPZ膜的溶胀减弱。
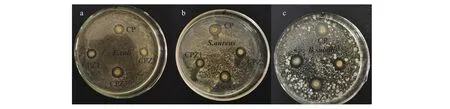
图1 CP和CPZ膜对大肠杆菌(a)、金黄色葡萄球菌(b)和枯草芽孢杆菌(c)的抑制
复合材料的溶胀会增加可溶成分在培养基内部的扩散范围,从而增大了抑菌圈直径。为了更准确地衡量复合膜的抑菌能力,我们测量了抑菌圈和溶胀圈的直径,算出两者的差值,即抑菌环的直径。表2显示,CPZ膜比CP膜对枯草芽孢杆菌的抑菌环大,且具有显著性差异,但CP膜与CPZ膜对大肠杆菌和金黄色葡萄球菌的抑菌环直径无明显差异。平板扩散抑菌圈法作为检测抑菌圈最常用的标准检测方法,虽然能直观展示抗菌材料的抑菌活性,但只能反映可溶组成的抑菌活性,灵敏度和准确性均较差,很难准确衡量CP及CPZ膜的抗菌效果。
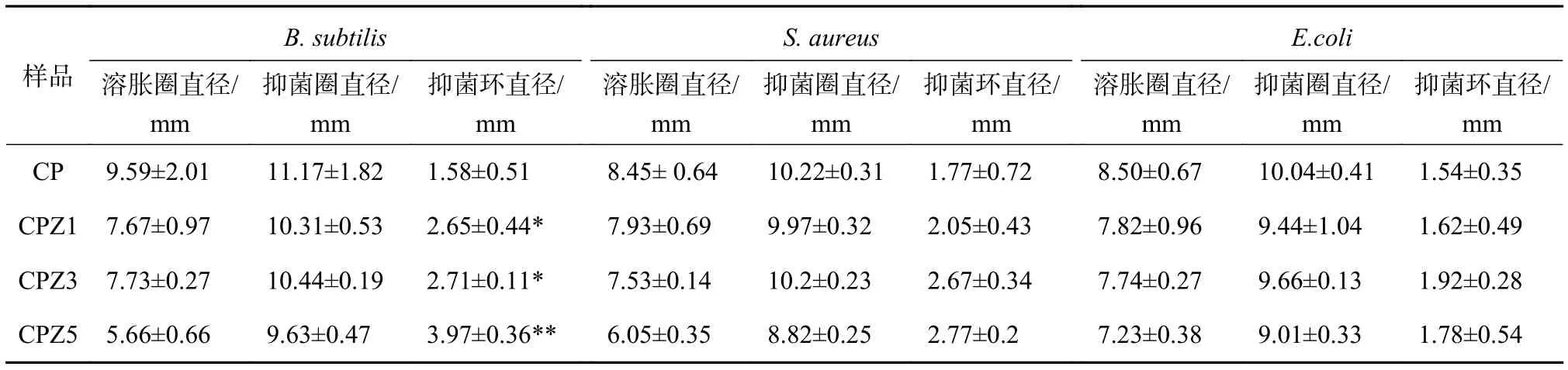
表2 CP和CPZ膜的抑菌圈、溶胀圈和抑菌环直径1)
2.2 比浊法、MTT法和CCK-8法对细菌浓度的测量
将3种细菌菌液进行倍比稀释,根据菌液浓度分别与MTT法和CCK-8法所得数值,以及菌液光吸收值OD600绘制曲线。图2~图4结果表明,随着菌液浓度增加,菌液的光吸收值OD600,以及MTT法和CCK-8法测得的数值增加。当枯草芽孢杆菌的菌液浓度为 1.5×105~4.8×106cfu/mL,金黄色葡萄球菌和大肠杆菌的菌液浓度为1×106~5×107cfu/mL,为光吸收值OD600、MTT法和CCK-8法测定的线性范围。因此本研究后续进行摇瓶振荡杀菌,以及培养条件优化所用枯草芽孢杆菌的初始菌液浓度约为1×106cfu/mL,金黄色葡萄球菌和大肠杆菌的初始菌液浓度 1×107cfu/mL。

图2 菌液浓度与 菌液浑浊度OD600之间的关系
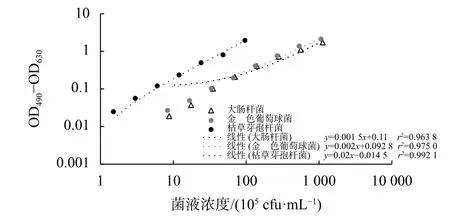
图3 菌液浓度与MTT法检测结果之间的关系
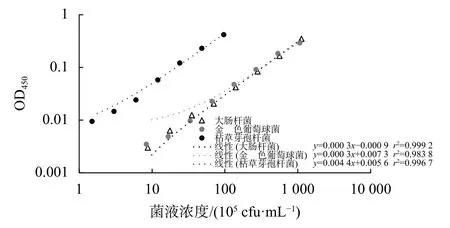
图4 菌液浓度与CCK-8法检测结果之间的关系
2.3 摇瓶振荡法细菌培养条件的优化
摇瓶振荡法需保证菌液振荡培养3 h后活菌数和总菌数均不发生明显变化,以确保在该条件下进行杀菌实验时对照组保持稳定。3种供试菌在锥瓶中振荡培养前后的比例见表3,由于培养基经过10倍稀释,E.coli在25 ℃和35 ℃条件下均无明显增长。S. aureus和B. subtilis在35 ℃的生长速度均比 25 ℃ 快,而且都在 240 r/min 比 120 r/min 时生长更快。因此,采用25 ℃,120 r/min作为进行摇瓶振荡杀菌实验的条件。
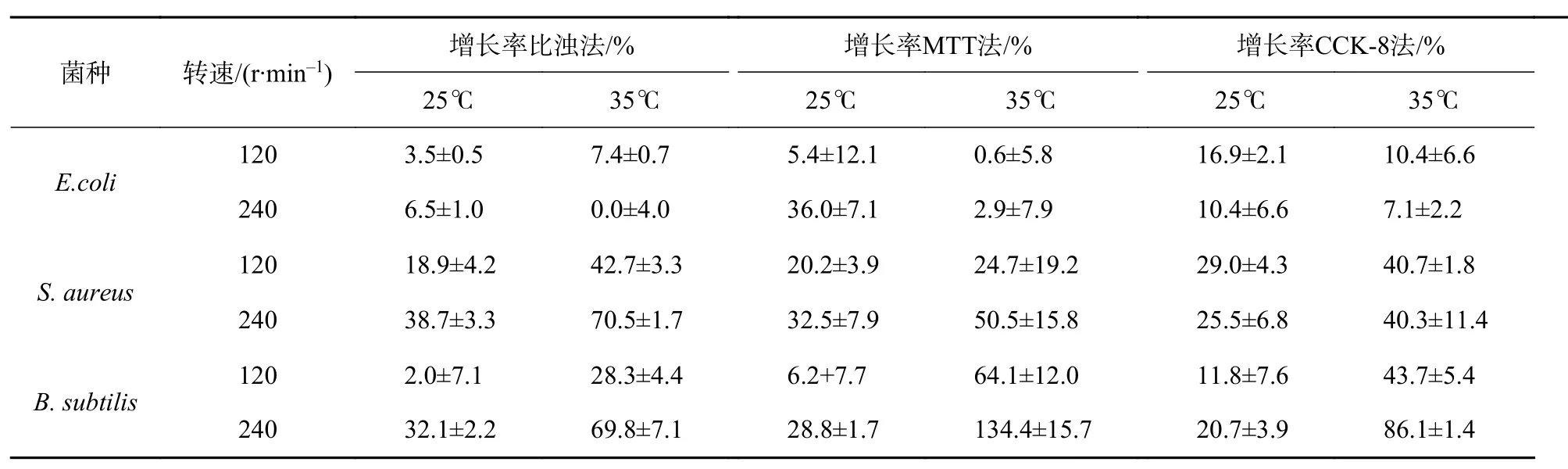
表3 供试菌摇瓶振荡培养前后的变化
2.4 摇瓶振荡检测抗菌膜的杀菌能力
3种细菌菌液与各复合膜在 25 ℃,120 r/min 一起振荡培养3 h后,分别用CCK-8法、MTT法和平板菌落计数法检测菌液并计算杀菌率。CCK-8法检测结果如图5所示,所有CPZ膜对S. aureus和B. subtilis的杀菌能力均明显强于CP膜,差异极显著(P<0.01)。然而CPZ膜对E.coli的杀菌率与CP差别不大。图6表明,MTT法测得所有CPZ膜对3种供试菌的杀菌率均明显高于CP膜,差异极显著(P<0.01),且数据的标准偏差小,重复性和准确性较高。MTT法和CCK-8法检测结果均表明各CPZ膜对S. aureus和B. subtilis的杀菌活性比E.coli的杀菌活性强,可能由于E.coli比S. aureus和B.subtilis对Zn的耐受能力更强。

图5 CCK-8法检测复合膜的杀菌活性
图7表明,平板菌落计数法测出的CPZ1膜与CP膜对E.coli和B. subtilis的杀菌率差别不大,差异没有显著性(P>0.05),而且大部分数据的标准偏差均较大,重复性和准确性较低。值得注意的是,平板菌落计数法测得的CPZ1和CPZ3膜对B.subtilis的杀菌率比它们对E.coli和S. aureus的杀菌率低,这与MTT法和CCK-8法以及平板抑菌实验的结果有所矛盾。这可能是由于在不利条件下B. subtilis形成了芽孢,较难被Zn2+杀死,且芽孢中脱氢酶活性较低因此无法被MTT法和CCK-8法检测,而平板菌落计数法无法分辨B. subtilis的营养细胞和芽孢,两者均可长出菌落。因此这3种方法检测出的CPZ膜对B. subtilis的杀菌活性差异较大,应避免选用会形成芽孢的细菌作为检测杀菌活性的供试菌。
此外,加入复合膜后菌液的吸光值OD600并未发生明显变化,主要是由于壳聚糖和Zn2+虽然杀死了部分供试菌,但并未使它们的细胞破裂,因此无法用比浊法测量复合膜的杀菌率。
2.5 方法比较及结果分析
本研究比较了平板扩散法和摇瓶振荡杀菌法对CP和CPZ复合膜抗菌性能的检测。从原理上来说,平板扩散法基于复合膜中的可溶抗菌成分在半固体或固体培养基中扩散,抑制周围微生物的生长,所形成的抑菌圈的大小只能反映可溶成分的抑菌活性,因此灵敏性差,只能作为定性检测。摇瓶振荡杀菌法则将菌液和抗菌材料在振荡条件下直接接触后检测活菌数量的变化,能反映抗菌材料中的溶解和未释放出的抗菌成分的杀菌活性,摇瓶振荡法所适用的检测范围更广。各种检测方法的性能比较汇总见表4。

表4 各种抗菌性能检测方法的比较
通过平板菌落计数法、MTT法和CCK-8法来检测摇瓶振荡实验中复合膜的杀菌能力,并进行比较。平板菌落计数法是目前通用的活菌数测量技术方法,但需要在超净台中进行无菌操作,不仅容易污染而且步骤繁琐且耗时长,且标准偏差较大,导致测试结果的重复性和准确性较差。MTT法和CCK-8法均是利用活细胞中脱氢酶的活性来间接反映菌液中活细菌数量,不需要进行无菌操作,利用96孔酶标版、多通道移液器和酶标仪可进行大批量样品的定量分析检测。MTT法和CCK-8法不仅方便快捷且耗时短,而且标准偏差小,灵敏性和准确性均较高。其中,MTT法所形成的紫色结晶甲臜需要被DMSO溶解后才能测量吸光值,而CCK-8法所形成的可溶的黄色甲臜可直接测量,因此CCK-8法比MTT法操作更简便,耗时更短。本研究中采用的MTT法通过测量产物的OD490,并减去OD630,减少了菌体本身对吸光值的影响,能更准确地反应菌液的细胞活力,测出的杀菌率更准确。但MTT法和CCK-8法在应用时的前提条件是假设某种细菌单个菌体所含脱氢酶的活性不变,但细菌在不同的培养条件和生长阶段的胞内脱氢酶活性会有差异。因此在摇瓶振荡法检测复合膜杀菌活性时,要以不加复合膜但在相同条件下振荡培养的对照组菌液的细胞活力作为百分之百,来计算杀菌率,才能确保实验结果的准确性。综上所述,相较于平板菌落计数法和CCK-8法,利用96孔板-MTT法检测CP和CPZ复合膜在摇瓶杀菌能力具有操作简单,客观可靠,重复性好等优点。
MTT法测定摇瓶振荡杀菌实验结果表明,ZnO的加入增强了CPZ复合材料对三种供试菌的杀菌活性。研究表明,微生物细胞吸附的锌离子导致细菌细胞膜变形、细胞内成分渗漏和氧化应激,导致细胞生长受到抑制,最终导致细胞死亡[15-16]。E.coli、S. aureus和B. subtilis都是检测材料抗菌能力时的常用菌种,但它们对金属离子的敏感性有明显差别。外膜的脂多糖层不仅能保持E.coli等革兰氏阴性菌的结构完整性,还能提高它们对重金属毒性的耐受力[17]。此外,革兰氏阴性菌所特有的RND家族外排系统可将胞内和周质空间中过量的Zn2+运输到胞外[18-19]。所以CPZ膜对E.coli的抗菌效果均明显弱于S. aureus和B. subtilis。
3 结束语
本课题利用平板扩散法和摇瓶振荡杀菌法检测了CP和CPZ复合膜在抗菌性能方面的差异。平板扩散法结果表明,CPZ膜比CP膜的抑菌活性强但差异不显著,该方法的灵敏度较差,其结果仅能够作为定性分析。另一方面,本研究用CCK-8法和MTT法检测了不同浓度的3种供试菌菌液,两者都具有较广的线性范围,然后对摇瓶振荡法的温度和振荡速度进行优化。在优化后的条件(25 ℃,120 r/min)下用CCK-8法、MTT法和平板菌落计数法检测了CP和CPZ膜的杀菌活性。结果表明,与CCK-8法和平板菌落计数法相比,MTT法的重复性和准确性最高,MTT法所测得的CPZ膜对3种供试菌的杀菌活性均明显高于CP膜,该方法适用于检测CPZ复合膜对不同供试菌的杀菌率。因此,本研究建立了一种通过MTT法检测壳聚糖/PVA/ZnO复合材料在摇瓶振荡条件下的杀菌能力的检测分析方法,不仅操作便捷,结果准确,定量能力显著,而且能满足批量分析要求,适用于各种复合材料抗菌性能的常规批量检测。

