卵巢癌耐药相关的miRNAs筛选及其预后意义研究
朱轶昊,杨奕辰,马琳琳*
(1.上海健康医学院医学技术学院,中国上海 201318;2.上海杉达学院信息科学与技术学院,中国上海 201209)
卵巢癌是最致命的妇科恶性肿瘤,5年生存率仅为46%[1]。缺乏早期诊断的特异性生物标志物和对化疗药物的耐药是患者不良预后的重要原因[2]。虽然80%的卵巢癌患者最初对紫杉醇/卡铂联合化疗敏感,但约有一半以上的患者在5年内因获得性耐药而复发[3]。因此,识别和开发针对化疗耐药卵巢癌患者的特异性生物标志物和潜在靶点至关重要。
微RNA(microRNA,miRNA)是一类长度约22个核苷酸的非编码RNA分子,可以在转录后水平上调控基因的翻译表达或mRNA的降解[4]。miRNA通过靶向mRNA的3′-UTR,实现对靶mRNA的降解或翻译抑制[5~6],从而调控基因表达。越来越多的证据表明,miRNA能够调节细胞的增殖、分化和应激反应。miRNA功能障碍与人类疾病,尤其是癌症的形成和发展有关[7~8]。许多miRNAs在卵巢癌中异常表达,对癌症的发生发展及预后有重要影响。例如:miR-450a是卵巢癌中显著下调的miRNAs之一,其过表达可抑制与上皮-间质转化相关的多个基因,减少肿瘤细胞的迁移和侵袭,增加肿瘤细胞的凋亡,在卵巢肿瘤异种移植模型中,miR-450a过表达可显著抑制肿瘤生长[9];miR-27a被发现在卵巢癌组织和细胞系中显著升高,抑制miR-27a的表达可抑制SK-OV-3和OVACAR-3卵巢癌细胞系的细胞周期进展,进而抑制其增殖[10]。此外,Zhou等[11]研究表明,低表达的miR-595与卵巢癌患者更短的生存期相关。本研究利用TCGA数据库下载卵巢癌的转录组数据及对应的临床信息,通过差异分析筛选与卵巢癌耐药相关的miRNAs,随后通过单因素Cox比例风险回归分析及Kaplan-Meier分析筛选出与预后相关的miRNAs,并通过构建预后风险评分模型来预测卵巢癌患者的预后风险,探讨其与卵巢癌预后的相关性,以期为提高卵巢癌患者的个体治疗提供参考。
1 材料与方法
1.1 数据的获取
卵巢癌相关的miRNAs表达数据及相应的临床数据均来源于TCGA数据库(https://portal.gdc.cancer.gov/)。下载的基因表达数据包含499例卵巢癌患者,临床数据包含年龄、FIGO分期、病理分级、淋巴结转移、脉管侵袭、耐药与否及肿瘤残留大小等信息[12]。
1.2 差异表达miRNAs筛选
利用R软件对下载的卵巢癌数据进行预处理,将counts数转化为表达值,并将样本ID转换为miRNAs基因名。根据卵巢癌耐药与否,我们分别将卵巢癌样本分为耐药组与非耐药组,通过R软件的“edgeR”包筛选出与卵巢癌耐药相关的mi-RNAs,筛选标准为:|log2FC|≥1(FC:fold change),P≤0.05[13]。
1.3 与卵巢癌总体生存相关miRNAs基因集的筛选
为了筛选与卵巢癌总体生存相关的miRNAs基因集,利用 R 软件的“survival”和“survminer”对卵巢癌耐药相关的miRNAs分别进行单因素Cox比例风险回归分析及Kaplan-Meier分析,P≤0.05被认为与卵巢癌的总体生存相关,最终取两种分析方法的交集进行下一步分析。
1.4 预后风险评分模型的构建
利用R软件中“survival”包的多因素Cox回归分析构建预后风险评分模型。采用前向逐步回归法筛选多因素模型纳入变量,以缩小用于构建预后风险评分模型的miRNAs基因集数。根据风险评分的中位数将卵巢癌患者分为高风险组和低风险组。采用Kaplan-Meier分析比较高风险组及低风险组患者的总体生存期,并采用log-rank检验进行评价。采用时间依赖性ROC曲线分析复发预测模型的敏感性和特异性。多因素分析用于评估风险评分是否独立于年龄、FIGO分期、病理分级、淋巴结转移、脉管侵袭及肿瘤残留大小等临床病理参数,成为卵巢癌患者预后的独立风险因子[14]。
1.5 列线图模型的构建
利用R软件的“rms”软件包绘制列线图模型。用于构建列线图的变量包括年龄、FIGO分期、病理分级、淋巴结转移、脉管侵袭、肿瘤残留大小和风险评分。校准曲线可以展示列线图模型在全部预测概率范围内的校准能力[15]。为评估列线图中实际生存和预测生存的一致性,用校准曲线评价列线图模型的预测能力。
1.6 统计学方法
所有分析均采用SPSS 23.0和R 3.5.3进行。所有统计检验均为双侧检验,P值小于0.05被认为具有统计学意义。符合正态分布的连续变量采用独立t检验进行组间差异比较,而偏态分布的连续变量则采用Mann-Whitney U检验进行比较。
2 结果
2.1 卵巢癌耐药相关的miRNAs
根据卵巢癌耐药与否将患者分为耐药组及非耐药组,利用R软件的“edgeR”包进行差异分析,筛选出与卵巢癌耐药相关的差异miRNAs共84个(P<0.05)。
2.2 卵巢癌预后相关的miRNAs
为了探讨卵巢癌耐药相关的miRNAs与患者预后的关系,我们首先利用单变量Cox比例风险回归分析法进行筛选,结果显示:16个miRNAs与卵巢癌患者的总体生存相关(表1,P<0.05)。随后对这16个基因进行Kaplan-Meier分析,结果表明,共有12个基因与卵巢癌患者的预后相关(图1,P<0.05)。我们将这12个基因用于下一步的分析。

表1 单因素Cox比例风险回归分析筛选出的与卵巢癌预后相关的miRNAsTable 1 miRNAs related to the prognosis of ovarian cancer selected by univariate Cox proportional risk regression analysis
2.3 卵巢癌预后风险评分模型
采用前向逐步回归法在单变量Cox比例风险回归分析和Kaplan-Meier分析的基础上继续缩小用于构建预后风险评分模型的miRNAs基因集数。结果表明,经过前向逐步回归法,我们最终筛选出8个miRNAs(表2)。将筛选的基因置入多变量Cox比例风险回归分析,根据这些miRNAs的回归系数构建以下公式:Risk10=-653.47×hsa-miR-6786-5p+282.93×hsa-miR-7155-3p-0.06×hsamiR-30e-3p+4 972.34×hsa-miR-4502-8 158.13×hsa-miR-3927-3p+427.09×hsa-miR-3662-0.09×hsa-miR-30d-5p+3 121.64×hsa-miR-548ai,构建预后风险回归模型。根据模型每个患者将得到一个复发风险评分。根据风险评分的中位值将患者分为高风险组及低风险组,Kaplan-Meier生存曲线提示高风险组患者具有较差的预后结果(P=0.029,图2A),ROC曲线表明该风险模型在预测复发风险上具有较好的敏感性及特异性(图2B)。卵巢癌患者的风险评分、生存状态及基因表达的聚类热图分别见图2C、图2D和图2E。
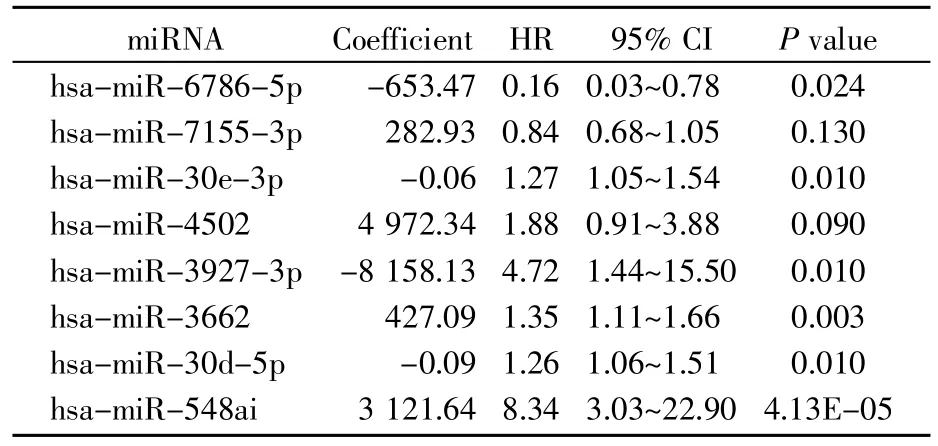
表2 用于构建风险评分模型的miRNAs及其回归系数Table 2 miRNAs used to construct prognostic risk score model and their regression coefficients

图2 预后风险评分模型的构建(A)Kaplan-Meier曲线;(B)ROC曲线;(C)卵巢癌患者风险评分;(D)卵巢癌患者生存状态分析;(E)卵巢癌患者基因表达聚类热图。Fig.2 Construction of prognostic risk score models(A)Kaplan-Meier survival curve;(B)ROC curve;(C)The risk scores of ovarian cancer patients;(D)Analysis of survival status of ovarian cancer patients;(E)The gene expression heat map of ovarian cancer patients.
2.4 预后风险评分是预测卵巢癌患者预后的独立风险因子
为了探索构建的预后风险评分模型对卵巢癌患者预后风险的预测是否独立于患者的年龄、FIGO分期、病理分级、淋巴结转移、脉管侵袭及肿瘤残留大小等临床病理参数,我们针对风险评分及临床病理参数进行了单因素及多因素分析。结果表明,风险评分(HR=1.41,95%CI=1.30~1.53;P=5.57E-17)及FIGO分期(HR=0.55,95%CI=0.39~0.78;P=0.000 7)均与卵巢癌患者的总体预后相关。其中,风险评分(HR=1.37,95%CI=1.09~1.73;P=0.008)为预测卵巢癌患者预后的独立风险因子(表3)。

表3 预后风险评分模型的单因素和多因素Cox回归分析Table 3 Univariate and multivariate Cox regression analysis of prognostic risk score model
2.5 预后风险评分与卵巢癌患者临床病理参数的相关性
进一步探索预后风险评分与卵巢癌患者年龄、FIGO分期、病理分级、淋巴结转移、脉管侵袭及肿瘤残留大小等临床病理参数之间的关系。结果表明,预后风险评分与卵巢癌患者的FIGO分期密切相关(P<0.000 1,表4),而与年龄、病理分级、淋巴结转移、脉管侵袭及肿瘤残留大小等病理参数无关(P>0.05,表4)。

表4 预后风险评分与卵巢癌患者临床病理参数之间的相关性Table 4 The correlation between the prognostic risk score and clinicopathologic parameters of ovarian cancer patients
2.6 列线图模型
最后,为了联合风险评分及年龄、FIGO分期、病理分级、淋巴结转移、脉管侵袭、肿瘤残留大小等临床病理参数对患者的预后进行有效预测,我们构建了列线图模型。结果显示,该模型可以充分利用各个预后变量对卵巢癌患者的死亡风险进行精准预测(图3)。校准曲线表示,列线图模型在预测复发风险上具有较好的校准能力,即模型预测风险与患者实际风险具有较好的一致性(图4)。

图3 列线图模型Fig.3 Nomogram model

图4 列线图的校准图(A)卵巢癌患者1年生存率预测;(B)卵巢癌患者2年生存率预测;(C)卵巢癌患者3年生存率预测。Fig.4 Calibration diagram of nomogram(A)Prediction of 1-year survival rate for ovarian cancer patients;(B)Prediction of 2-year survival rate for ovarian cancer patients;(C)Prediction of 3-year survival rate for ovarian cancer patients.
3 总结与讨论
卵巢癌的主要化疗方法是以铂类为基础的联合化疗,其已被证明是最有效的化疗方案。然而,在铂类为基础的联合化疗中,疾病常因耐药而复发[16]。因此,寻找耐药相关的肿瘤标记物,并探索其对卵巢癌预后的影响,对卵巢癌患者的精准治疗至关重要。miRNA是一类由内源性基因编码的长度约为22个核苷酸的非编码RNA分子,参与调控动植物转录后的基因表达[17]。Shin等[18]研究表明,miRNA可以参与肿瘤的发生发展,调节肿瘤细胞对放疗和化疗的敏感性。因此,本研究筛选出与卵巢癌耐药相关的miRNAs,并从中筛选出与预后相关的miRNAs构建预后风险评分模型,以预测卵巢癌患者的复发风险。
首先,我们从TCGA数据库中下载卵巢癌转录组数据及临床数据,根据卵巢癌耐药与否将患者分为耐药组及非耐药组,并进行差异分析,筛选出与卵巢癌耐药相关的基因。随后,对筛选出来的基因进行单因素Cox比例风险回归分析及Kaplan-Meier分析,进一步筛选出与预后相关的基因。最后,利用这些基因构建预后风险评分模型。Kaplan-Meier生存曲线分析表示,与低风险组患者相比,高风险组患者具有较差的预后。ROC曲线表示,该风险模型在预测复发风险上具有较好的敏感性及特异性。进一步的Cox回归分析提示,该预后风险评分是预测卵巢癌患者复发风险的独立影响因子。此外,我们还联合风险评分及年龄、FIGO分期、病理分级、淋巴结转移、脉管侵袭、肿瘤残留大小等临床病理参数构建了列线图模型,结果显示,该模型可以对卵巢癌患者的死亡风险进行精准预测。
在用于构建预后风险评分模型的8个miRNAs中,目前仅3个是有相关文献报道过的,即hsa-miR-30e-3p、hsa-miR-3662 和 hsa-miR-30d-5p。Koutsaki等[19]研究表明 hsa-miR-30e-3p的表达与卵巢癌的上皮-间质转化相关。hsa-miR-3662在实体瘤肺腺癌中过表达,且在可手术腺癌的诊断中发挥着重要的作用[20]。然而,hsa-miR-3662被报道在肝癌组织和细胞系低表达,且低表达的hsa-miR-3662与肿瘤大小、肿瘤多样性、Edmondson分级和肿瘤-淋巴结转移分期相关[21]。Shi等[22]研究表明hsa-miR-30d-5p的高表达与卵巢癌良好的预后水平相关。
综上所述,我们通过一系列生物信息学方法筛选出8个与卵巢癌预后相关的miRNA标志物。多因素Cox比例风险回归分析表明,8个miRNAs是卵巢癌预后的独立风险因素。结合预后风险评分及卵巢癌的临床病理参数构建的列线图模型可有效预测卵巢癌的生存率。该预测方法在一定程度上可为未来卵巢癌预后相关研究提供方向。