草鱼源维氏气单胞菌毒力基因及耐药性分析
元丽花
摘 要:為了解草鱼Ctenopharyngodon idellus养殖过程中维氏气单胞菌Aeromonas veronii的流行季节及不同时期维氏气单胞菌毒力基因携带情况及防治方法,从福建省顺昌县某养殖场患病草鱼肝脏、肾脏、脾脏等组织分离得到7株致病菌进行研究。通过细菌分离培养、革兰氏染色镜检、生化鉴定、毒力基因、药敏试验、16S rRNA与gyrB基因测序对分离菌株进行分析。结果显示,从草鱼体内分离到的7株致病菌在培养基中呈圆形、表面湿润光滑、边缘整齐的淡黄色菌落;菌落周围呈β-溶血;革兰氏镜检呈阴性短杆菌;16S rRNA 、gyrB基因序列分析结合生化鉴定及质谱鉴定,鉴定结果均为维氏气单胞菌;8种毒力基因扩增结果显示,分离菌株均携带Lip 、Act、aerA、Alt、Exu及Fla 6种毒力基因;药敏试验结果显示,各菌株对8种抗菌药物敏感性一致,对盐酸土霉素、甲砜霉素、氟苯尼考、磺胺甲噁唑、磺胺二甲氧嘧啶、交沙霉素及恩诺沙星7种药物相对敏感,对氨苄西林钠、硫酸新霉素、磺胺嘧啶、磺胺间甲氧嘧啶、强力霉素及红霉素6种药物相对耐药。
关键词:草鱼;维氏气单胞菌;毒力基因;药敏试验
中图分类号:S 917.1 文献标志码:A 文章编号:0253-2301(2022)03-0013-07
DOI: 10.13651/j.cnki.fjnykj.2022.03.003
Analysis on the Virulence Genes and Drug Resistance of Aeromonas veroniiin Ctenopharyngodon idellus
YUAN Li-hua
(Fujian Station of Fishery Technology Eextension, Fuzhou, Fujian 350002, China)
Abstract: In order to understand the epidemic season of Aeromonas veronii and the virulence gene carrying situation of Aeromonas veronii in different periods and its prevention and control methods during the aquaculture process of Ctenopharyngodon idellus, seven strains of pathogenic bacteria were isolated from the tissues of diseased Ctenopharyngodon idellus, such as liver, kidney, and spleen in the aquaculture farm of Shunchang County, Fujian Province. The isolated strains were analyzed by using the bacterial isolation & culture, gram staining microscopic examination, biochemical identification, virulence genes, drug sensitivity test, 16S rRNA and gyrB gene sequencing. The results showed that the seven pathogenic bacteria isolated from Ctenopharyngodon idellus showed the round yellowish bacterial colony with smooth moist surface and neat edge in the culture medium. β-hemolysis was observed around the colony, and the gram staining microscopic examination showed the negative brevibacterium. Through the 16S rRNA and gyrB gene sequencing analysis combined with the biochemical identification and mass spectrum identification, the identification results were all Aeromonas veronii. The PCR result of the eight kinds of virulence genes showed that all the isolated strains all carried 6 kinds of virulence genes including Lip, Act, aerA, Alt, Exu and Fla. The results of drug sensitivity test showed that all the strains had the same sensitivity to the eight kinds of antibiotics, and were relatively sensitive to the seven kinds of antibiotics, such as oxytetracycline hydrochloride, thiamphenicol, flufenicol, sulfamethoxazole, sulfadimethoxine, josamycin and enrofloxacin, while were relatively resistant to the six kinds of antibiotics, such as ampicillin sodium, neomycin sulfate, sulfadiazine, sulfamonomethoxine, doxycycline and erythromycin.
Key words: Ctenopharyngodon idellus; Aeromonas veronii; Virulence genes; Drug sensitivity test
草鱼是我国重要的淡水经济鱼类,产量占淡水养殖鱼类产量的1/5,是我国淡水养殖鱼类中产量最大的品种[1]。我国草鱼养殖主体仍采用传统养殖模式,由于养殖密度过大以及缺乏科学的管理,草鱼病害问题日益凸显,给养殖户造成了很大的经济损失[2]。维氏气单胞菌隶属弧菌科、气单胞菌属,在环境中广泛存在,特别是水体环境[3],是一种条件致病菌,当草鱼免疫力降低或体表有创伤时更容易感染,主要症状为体表溃烂、出血、肠炎、腹水,严重时可引起较高的死亡率[4-5]。维氏气单胞菌携带多种毒力基因,多种毒力基因的共同作用会造成鱼体损伤、死亡,因此对维氏气单胞菌引起的水产养殖病害应高度重视[6]。本研究在1~12月对福建省顺昌县某养殖场维氏气单胞菌的发病情况进行监测。监测结果表明,维氏气单胞菌的发病季节为8月至10月,与维氏气单胞菌流行季节相符,患病草鱼主要症状为体表出血、溃烂、肝脏肿大、腹水及肠炎,与维氏气单胞菌感染特征一致。本试验对分离得到的7株草鱼源致病菌进行培养鉴定、毒力基因检测和抗菌药物敏感性分析,旨在探索不同时期草鱼源维氏气单胞菌毒力基因携带情况,并依据药敏试验结果为草鱼养殖过程中维氏气单胞菌的防控和治疗提供依据和指导。
1 材料与方法
1.1 试验材料
患病草鱼样品取自福建省顺昌县某养殖场,体重(1 000±50)g,体长(25±5)cm。大豆酪蛋白琼脂培养基(TSA)、胰蛋白胨大豆肉湯(TSB)及绵羊血琼脂培养基均购自广东环凯微生物科技有限公司;革兰氏染色液试剂盒购自北京陆桥技术股份有限公司;细菌鉴定生化试剂条ID 32E购自生物梅里埃美国股份有限公司;PCR premix试剂盒、核酸提取试剂盒均购自宝生物工程有限公司;引物由福州尚亚生物技术有限公司合成;药物敏感性试验所需原料药由全国水产技术推广总站提供。
1.2 试验方法
1.2.1 细菌分离纯化 无菌操作从濒死的患病草鱼肝脏、肾脏及脾脏蘸取组织,用无菌环分别划线接种于TSA培养基,于28℃恒温培养18~24 h后,挑取形态一致的优势菌落划线接种于TSA培养基,得到纯培养菌落。挑取单个纯培养菌落于TSB培养基中28℃恒温震荡培养18~24 h后4℃保存备用。
1.2.2 细菌形态观察及生理生化鉴定 从纯培养后的TSA培养基上挑取生长良好的单个菌落于载玻片上进行革兰氏染色,显微镜下观察菌体形态;取纯培养后的单个菌落划线接种于血琼脂平板,观察其溶血性,并从血琼脂平板上挑取单个菌落进行ID 32E生化鉴定,37℃培养24 h后,使用VITEK 2 Compact全自动细菌鉴定系统进行菌株的生化鉴定。
1.2.3 细菌16S rRNA及gyr B基因序列分析 取纯化菌液,按照核酸提取试剂盒说明书提取DNA作为PCR扩增模板。16S rRNA及gyr B基因引物信息见表1,引物均由福州尚亚生物技术有限公司合成。16S rRNA PCR反应体系(共50 uL)为:DNA 2 uL,上下游引物(10 umol·L-1)各1.5 uL,Premix Taq预混试剂 25 uL,ddH2O 20 uL。PCR反应条件为:94℃预变性3 min,94℃变性1 min,55℃退火1 min 20 s,72℃延伸2 min,共35个循环,最后72℃再延伸5 min,4℃保温[7]。PCR产物经1.5%琼脂糖凝胶电泳进行检测,将阳性产物送至福州尚亚生物技术有限公司进行测序,并将测得的基因序列在NCBI中进行同源性比对分析。
1.2.4 菌株质谱鉴定 将纯化后的菌株划线接种于血琼脂培养基,28℃培养24 h后挑选单个菌落均匀涂布于靶板,待干燥后加基质液覆盖,通过VITEK MS Plus质谱仪进行菌株鉴定。
1.2.5 毒力基因序检测 参照Nawaz等[8]方法,以提取的DNA为模板,通过PCR扩增对细胞毒性肠毒素(Act)、气溶素(aerA)、脂酶(Lip)、核酶(Exu)、鞭毛(Fla)、丝氨酸蛋白酶(Ser)、热不稳定性肠毒素(Alt)、溶血素(hlyA)等毒力基因进行检测,PCR产物经1.5%的琼脂糖凝胶电泳进行分析。引物序列信息及扩增片段大小见表1。
1.2.6 药物敏感性试验 药物敏感性试验采用96孔板微量肉汤稀释法。挑取单个菌落接种于TSB培养基中,置于28℃恒温摇床培养24 h制备为菌悬液。将14种抗生素药物配制成200 ug·L-1的浓度;按照倍比稀释法将抗菌药物稀释至第11孔,形成11个药物梯度;再依次加入浓度为106 CFU·mL-1的菌悬液;每种药物做2个平行;28℃恒温培养24 h,观察各孔培养液中细菌的生长情况,以抑制细菌生长的药物最高稀释度作为供试药物的最小抑菌浓度(MIC)。
2 结果与分析
2.1 菌株形态及生理生化特征分析
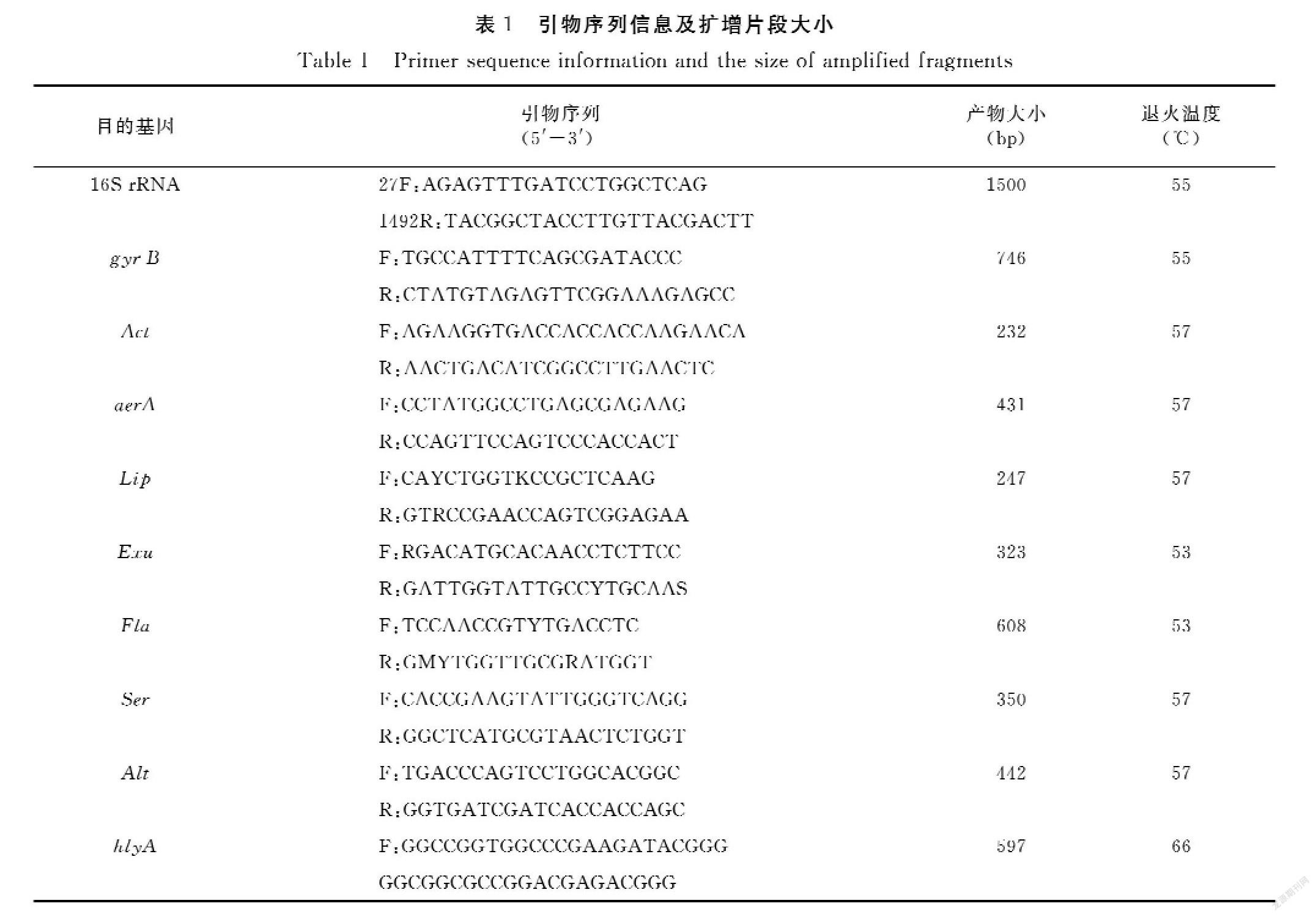
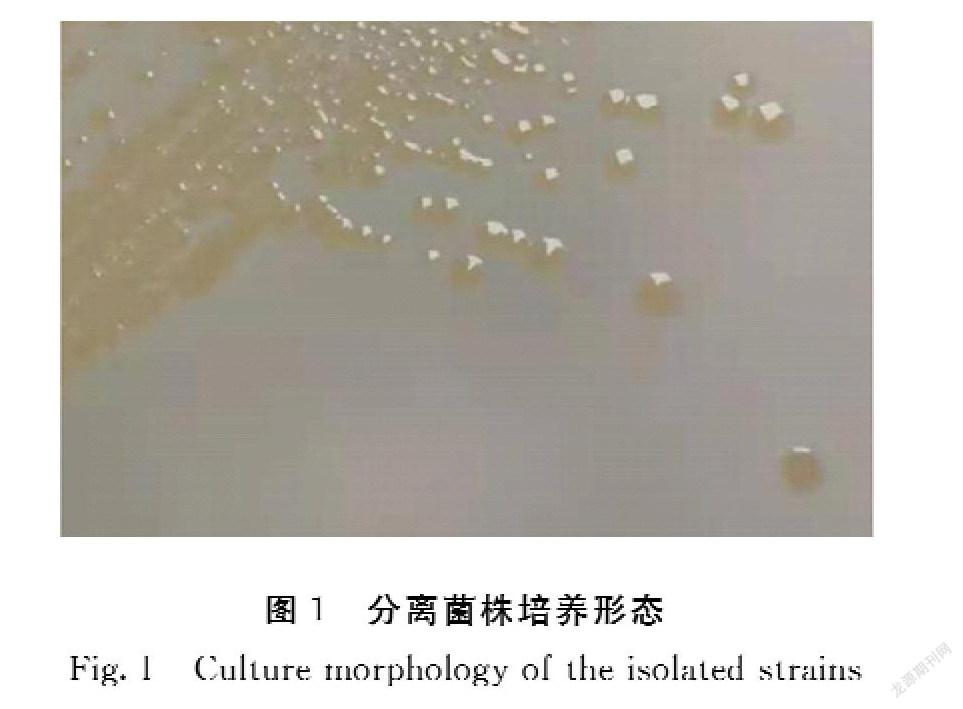
分离菌株在TSA上形成圆形、表面湿润光滑、边缘整齐的淡黄色菌落(图1);在绵羊血琼脂平板上可见半透明、边缘整齐的灰白色菌落,菌落周围产生β-溶血环(图2);革兰氏染色镜检为两端钝圆的阴性短杆菌(图3);分离得到的菌株生化鉴定结果见表2,与标准菌株的符合概率为99%,鉴定结果为维氏气单胞菌;各菌株质谱鉴定出现相同的特征峰(图4),质谱鉴定结果为维氏气单胞菌。结合细菌形态和生理生化结果,7株菌株初步判定为维氏气单胞菌。
2.2 16S rRNA及gyrB基因序列分析
PCR扩增得到的16S rRNA目的条带大小约1 500 bp,看家基因gyrB大小约746 bp,与预期扩增条带一致。将测序所得序列在NCBI中进行同源性比对,结果显示,分离菌株16S rRNA及gyrB基因与维氏气单胞菌同源性均>99%。结合分离菌株形态特征、生理生化鉴定、质谱鉴定(图4)、16S rRNA及gyrB基因序列分析,最终确定分离菌株为维氏气单胞菌。
2.3 毒力基因检测
由表3可知,分离7个菌株的Lip 、Act、aerA、Alt、Exu及Fla毒力基因PCR扩增结果条带大小与预期片段相符,检出率为100%;对hlyA毒力基因的携带则表现不同,检出率为71.43%,均未携带Ser毒力基因。
2.4 药物敏感性试验
采用微量肉汤稀释法(96孔板)测定分离菌株对14种抗生素类药物的敏感性,结果见表4。由测定结果可知,分离菌株均对盐酸土霉素、甲砜霉素、氟苯尼考、磺胺甲噁唑、磺胺二甲氧嘧啶、恩诺沙星及交沙霉素7个药物相对敏感,对氨苄西林钠、硫酸新霉素、磺胺嘧啶、磺胺间甲氧嘧啶、强力霉素及红霉素6种药物相对耐药,对盐酸环丙沙星表现为中介。
3 讨论与结论
维氏气单胞菌是一种人、兽、水生动物共患的条件致病菌,淡水鱼感染后可引起出血、肠炎、腹水等症状,人感染后可引起败血症、肠胃炎、腹膜炎等疾病[9-11],现已被国家列为食品和水体安全的检测对象。本研究在1月至12月对福建省顺昌县某养殖场草鱼源维氏气单胞菌发病情况进行监测,结果表明鱼源维氏气单胞菌发病时间为8月至10月,发病特征为体表出血、溃烂、肝脏肿大、腹水及肠炎,与维氏气单胞菌的流行季节及流行特征一致。从患病草鱼体内共分离到7株维氏气单胞菌,菌株形态与高彩霞等[12]、覃华斌等[13]研究结果一致,与斑点叉尾鮰[14]、克氏原螯虾[15]等品种上分离到的维氏气单胞菌细菌形态也表现出一致性,这说明不同地区及不同品种的维氏气单胞菌培养特性无明显差异。
16S rRNA基因序列分析是细菌种属鉴定的常用方法,大约有2 500个种的16S rRNA全序列已经被报道。但16S rRNA基因序列具有高度保守性,包含的信息量较少,在区分亲缘关系较近的菌株准确性较差,存在一定的局限性[16]。gyrB基因是普遍存在于细菌内编码DNA促旋酶中B亚单位蛋白的基因,是蛋白编码基因的典型代表,不会发生频繁的水平转移,在不同的蛋白及蛋白的不同位点,其氨基酸替代率也不同,在区分亲缘关系较近的菌株更加准确。质谱鉴定通过分析分子离子的质量电荷比(m/z)来鉴定和定量检测分子,将不同种微生物经质谱分析所形成的质量图谱与数据库中的参考图谱进行比较, 从而实现对目标微生物种或菌株的区分和鉴定,与传统的生化表型鉴定方法和分子生物学方法相比,质谱鉴定具有操作简单、快速、准确和经济的特点,现已广泛应用于生命科学及相关领域。为保证试验结果的准确性,本研究采用16S rRNA及gyrB基因进行序列分析,结合生理生化鉴定及质谱鉴定确定分离菌株为维氏气单胞菌。
毒力基因常作为细菌毒力强弱的判断标准之一,维氏气单胞菌能产生Act、aerA、Fla、Alt、Lip等多种毒力基因[17],其强致病性与毒力基因的种类、数量及复杂的致病机制存在一定的相关性。本试验检测了维氏气单胞菌的8种毒力基因,其中aerA能改变细胞膜的通透性,使宿主细胞凋亡,可引起宿主内脏器官与体表出血,是维氏气单胞菌有无致病性的标志之一[18-19];Fla基因是细菌的重要毒力因子,参与细菌的吸附、侵袭与定植,进而引起草鱼肠炎[20];hlyA可导致宿主细胞的渗透性裂解和完全溶血,在维氏气单胞菌的致病过程中起到关键的作用[21];Lip能溶解宿主脂质,参与宿主细胞膜的变化;Act、Alt可引发细胞凋亡。毒力基因检测结果显示,8月至10月分离得到的维氏气单胞菌Lip、Act、aerA、Alt、Exu及Fla6种毒力基因检出率为100%,hlyA毒力基因检出率为71.43%。本研究患病草鱼出现体表出血及肠炎等症状,与患病草鱼携带aerA、Fla等毒力基因密切相关;患病草鱼均有腹水的症状,但未见资料表明是由某個毒力基因引发的,可能是多种毒力基因协同作用的结果;在不同月份分离到的菌株在hlyA毒力基因上有所差异,未呈现一定的规律性,但对草鱼的致病性基本一致,这与各菌株含有多种毒力基因且致病机制复杂有关,个别毒力基因的差异并不能明显表现出各菌株致病性的差异;各菌株均未携带Ser毒力基因,与张飘等[22]研究结果不一致,这可能是由于不同地区分离得到的菌株所携带的毒力基因有所差异。
由药敏试验结果可知,7株菌株对14种抗生素类药物的敏感性无明显差异,均对盐酸土霉素、甲砜霉素、氟苯尼考、磺胺甲噁唑、磺胺二甲氧嘧啶、恩诺沙星及交沙霉素7个药物相对敏感,对氨苄西林钠、硫酸新霉素、磺胺嘧啶、磺胺间甲氧嘧啶、强力霉素及红霉素6种药物相对耐药,这表明在同一养殖场不同月份分离到的菌株对同一种抗生素类药物的敏感性是一致的。致病菌株的药物敏感性与养殖地区、养殖环境及用药习惯有很大关系,在草鱼养殖过程中应依据药敏试验结果对病害防控进行科学指导。
本研究于8月至10月从患病草鱼体内分离得到的7株维氏气单胞菌均含有多种毒力基因,不同月份分离到的维氏气单胞菌毒力基因种类有所差异未呈现一定的规律性,其差异原因有待进一步研究。在水产养殖过程中应依据药敏试验结果为草鱼养殖过程中维氏气单胞菌的预防控制及治疗提供科学精准的用药指导,可采用轮换用药和联合用药,避免耐药菌株的产生,确保水产养殖业绿色健康可持续性发展。
参考文献:
[1]黄浦江,程俊,冯卫权,等.一株草鱼维氏气单胞菌的分离鉴定及毒力基因分析[J].中国畜牧兽医,2020,47(3):848-855.
[2]康元环,张冬星,杨滨僮,等.维氏气单胞菌最新研究进展[J].中国人兽共患病学报,2018,34(5):452-459,465.
[3]吴同垒,单晓枫,孟庆峰,等.维氏气单胞菌研究进展[J].中国兽药杂志,2011,45(7):41-44.
[4]宋明芳,张冬星,张海鹏,等.维氏气单胞菌毒力因子的研究进展[J].中国兽医科学,2018,48(8):1038-1042.
[5]隗黎丽,王自蕊,杨竹青.草鱼2株气单胞菌的分离与鉴定[J].水产科学,2013,32(6):348-352.
[6]GALINDO C L,GUTIERREZ C J,CHOPRA A K.Potential involvement of galectin-3 and SNAP23 in Aeromonas hydrophila cytotoxic enrerotoxin-induced host cell apoptosis[J].Microbial Pathogenesis,2006,40(2):56-68.
[7]贾丹,史成银,黄倢,等.凡纳滨对虾急性肝胰腺坏死病(AHPND) 病原分离鉴定及其致病性分析 [J]. 渔业科学进展,2018,39 (3):103-111.
[8]NAWAZ M,KHAN S A,KHAN A A,et al.Detection and characterization of virulence genes and integrons in Aeromonas veronni isolated from catfish[J].Food Microbiology,2010,27(3):327-331.
[9]胡萌.江苏地区气单胞菌分离鉴定及强毒株生物学特性分析[D].南京:南京农业大学,2012.
[10]胡安东,杨霞,张飘,等.水生动物维氏气单胞菌病概述[J].贵州畜牧兽医,2019,43(2):39-42.
[11]KUMAR N,SINGH N P.Effect of dietary selenium on immuno-biochemical plasticity and resistance against Aeromonas veronii biovar in fish reared under multiple stressors[J].Fish Shellfish Immunol,2019,84:38-47.
[12]高彩霞,任燕,王慶,等.草鱼源致病性维氏气单胞菌的分离鉴定及药物敏感性分析[J].安徽农业大学学报,2018,45(3):409-415.
[13]覃华斌,袁富豪,杨映,等.草鱼致病性维氏气单胞菌的分离鉴定[J].水产科技情报,2019,46(3):150-153.
[14]田浪,温贵兰,张升波,等.斑点叉尾鮰源致病性维氏气单胞菌的分离与生物学特性鉴定[J].中国畜牧兽医,2018,45(11):3203-3210.
[15]彭博文,杨移斌,艾晓辉,等.克氏原螯虾源维氏气单胞菌分离鉴定及药敏特性研究[J].海洋湖沼通报,2020(4):108-114.
[16]郝云婕,韩素贞.gyrB基因在细菌系统发育分析中的应用[J].生物技术通报,2008(2):39-41.
[17]康元环,孟庆峰,夏京津,等.乌鳢致病性维氏气单胞菌的分离鉴定及生物学特性研究[J].动物医学进展,2014,35(5):40-43.
[18]王惠.不同动物源性维氏气单胞菌的生物特性及四种毒力基因比较研究[D].长春:吉林农业大学,2014.
[19]王兴丽,汪开毓,陈德芳,等.一株虹鳟源维氏气单胞菌的分离鉴定及组织病理学观察[J].中国预防兽医学报,2016,38(11):879-883.
[20]任燕,高彩霞,曾伟伟,等.两株草鱼源维氏气单胞菌菌株的主要表型特征及致病力比较[J].中国预防兽医学报,2019,41(2):145-450.
[21]李忱炜.肺炎链球菌溶血素对细菌毒力的影响及诱导RAW264.7细胞凋亡的研究[D].重庆:重庆医科大学,2011.
[22]张飘,胡安东,杨霞,等.一株草鱼维氏气单胞菌的分离鉴定及毒力基因分析[J].中国畜牧兽医,2020,47(3):848-855.
(责任编辑:柯文辉)

