痛风石病人的临床特征及其危险因素分析
范又琳,周诗喆,杨敏,陈颖

[摘要]目的 探討痛风石病人的临床特征及其危险因素,为痛风石的早期防治提供临床依据。方法 收集2016—2021年就诊于我院山东省痛风病临床医学中心的2 290例痛风病人的临床资料,比较有痛风石组和无痛风石组病人的临床特征,并分析其危险因素。 结果 两组病人的年龄、收缩压、舒张压、肾小球滤过率(eGFR)、血肌酐、尿素氮、总胆固醇、空腹血糖、血尿酸和病程等比较,差异均有统计学意义(t=-13.146~7.489,Z=-13.146,P<0.05)。两组病人合并高血压、高糖血症及糖尿病、肾功能轻度及中/重度受损的构成比等比较,差异均有统计学意义(χ2=4.760~59.478,P<0.05);两组合并肥胖、高胆固醇血症与高三酰甘油血症比较,差异均无统计学意义。Logistic回归分析显示,年龄、高血压、高糖血症及糖尿病、高尿酸血症、肾功能不全、病程长等是痛风石发生的危险因素(OR=1.272~2.865,95%CI=1.022~4.730,P<0.05)。 结论 痛风石病人有年龄更大、病程更长、eGFR更低,以及血压、血肌酐、尿素氮、总胆固醇、空腹血糖、血尿酸等更高的临床特点。年龄大、高血压、高糖血症及糖尿病、高尿酸血症、肾功能受损、病程长等是痛风石发生的危险因素。
[关键词]痛风;高尿酸血症;结晶;代谢综合征;危险因素
[中图分类号]R589.7
[文献标志码]A
[文章编号]2096-5532(2022)04-0553-06
doi:10.11712/jms.2096-5532.2022.58.096
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220617.1645.010.html;[JY]2022-06-2015:20:44
CLINICAL FEATURES OF TOPHI PATIENTS AND RELATED RISK FACTORS
FAN Youlin, ZHOU Shizhe, YANG Min, CHEN Ying
(Department of Endocrinology and Metabolic Diseases, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]Objective[WTBZ] To investigate the clinical features of tophi patients and related risk factors, and to provide a cli-
nical basis for the early prevention and treatment of tophi.
Methods Clinical data were collected from 2 290 gout patients who attended Shandong Gout Clinical Medical Center of our hospital from 2016 to 2021. Clinical features were compared between the patients with tophi and those without tophi, and related risk factors were analyzed.
Results There were significant differences between the two groups in age, systolic blood pressure, diastolic blood pressure, glomerular filtration rate (eGFR), serum creatinine, blood urea nitrogen, total cholesterol, fasting blood glucose, blood uric acid, and disease duration (t=-13.146 to 7.489,Z=-13.146,P<0.05). There were also significant differences between the two groups in the composition ratios of hypertension, hyperglycemia, diabetes, and mild and moderate/severe renal impairment (χ2=4.760-59.478,P<0.05), while there were no significant differences in obesity, hypercholesterolemia, and hypertriglyceridemia between the two groups. The logistic regression analysis showed that age, hypertension, hyperglycemia/diabetes, hyperuricemia, renal insufficiency, and long course of disease were risk factors for tophi (OR=1.272-2.865,95%CI=1.022-4.730,P<0.05).
Conclusion Tophi patients tend to have an older age, a longer course of disease, a lower eGFR, and higher levels of blood pressure, serum creatinine, blood urea nitrogen, total cholesterol, fasting blood glucose, and serum uric acid. Old age, hypertension, hyperglycemia/diabetes, hyperuricemia, renal impairment, and long course of disease are risk factors for tophi.
[KEY WORDS]gout; hyperuricemia; crystallization; metabolic syndrome; risk factors
痛风发病的原因是尿酸水平升高超过尿酸单钠(MSU)晶体形成的饱和点,表现为外周关节滑膜炎和严重疼痛发作,最终可能发展为关节损伤和畸形、慢性相关疼痛和皮下痛风石沉积。过去50年中,痛风的全球负担是巨大的[1]。痛风和高尿酸血症都已成为需要迅速解决的公共卫生问题[2]。痛风石是由于尿酸盐结晶沉积于人体组织,引起慢性炎症及纤维组织增生形成的结石,近年来其发病率呈逐年上升趋势。痛风石多发生于拇趾的第一跖趾关节,以及指、腕、肘及膝关节等关节处[3]。痛风石形成的危险因素主要包括年龄、性别、遗传易感性、血尿酸水平、疾病病程、是否合并代谢综合征、生活方式及药物等因素[4]。然而,关于痛风石病人的临床特征和危险因素的调查研究目前还有所缺乏。因此,本文回顾性分析了2016—2021年就诊于我院山东省痛风病临床医学中心的痛风病人的临床资料,对是否并发痛风石病人的临床特征进行统计分析,并探讨痛风石发生的危险因素,旨在为预防痛风石的发生提供依据。现将结果报告如下。
1对象和方法
1.1研究对象
收集2016年11月—2021年4月首次到我院痛风门诊就诊的中国痛风病人的临床资料。按照痛风的诊断标准最终纳入2 290例男病人。根据病人第一次就诊时是否有痛风石分为无痛风石组(对照组)和有痛风石组(观察组)。本研究方案经青岛大学附属医院伦理审查委员会批准,所有病人均提供书面同意。
1.2研究方法
1.2.1病史采集和实验室检测对两组病人的一般资料及人口学信息进行采集,包括身高、体质量、吸烟及饮酒史等,并计算体质量指数(BMI)。采集病人空腹静脉血,采用全自动生化分析仪检测三酰甘油、总胆固醇、血糖、肌酐、尿酸、谷丙转氨酶、谷草转氨酶等指标。
1.2.2诊断标准和分組依据所纳入病人均符合《2015年美国风湿病学会、欧洲抗风湿联盟(ACR/EULAR)痛风诊断标准》[5],参照该标准将所有病人分为有痛风石组(观察组,588例)和无痛风石组(对照组,1 702例)。同时,按照相关标准分为如下亚组。根据《1999年世界卫生组织/国际高血压学会治疗指南》[6],分为高血压组(928例)和非高血压组(1 362例);根据《中国2型糖尿病防治指南(2020年版)》[7],以空腹血糖<6.1 mmol/L为血糖正常组(1 876例),6.1 mmol/L≤空腹血糖<7.0 mmol/L为高糖血症组(293例),空腹血糖≥7.0 mmol/L为糖尿病组(121例);根据《中国成人超重和肥胖症预防与控制指南》[8],以BMI<24 kg/m2为正常组(419例),24 kg/m2≤BMI<28 kg/m2为超重组(1 024例),BMI≥28 kg/m2 为肥胖组(847例);根据慢性肾脏疾病(CKD)分期标准[9],以肾小球滤过率(eGFR)<60 mL/(min·1.73 m2)为肾功能中重度受损组(49例),60≤eGFR<90 mL/(min·1.73 m2)为肾功能轻度受损组(917例),eGFR≥90 mL/(min·1.73 m2)为肾功能正常组(1 324例);根据《中国成人血脂异常防治指南(2016年修订版)》[10],以三酰甘油≥1.7 mmo/L为高三酰甘油血症组(1 156例),而<1.7 mmo/L为非高三酰甘油血症组(1 134例),以胆固醇≥5.2 mmol/L为高胆固醇血症组(807例),而<5.2 mmol/L为非高胆固醇血症组(1 483例)。
1.3统计学处理
采用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料采用[AKx-D]±s表示,两组间均数比较采用两独立样本t检验;不符合正态分布的计量资料采用中位数(四分位数间距)表示,两组间比较采用Mann-Whitney U检验。计数资料采用频数(百分数)表示,组间比较采用卡方检验。采用Logistic回归分析痛风病人合并痛风石的相关因素。以P<0.05为差异有统计学意义。
2结果
2.1两组病人基线资料相关指标比较
观察组病人的年龄、收缩压、舒张压、血肌酐、尿素氮、总胆固醇、空腹血糖、血尿酸和病程等均大于对照组,差异均有显著意义(t=-7.836~-3.844,Z=-13.146,P<0.05);eGFR小于对照组,差异有统计学意义(t=7.489,P<0.05)。而两组病人的BMI、三酰甘油、吸烟饮酒史等比较,差异无统计学意义(P>0.05)。见表1。
2.2两组病人合并代谢性疾病的比较
观察组病人合并高血压、高胆固醇血症、糖尿病/高糖血症所占比均高于对照组,差异有统计学意义(χ2=4.760~31.565,P<0.05);而肾功能轻度/中重度受损所占比均低于对照组,差异具有统计学意义(χ2=59.478,P<0.05)。两组病人超重/肥胖和高三酰甘油血症的构成比比较,差异均无统计学意义(P>0.05)。见表2。
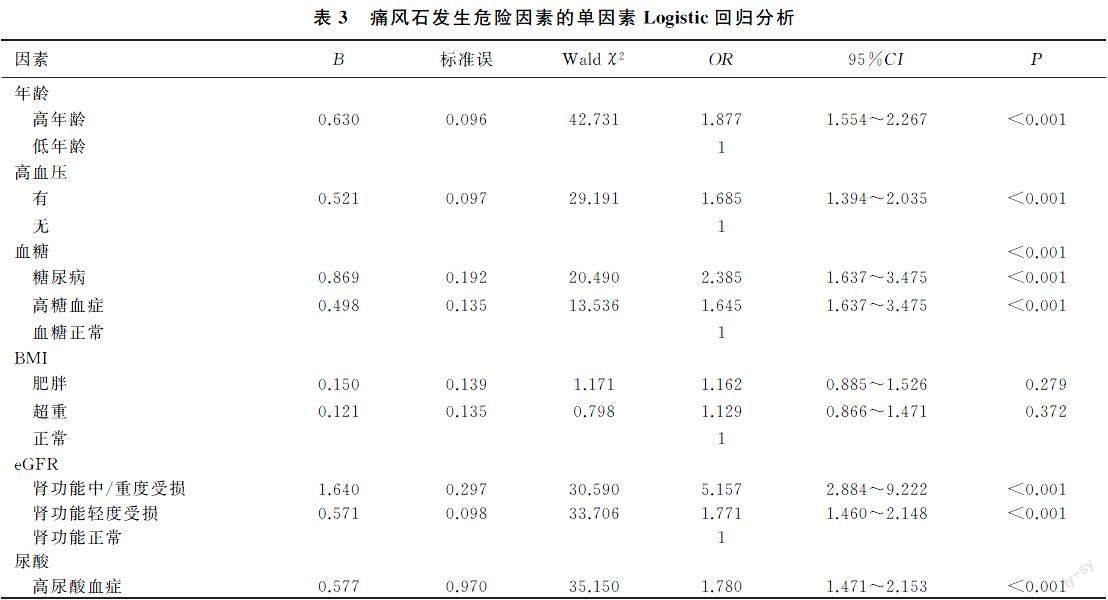
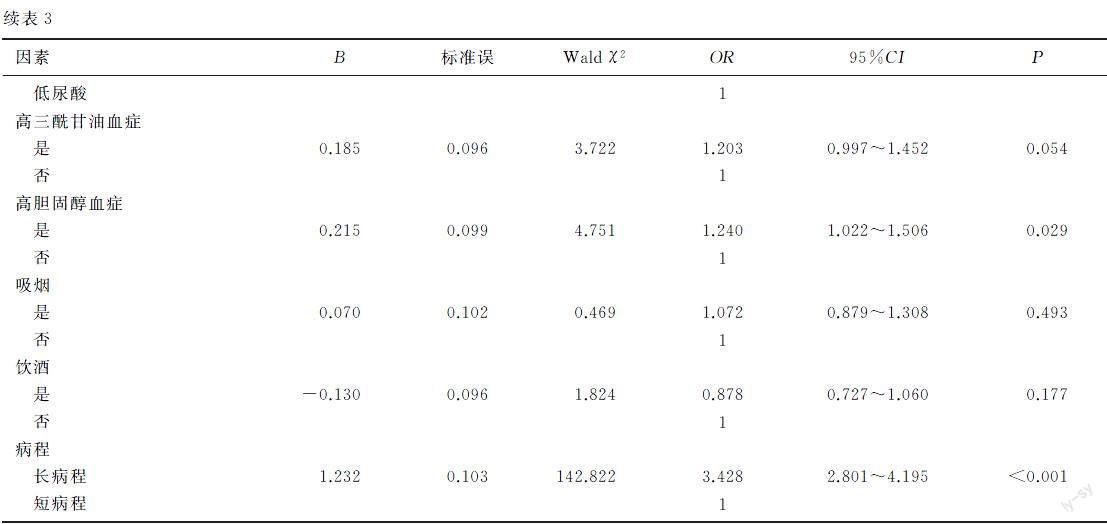
2.3痛风石发生危险因素的Logistic回归分析
将年龄、血尿酸、病程以中位数分为两组,以是否有痛风石为因变量,分别以年龄、高血压、空腹血糖、BMI、eGFR、尿酸、高三酰甘油血症、高胆固醇血症、吸烟、饮酒和病程等因素为自变量,进行单因素Logistic回归分析,结果显示,年龄、高血压、空腹高糖血症及糖尿病、高尿酸血症、高胆固醇血症、长病程、肾功能轻度及中/重度受损等是痛风石发生的危险因素(P<0.05)。见表3。将单因素Logistic回归分析中P<0.1的变量及临床中认为影响血尿酸水平的BMI分组作为自变量,采用进入法进行多因素Logistic回归分析,结果显示,年龄、高血压、空腹血糖、eGFR、尿酸、病程等因素是痛风石发生的危险因素(P<0.05)。其中:高年龄组比低年龄组出现痛风石的风险增加50.0%(OR=1.500,95%CI=1.188~1.893);高血压组增加60.7%(OR=1.607,95%CI=1.306~1.977);高尿酸血症组增加62.7%(OR=1.627,95%CI=1.300~2.035);病程长组增加186.5%(OR=2.865,95%CI=2.305~3.561);高糖血症组增加60.4%(OR=1.604,95%CI=1.198~2.146),糖尿病组增加129.3%(OR=2.293,95%CI=1.502~3.501);肾功能中/重度受损组增加147.9%(OR=2.479,95%CI=1.300~4.730),肾功能轻度受损组增加27.2%(OR=1.272,95%CI=1.022~1.585)。见表4。
3讨论
在痛风病人中,有部分病人随着病程进展可形成痛风石。近年来的流行病学研究显示,痛风患病率呈上升趋势[11-13],2000—2014年中国痛风患病率上升至1.1%[14]。
[JP2]痛风石为一种慢性肉芽肿性病变,其中心是MSU晶体,周围分布着单核和多核巨噬细胞,外层由致密的结缔组织包裹。组成痛风石的蛋白质成分包括与适应性免疫相关的蛋白质,如免疫球蛋白和补体因子、炎症蛋白、结缔组织和基质蛋白、载脂蛋白和组蛋白等[15]。痛风石不仅使人体罹患部位外观畸形、关节受破坏及活动受限,而且给病人心理健康造成严重的影响,从而影响其正常的工作和生活[16]。痛风石形成的相关因素主要包括尿酸盐溶液中各离子浓度、环境温度、尿酸盐溶液酸碱度、结缔组织因子与蛋白质、中性粒细胞胞外网状陷阱等[15]。目前,关于痛风石发生的危险因素研究较少,还不是很明确,因此本研究对痛风石病人的临床特征及其发生的危险因素进行探讨。
本文研究结果显示,与无痛风石病人比较,痛风石病人的年龄、收缩压、舒张压、eGFR、尿素氮、总胆固醇、血尿酸、空腹血糖、病程等指标均存在统计学差异。有痛风石病人的年龄更大,收缩压和舒张压更高,eGFR更低,尿素氮水平更高,总胆固醇、血尿酸、空腹血糖水平更高,病程更长。LU等[16]研究表明,eGFR和病程是与痛风石罹患关节数量独立相关的主要因素。通过单因素分析,尽管年龄、高血压和高脂血症等其他因素在是否罹患痛风石的病人之间存在显著差异,并且年龄与患有痛风石的关节数量相关,当eGFR和病程被纳入回归模型时,这些因素与痛风石罹患关节数量没有独立的相关性。MA等[17]研究表明,痛风石组的收缩压、舒张压、血尿酸、肌酐、病程和受累关节数量等显著高于非痛风石组;而痛风石组的发病年龄和肌酐清除率则显著低于非痛风石组;但两组之间的空腹血糖、血清三酰甘油或胆固醇水平没有显著差异。这与本文的研究结论基本一致。
本文研究结果也显示,有痛风石病人合并高血压、高糖血症、肾功能不全和高胆固醇血症等的比例更高。目前的研究也表明,罹患痛风石与肾功能的进行性下降相關[18]。过量的尿酸盐结晶会加重肾脏负荷,导致肾功能受损,而慢性肾脏病本身又是痛风石的危险因素[18-19]。
本文对有无痛风石病人的性别、年龄、收缩压、舒张压、空腹血糖、BMI、eGFR、血尿酸、三酰甘油、胆固醇、吸烟、饮酒、病程等因素进行单因素及多因素Logistic回归分析显示,年龄、高血压、高糖血症及糖尿病、高尿酸血症、高胆固醇血症、病程长、肾功能轻度及中/重度受损等因素是痛风石发生的危险因素。因此,对以上因素进行积极控制,或可以避免痛风石发生。此外,与痛风石发生相关的因素还有很多。如有研究结果显示,痛风石的形成与次黄嘌呤磷酸核糖转移酶、[STBX]SLC2A9和TGF-β1等基因有关,提示痛风石的形成可能与遗传有关[20-22]。还有性别、免疫细胞及炎症因子、生活方式、药物等因素也与痛风石的发生有关[23-25]。如有研究结果显示,3个月内每周至少摄入15 mg强的松与病人痛风石的形成有关,在存在高血压、肾功能损害和血清肌酐水平升高的情况下,使用类固醇会混淆每个因素带来的个体风险[26]。
痛风作为一种代谢性疾病,其发生与多种因素相关,痛风治疗的主要目标是将血尿酸浓度控制在目标水平,减少痛风发作频次,避免痛风石以及其他并发症的发生[27-28]。本文比较了是否罹患痛风石病人临床特征的差异,提示应重点关注病人的血压、空腹血糖、肾功能、血尿酸和血脂水平等因素[29-31]。痛风石的形成是一个复杂的过程,与多种因素相关。痛风石的形成可严重影响病人的工作、生活质量甚至寿命[32]。其中,血尿酸水平是痛风石形成的重要因素,血尿酸水平控制达标后,痛风石发生、痛风急性复发等事件将大大减少[33-34]。对于已经出现痛风石的病人应积极进行治疗,尽可能减少痛风石对病人外观、活动及生活的影响,避免致畸致残的结果。对于尚未出现痛风石的病人,应努力控制相关危险因素,进行饮食、运动等生活方式指导,做好病人健康教育,提高病人依从性,定期随访,尽早进行干预,避免或延缓痛风石出现,尽可能避免痛风石的发生及对病人的影响。
[参考文献]
[1]KUO C F, GRAINGE M J, ZHANG W Y, et al. Global epidemiology of gout: prevalence, incidence and risk factors[J]. Nature Reviews Rheumatology, 2015,11(11):649-662.
[2]LIU R, HAN C, WU D, et al. Prevalence of hyperuricemia and gout in mainland China from 2000 to 2014: a systematic review and meta-analysis[J]. BioMed Research International, 2015, 2015:762820.
[3]汪群力,牛成,陈奇. 关节周围慢性痛风石的结构及成分分析[J]. 局解手术学杂志, 2019,28(1):6-9.
[4]马利丹,李鑫德,辛颖,等. 痛风石形成相关危险因素研究进展[J]. 中华全科医师杂志, 2020,19(6):554-557.
[5]张冰清,盛峰,谷俊杰,等. 《2015年美国风湿病学会/欧洲抗风湿联盟痛风分类标准》摘译[J]. 中华临床免疫和变态反应杂志, 2015,9(4):333-336.
[6]林金秀,吴可贵. 1999年世界卫生组织/国际高血压联盟关于高血压治疗指南[J]. 高血压杂志, 1999,7(2):97-100.
[7]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年[J]. 国际内分泌代谢杂志, 2021,41(5):482-548.
[8]中国肥胖问题工作组. 中国成人超重和肥胖症预防与控制指南(节录)[J]. 营养学报, 2004,26(1):1-4.
[9]NATIONAL KIDNEY FOUNDATION. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification[J]. American Journal of Kidney Diseases: the Official Journal of the National Kidney Foundation, 2002,39(2 Suppl 1):S1-S266.
[10][诸骏仁,高润霖,赵水平,等. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016,31(10):937-953.
[11]STAMP L K, WELLS J E, PITAMA S, et al. Hyperuricaemia and gout in New Zealand rural and urban Mori and non-Mori communities[J]. Internal Medicine Journal, 2013,43(6):678-684.
[12]YAMANAKA H. Gout and hyperuricemia in young people[J]. Current Opinion in Rheumatology, 2011,23(2):156-160.
[13]BURSILL D, TAYLOR W J, TERKELTAUB R, et al. Gout, Hyperuricaemia and Crystal-Associated Disease Network (G-CAN) consensus statement regarding labels and definitions of disease states of gout[J]. Annals of the Rheumatic Diseases, 2019,78(11):1592-1600.
[14]GAO Q H, CHENG X Y, MERRIMAN T R, et al. Trends in the manifestations of 9754 gout patients in a Chinese clinical center: a 10-year observational study[J]. Joint Bone Spine, 2021,88(6):105078.
[15]李青,易婷,青玉鳳. 慢性痛风石发生机制研究进展[J]. 中国临床医学, 2018,25(6):1016-1019.
[16]LU B L, LU Q, HUANG B J, et al. Risk factors of ultrasound-detected tophi in patients with gout[J]. Clinical Rheumatology, 2020,39(6):1953-1960.
[17]MA L D, SUN R X, JIA Z T, et al. Clinical characteristics associated with subcutaneous tophi formation in Chinese gout patients: a retrospective study[J]. Clinical Rheumatology, 2018,37(5):1359-1365.
[18]OH Y J, MOON K W. Presence of tophi is associated with a rapid decline in the renal function in patients with gout[J]. Scientific Reports, 2021,11:5684.
[19]LI C C, CHIEN T M, WU W J, et al. Uric acid stones increase the risk of chronic kidney disease[J]. Urolithiasis, 2018,46(6):543-547.
[20]LAHAYE C, AUG F, SOUBRIER M, et al. New mutation affecting hypoxanthine phosphoribosyltransferase responsible for severe tophaceous gout[J]. The Journal of Rheumatology, 2014,41(6):1252-1254.
[21]HOLLIS-MOFFATT J E, GOW P J, HARRISON A A, et al. The SLC2A9 nonsynonymous Arg265His variant and gout: evidence for a population-specific effect on severity[J]. Arthritis Research & Therapy, 2011,13(3):R85.
[22]CHANG S J, CHEN C J, TSAI F C, et al. Associations between gout tophus and polymorphisms 869T/C and-509C/T in transforming growth factor 1 gene[J]. Rheumatology, 2008,47(5):617-621.
[23]FORBESS L J, FIELDS T R. The broad spectrum of urate crystal deposition: unusual presentations of gouty tophi[J]. Seminars in Arthritis and Rheumatism, 2012,42(2):146-154.
[24]DALBETH N, POOL B, GAMBLE G D, et al. Cellular cha-racterization of the gouty tophus: a quantitative analysis[J]. Arthritis and Rheumatism, 2010,62(5):1549-1556.
[25]JEE Y, JEON C, SULL J W, et al. Association between smoking and gout: a meta-analysis[J]. Clinical Rheumatology, 2018,37(7):1895-1902.
[26]RASO A A P, NIO O V S, LI-YU J L. Does prolonged systemic glucocorticoid use increase risk of tophus formation among gouty arthritis patients?[J]. International Journal of Rheumatic Diseases, 2009,12(3):243-249.
[27]GANCHEVA R N, KUNDURDJIEV A I, IVANOVA M G, et al. Ultrasonographic measurement of carotid artery resistive index and diastolic function of the heart in gout patients[J]. Rheumatology International, 2015,35(8):1369-1375.
[28]BORGHI C, ROSEI E A, BARDIN T, et al. Serum uric acid and the risk of cardiovascular and renal disease[J]. Journal of Hypertension, 2015,33(9):1729-1741,discussion1741.
[29]SINGH J A, REDDY S G, KUNDUKULAM J. Risk factors for gout and prevention: a systematic review of the literature[J]. Current Opinion in Rheumatology, 2011,23(2):192-202.
[30]PAN A, TENG G G, YUAN J M, et al. Bidirectional association between self-reported hypertension and gout: the Singapore Chinese health study[J]. PLoS One, 2015,10(10):e0141749.
[31]SUN C, QI X, TIAN Y, et al. Risk factors for the formation of double-contour sign and tophi in gout[J]. Journal of Orthopaedic Surgery and Research, 2019,14(1):239.
[32]馬利丹,程晓宇,吴秀英,等. 痛风患者易患皮下痛风石的相关危险因素分析[J]. 中华内分泌代谢杂志, 2017,33(6):497-501.
[33]DALBETH N, GOSLING A L, GAFFO A, et al. Gout[J]. The Lancet, 2021,397(10287):1843-1855.
[34]KUMAR M, MANLEY N, MIKULS T R. Gout flare burden, diagnosis, and management: navigating care in older patients with comorbidity[J]. Drugs & Aging, 2021,38(7):545-557.
(本文编辑于国艺)

