不同品种猪PBD-124基因多态性及差异表达研究
高倍瑶,刘艳光,贾 琪,柳俭强,罗新惠,张立春
(1.吉林农业大学动物科技学院,长春 130000;2.吉林省农业科学院动物生物技术研究所,公主岭 136100;3.延边大学农学院,延吉 130021)
抗菌肽(antimicrobial peptides,AMPs)又称宿主防御肽或抗微生物肽,是一类宿主经病原微生物诱导所分泌且能够对抗病原体的小分子多肽[1]。在过去的几十年里,AMPs因其对细菌、真菌及病毒具有独特的抗菌活性能有效降低细菌耐药性,具有生物相容性,具有成为新型治疗药物替代品的广阔发展前景[2-4]。AMPs的产生是宿主和病原在自然界长期协同进化的结果,动物体内的AMPs主要由吞噬细胞和黏膜上皮细胞产生,并通过蛋白质水解作用形成具有生物活性的成熟肽。成熟的AMPs具有广泛的抗病原体谱系[5],对自然界的革兰氏阳性菌、革兰氏阴性菌、真菌、寄生虫、病毒及肿瘤细胞的天然免疫都起着重要作用[6]。防御素是广泛分布于动物、植物、昆虫体内具有6个半胱氨酸残基和3个分子链间二硫键的阳离子内源性AMPs[7],在牛、马、羊、猪、鹿及骆驼等家畜体内广泛表达[8]。根据半胱氨酸残基之间的不同联系,哺乳动物防御素可分为α、β和θ 3种,从进化的角度来看,β-防御素是最古老的防御素[3]。在猪体内,仅发现了β-防御素[9]且表达极为广泛,Choi等[10]在猪的消化道、呼吸道、脾脏、淋巴结、脑、心脏、肝脏、肾脏、膀胱、睾丸、皮肤、肌肉、骨髓、外周血、嗜中性粒细胞、肺泡巨噬细胞以及脐带中均检测到猪β-防御素-1(porcine beta-defensin-1,PBD-1)mRNA表达。β-防御素因其在猪体内广泛表达和其对微生物的广谱抗性、调节先天免疫的能力,具有开发成为良好的外源性抗生素替代品的潜质[11],是目前研究最深入、广泛的一类防御素,目前已发现了29种PBD[10],但并未发现针对猪PBD-124基因的报道。鉴于此,本试验以大白猪、民猪和野杂猪3个群体为研究对象,采用RT-PCR方法扩增并克隆PBD-124基因;利用PCR-RFLP限制性核酸内切酶BlnⅠ对突变位点进行酶切,检测该基因的多态性;利用实时荧光定量PCR方法检测该基因在不同品种猪组织中的差异表达情况,以期为进一步探究PDB-124基因的生物学功能及免疫防御相关的候选基因提供参考依据。
1 材料与方法
1.1 样品采集
于吉林省白山市隆兴牧业有限公司兴降猪场选取野杂猪31头(民猪与野猪杂交猪,含75%长白山野猪血统);于吉林省农业科学院畜牧分院民猪保种场民猪34头;于四平红嘴集团梨树种猪场选取纯种大白猪31头,3个品种猪均为5~6月龄。采集3个品种96头猪血样,用抗凝血管收集,-20 ℃保存备用。屠宰后取肝脏和脾脏,用灭菌剪刀剪成小块,放入冻存管并做好标记,于液氮中保存备用。
1.2 主要试剂及仪器
Blood Genomic DNA提取试剂盒购自赛默飞世尔科技有限公司;Trizol购自Invitrogen公司;PrimeScript®RT MasterMix反转录试剂盒、大肠杆菌DH5α感受态细胞、2×ESTaqMasterMix 均购自北京康为世纪生物科技有限公司;Gel Extraction Kit胶回收试剂盒购自Omega公司。Light Cycler 480 SYBR Green Ⅰ Master和实时荧光定量PCR仪均购自罗氏公司;梯度PCR仪购自北京博辉生物科技有限公司。
1.3 引物设计与合成
根据GenBank中PBD-124基因mRNA预测序列(登录号:XM_013983105),利用Primer Premier 5.0软件设计引物扩增PBD-124基因CDS区;根据PBD-124基因突变位点,利用Beacon Designer 7.0软件设计PCR-RFLP酶切引物和实时荧光定量PCR引物,以猪HPRT1为内参基因,引物信息见表1。 引物均由苏州金唯智生物科技有限公司合成。

表1 引物信息
1.4 猪PBD-124基因克隆及测序
1.4.1 DNA、总RNA提取及cDNA合成 按照Blood Genomic DNA试剂盒说明书提取3个品种猪血液基因组DNA。采用Trizol法提取3个品种猪肝脏、脾脏和血液总RNA,采用Quawell-Q5000超微量分光光度计对纯度及浓度进行检测。参照PrimeScript®RT MasterMix反转录试剂盒使用说明进行cDNA合成,-20 ℃保存备用。
1.4.2 PCR扩增、克隆及测序分析 以3个品种猪cDNA为模板,扩增PBD-124基因CDS区。PCR反应体系20 μL:2×EsTaqMasterMix 10 μL,上、下游引物各0.5 μL,cDNA 0.5 μL,ddH2O补足体系。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,共34个循环;72 ℃延伸5 min;4 ℃保存。PCR扩增产物经1.5%琼脂糖凝胶电泳检测,参照Gel Extraction Kit胶回收试剂盒切胶回收,取回收产物与pMD18-T载体进行连接,连接体系10 μL:回收产物4.5 μL,pMD18-T载体0.5 μL,Solution 5 μL。16 ℃连接1 h。连接产物转化大肠杆菌DH5α感受态细胞,加入450 μL LB培养液(不含AMP+)置于37 ℃摇床220 r/min震荡培养45 min使菌体复苏,取200 μL复苏菌液用一次性涂布棒均匀涂在固体LB平板上(含AMP+),37 ℃倒置培养12~16 h,挑取单个菌落置于1 L液体LB(含AMP+)中37 ℃摇床220 r/min震荡培养10 h。取鉴定正确的阳性克隆产物送测,并对测序结果进行比对分析。
1.5 PCR-RFLP法检测猪PBD-124基因多态性
以3个品种猪所提取的DNA为模板,根据PCR-RFLP所设计的引物进行PBD-124基因扩增。PCR反应体系20 μL:2×EsTaqMasterMix 10 μL,上、下游引物各0.5 μL,DNA 0.5 μL,ddH2O补足体系。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸1 min,共34 个循环;72 ℃延伸5 min;4 ℃保存。PCR扩增产物经1.5%琼脂糖凝胶电泳检测。采用限制性内切酶BlnⅠ对猪PBD-124基因目的片段进行酶切,反应体系10 μL:BlnⅠ 0.5 μL,10×K Buffer 1 μL,PCR产物5 μL,ddH2O补足体系。37 ℃水浴4 h。酶切产物经2.0%琼脂糖凝胶电泳进行基因型检测。
1.6 遗传多样性分析
分析PBD-124基因不同基因型的基因频率和基因型频率,计算遗传纯合度(Ho)、遗传杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC),通过卡方检验分析基因型是否处于Hardy-Weinberg平衡状态。
1.7 实时荧光定量PCR检测不同品种猪不同组织中PBD-124基因的表达
采用实时荧光定量PCR检测PBD-124基因在大白猪、民猪和野杂猪的肝脏、脾脏和血液中的表达情况,并比较相同组织不同品种和相同品种不同组织间的差异表达。 PCR反应体系20 μL:cDNA 1 μL,上、下游引物各0.5 μL,2×SYBR Premix Dimer Eraser 10 μL,ddH2O补足体系。PCR扩增程序:95 ℃预变性5 min;95 ℃变性10 s,57 ℃退火15 s,72 ℃延伸35 s,共45 个循环;95 ℃变性5 s,60 ℃递增到97 ℃最后降到40 ℃保存。每组试验重复3次,采用2-△△Ct方法对数据进行分析。
1.8 数据分析
使用SPSS 19.0软件进行统计学分析,组间比较采取t检验,结果以平均值±标准误表示,以P<0.05为差异显著性判断标准。
2 结 果
2.1 PBD-124基因CDS区PCR扩增及测序
以野杂猪、民猪和大白猪的血液cDNA为模板,PCR产物片段大小约500 bp(图1),与预期相符。克隆测序发现,目的条带全长500 bp;BLASTN比对发现,该片段与PBD-124基因预测mRNA序列(登录号:XM_013983105)高度同源,其中,包含完整CDS序列423 bp,共编码140个氨基酸。序列比对发现,PBD-124基因存在2个突变位点:c.257 G>A和c.263 T>C,但均没有引起氨基酸的改变。因2个突变位点间隔过近,可能存在连锁,仅对第1个突变位点进行酶切分型。
2.2 PBD-124基因PCR-RFLP酶切分型
由图2可知,PBD-124基因产物片段大小约为700 bp,与预期一致,可用于下一步酶切。 由图3可知,猪PBD-124基因存在3种基因型:GG(700 bp)、GA(700/500/200 bp)和AA(500/200 bp),该基因CDS区第257 bp处存在突变c.257G>A,引起了BlnⅠ限制性核酸内切酶的存在与丢失。

M,DL2000 DNA Marker;D1、D2,大白猪PBD-124基因PCR扩增产物;M1、M2,民猪PBD-124基因PCR扩增产物;WI,野杂猪PBD-124基因PCR扩增产物M,DL2000 DNA Marker;D1 and D2,PCR amplification products of PBD-124 gene in Large White pigs;M1 and M2,PCR amplification products of PBD-124 gene in Min pigs;W1,PCR amplification products of PBD-124 gene in wild hybrid pigs图1 不同品种猪PBD-124基因PCR扩增电泳图Fig.1 Electrophoresis of PCR amplification of PBD-124 gene from different pig populations

M,DL2000 Plus DNA Marker;1~4,PBD-124基因PCR扩增产物M,DL2000 Plus DNA Marker;1-4,PCR amplification products of PBD-124 gene图2 猪PBD-124基因PCR扩增结果Fig.2 PCR amplification results of PBD-124 gene in pigs

M,DL2000 Plus DNA Marker;1、9、11、12、16、18-24,AA基因型;3、4、13,GG基因型;2、5~8、10、14、15、17,AG基因型M,DL2000 Plus DNA Marker;1,9,11,12,16 and 18-24,AA genotype;3,4 and 13,GG genotype;2,5-8,10,14 ,15 and 17,AG genotype图3 PBD-124基因Bln Ⅰ酶切结果Fig.3 Results of PBD-124 gene digested with Bln Ⅰ
2.3 遗传多样性分析
对96头猪做PCR-RFLP酶切,统计分析各个品种猪的基因型频率和等位基因频率,结果见表2。由表2可知,大白猪群体中检测出AA、AG和GG 3种基因型,基因型频率分别为0.5161、0.3256和0.1613;而民猪和野杂猪群体中仅检测出AA和AG 2种基因型,基因型频率分别为0.9412、0.6542和0.0588、0.3548。3个品种中优势等位基因均为A,该位点均符合Hardy-Weinberg平衡(P>0.05)。3个群体中AA、AG和GG的总基因型频率分别为0.698、 0.400和0.520,经卡方检验计算,按自由度=2,查表得知该位点在总群体中符合Hardy-Weinberg平衡(P>0.05),达到了遗传平衡。
由表3可知,在3个品种中大白猪的遗传杂合度、有效等位基因数及多态信息含量均高于民猪和野杂猪,处于中度多态(0.25 表2 PBD-124基因Bln Ⅰ酶切位点的基因型频率和基因频率 表3 猪PBD-124基因的遗传多样性指标 由表4可知,PBD-124基因在大白猪血液中的表达量显著高于肝脏和脾脏(P<0.05),肝脏中的表达量略高于脾脏,但差异不显著(P>0.05);在民猪和野杂猪不同组织间PBD-124基因表达量均存在显著差异(P<0.05)。PBD-124基因在民猪脾脏中的表达量显著高于大白猪和野杂猪(P<0.05),野杂猪的表达量略高于大白猪,但差异不显著(P>0.05);在3个品种猪肝脏中的表达量存在显著差异(P<0.05);在大白猪血液中的表达量显著高于民猪和野杂猪(P<0.05),在民猪中的表达量高于野杂猪,但差异不显著(P>0.05)。 表4 PBD-124基因在3个品种猪各组织中的相对表达量 研究表明,AMPs作为机体抵御外源微生物的第一道防线,广泛分布于细菌、真菌、植物、昆虫、两栖类及脊椎动物中[12]。防御素家族作为一类重要的AMPs,在哺乳动物中最为丰富,研究也较为透彻,其中β-防御素分布最广,在所有脊椎动物中均有发现,α-防御素则存在于大部分哺乳动物中,而θ-防御素只存在于灵长类动物中。目前,在人基因组中已发现6种α-防御素和39种β-防御素[8];在牛和猪基因组中发现了至少57和31个编码β-防御素的基因[9];在鸡基因组中含有14种β-防御素,未发现α-防御素基因,说明不同物种防御素基因在天然免疫系统构建中的作用不尽相同。本试验通过RT-PCR方法成功获得猪PBD-124基因CDS序列,并证实不同遗传背景群体不同组织中该基因表达量存在差异,为进一步研究其功能及在猪抗病表型中的作用奠定基础。 目前,在猪基因组中所预测的β-防御素基因家族成员众多,仅有少部分基因结构功能得到验证。本实验室前期参照GenBank数据库中预测序列设计扩增引物,尝试从外周血、肝脏和脾脏组织中检测β-防御素基因表达,结果显示,只有包括PBD-124基因在内的防御素基因表达,证实β-防御素家族基因存在组织器官表达特异性(未发表)。哺乳动物中β-防御素基因高度保守,目前鲜有在基因编码区检测到SNP位点的报道。本试验在PBD-124基因CDS区发现2个SNPs位点,尽管未引起氨基酸位点改变,但其在不同品种群体中存在不同频率的遗传多样性,且遵循Hardy-Weinberg平衡定律,说明该SNP位点并未受到较强的选择压力。研究表明,机体受到多种病原感染或病理条件下可激活防御素基因表达。本试验中,3个品种猪的脾脏、肝脏和血液中均有PBD-124基因的表达且表达量各不相同,提示其可能参与黏膜和全身免疫构建[13]。血常规和抗体滴度检测证实野杂猪、民猪较大白猪具有更强的抵抗能力[14-15],3个群体猪PBD-124基因表达模式存在一定差异,可能是3个群体猪所处外界环境不同所引起的,或者主要由于遗传差异所决定,仍有待于进一步研究。 尽管β-防御素存在结构功能的高度保守性,但越来越多的研究证实,β-防御素存在抗菌[16]、抗寄生虫[17]、抗病毒、抗炎[18]及调节免疫等多种功能,因其抗菌的广谱性和低耐药性,使其成为具有潜在应用价值的抗生素替代品[19]。挖掘出包括β-防御素在内的具有广谱高效抗菌活性的AMPs类物质,对提高猪群健康水平具有重要的意义,也是未来重要的研究方向。研究表明,不同品种猪自身免疫与抗菌能力也有所差异。本试验中,脾脏、肝脏和血液中PBD-124基因表达趋势在3个品种猪中各不相同,这与刘艳光等[20-21]研究结果相似,但具体原因尚不明确。在民猪和野杂猪免疫器官脾脏和肝脏中PBD-124基因的表达量多于大白猪,这可能与民猪和野杂猪比大白猪具有更强的抗逆能力有关。本试验进一步证实了防御素广泛分布在哺乳动物全身的各个器官组织中[8],对于抵抗外界病原体、调节自身免疫、促进生长发育有一定功能[22]。抗生素的大量使用加剧了潜在的全球公共卫生危机[23]。为了减少抗菌素耐药性的出现,需采取措施减少动物生产中抗生素的使用。AMPs存在于各种生命形式中,并在先天免疫系统中起关键作用,由于其抵抗病原体和微生物的能力,已被开发为维持肠道健康和减少抗生素使用的新战略[24]。本试验结果可为研究PBD-124基因在猪β-防御素先天免疫系统中的作用,以及为进一步完善AMPs作为抗生素替代品的抗菌、抗病毒作用提供参考。 本试验成功克隆猪PBD-124基因CDS区,发现c.257 G>A和c.263 T>G 2个突变位点,因2个突变位点间隔过近,可能存在连锁,仅对第1个突变位点进行酶切;PCR-RFLP酶切发现大白猪中存在GG、GA、AA 3种基因型,而民猪和野杂猪仅检测到GA和AA 2种基因型;3个品种猪的脾脏、肝脏和血液中均有PBD-124基因的表达且存在表达差异,提示该基因可能参与机体先天免疫功能的构建。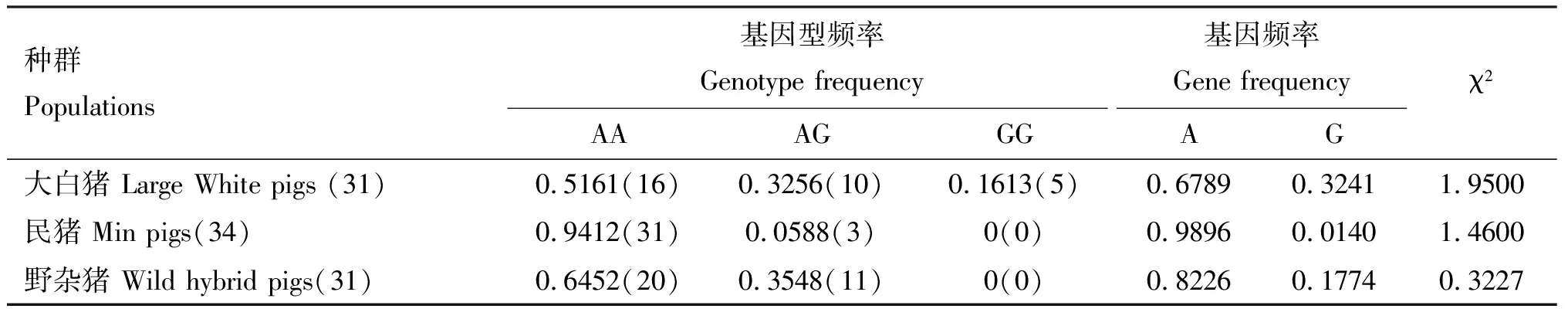

2.4 PBD-124基因在不同品种猪不同组织中的相对表达量

3 讨 论
4 结 论

