基于PINK1/Parkin信号通路研究MEHP对小鼠睾丸间质细胞线粒体自噬的影响
宋贝贝,李 玲,2,3,德小明,2,3,李丽萍,2,3,黄金瑞,郭晓英,马慧颖
(1.宁夏医科大学公共卫生与管理学院职业卫生与环境卫生学系,银川 750004;2.宁夏环境因素与慢性病控制重点实验室,银川 750004;3.生育力保持教育部重点实验室,银川 750004)
作为环境内分泌干扰物的一种,邻苯二甲酸酯类(phthalates,PAEs)物质因其延展性强、耐高温的特点被广泛用于玩具、医疗材料、装饰材料、化妆品甚至食品包装中[1]。目前研究发现应用最广泛的为邻苯二甲酸二(2-乙基己基)酯(DEHP),其可通过消化道、皮肤等方式进入人体[2],DEHP主要的代谢产物为邻苯二甲酸单(2-乙基己基)酯(MEHP),代谢产物MEHP比其原形毒性更强,在人体蓄积时间更久,对人体危害作用更大[3]。
线粒体过度损伤将会导致细胞内环境稳态的破坏、腺嘌呤核苷三磷酸(ATP)水平降低和反应性改变[4]。线粒体去极化是线粒体损伤后膜电位的一种变化趋势,同时也是线粒体自噬过程中的一种早期现象[5-6]。细胞在氧化应激、营养缺乏以及细胞凋亡等因素影响下,会引起线粒体的功能改变[7]。
关于线粒体自噬的分子调节机制目前引起了普遍重视,由同源性磷酸酶张力蛋白诱导激酶1(PINK1)/帕金森蛋白(Parkin)途径介导的线粒体自噬是目前研究发现最广泛的,也是其经典途径之一[8]。PINK1蛋白稳定存在于线粒体外膜上,并被细胞内的蛋白酶所降解,在细胞内呈低水平表达。当线粒体受损,蛋白酶活性降低,使线粒体外膜上的PINK1蛋白水解过程受阻[9],存在于胞浆中的Parkin被PINK1蛋白不断募集至线粒体外膜上并被磷酸化为P-Parkin[10]。抗增殖蛋白2(PHB2)已经被确定了是PINK1/Parkin介导的线粒体自噬不可缺少的受体蛋白,它也被认为是线粒体自噬的一种标志蛋白[11]。
课题组前期实验结果表明,MEHP可干扰小鼠睾丸间质(TM-3)细胞线粒体功能[12],但其对线粒体自噬的作用机制尚不清楚。因此本研究拟从PINK1/Parkin途径探讨MEHP对TM-3细胞线粒体自噬水平的影响,并通过自噬抑制剂3-3-甲基腺嘌呤(3-MA)进行验证。
1 材料与方法
1.1 细胞株来源
TM-3细胞(ATCC细胞研究中心,美国)。
1.2 主要仪器
SW-CJ-1CU超净工作台(苏州安泰空气技术有限公司,中国),低温高速离心机(Thermo Fisher Scientific公司,美国),CKX41倒置相差显微镜(Olympus公司,日本),HF90 CO2培养箱(上海力申科学仪器有限公司,中国),成像系统(Azure Biosystems公司,美国),VICTOR Nivo酶标仪(PerkinElmer公司,美国)。
1.3 主要试剂
MEHP标准品(纯度为99%,Sigma公司,美国),3-MA(Sigma公司,美国),胎牛血清、DMEM培养基、二甲基亚砜(DMSO)、青链霉素混合液(Gibco公司,美国)、胰酶(北京索莱宝科技有限公司,中国),CCK-8细胞增殖检测试剂盒(上海贝博生物科技有限公司,中国),ATP检测试剂盒、JC-1线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司,中国),全蛋白提取试剂盒、BCA蛋白检测试剂盒、SDS-PAGE凝胶电泳试剂盒、ECL检测试剂盒(江苏凯基生物技术股份有限公司,中国),PHB2、PINK1、Parkin、P-Parkin、β-actin抗体(Proteintech公司,美国),其他试剂为国产分析纯。
1.4 TM-3细胞复苏、传代、培养及分组
将冻存的TM-3细胞从-80℃冰箱中取出,离心,弃去冻存液,加入4 mL新鲜配制的完全培养基,混匀后接种于培养瓶中。5%CO2培养箱中恒温37℃培养24 h后更换培养液。取对数生长期的TM-3细胞,确立对照组(完全培养基)、MEHP低、中、高剂量组(200、400、800μmol·L-1,剂量均按本课题组前期研究结果设置[12])和抑制剂组(400μmol·L-1MEHP+1.0 mmol·L-13-MA),继续培养24 h后进行相关检测。
1.5 CCK-8法检测TM-3细胞活性
取对数生长期的TM-3细胞,胰酶消化后配成细胞混悬液(细胞数约2×105个/mL),每孔100μL加入96孔板,置于37℃、5%CO2细胞培养箱中培养,待细胞贴壁后弃去培养基并加入0、0.25、0.5、1.0、1.25、1.5 mmol·L-16个 浓 度梯度的3-MA。设置对照组、MEHP中剂量组和抑制剂组,培养箱中孵育24 h。各孔中加入10μL的CCK-8检测液,孵育1~2 h后,酶标仪450 nm波长下检测各孔光密度(OD)值并计算细胞活力(%)=[(染毒组OD-空白组OD)/(对照组OD-空白组OD)]×100%。
1.6 化学发光法检测TM-3细胞ATP水平
取TM-3细胞混悬液(细胞数约2×105个/mL)接种于6孔板,培养至细胞贴壁,弃去培养基,设置对照组,MEHP低、中、高剂量组和抑制剂组。培养24 h后用事先冷藏的PBS洗1次,随后裂解细胞。将细胞收集到1.5 mL的离心管中,4℃离心(12 000 r·min-1)5 min。ATP标准溶液稀释为浓度梯度为0.01、0.03、0.1、0.3、1、3和10μmol·L-1。配制适量的ATP检测工作液于冰上保存。每个检测管中先加入100μL ATP检测工作液,并于室温条件下放置3~5 min,减少背景值。将20μL样品或标准品添加到检测管中,间隔2 s后用化学发光仪测量相对光单位(relative light unit,RLU)值。根据标准曲线计算待测样品中ATP的浓度。
1.7 荧光探针JC-1法检测TM-3细胞线粒体膜电位水平
将处于对数增殖期的TM-3细胞以2×105个/mL的密度接种于6孔板中,孵育24 h后,设置对照组、MEHP低、中、高剂量组和抑制剂组,细胞培养24 h。每孔细胞培养液和JC-1染色工作液各1 mL,混合均匀,孵育20 min。孵育期间,按照JC-1染色缓冲液(5×)和蒸馏水1∶4的比例,准备适量的JC-1染色缓冲液(1×),冰浴。37℃孵育结束后,弃上清,裂解细胞并收集,4℃,600×g,离心3 min,沉淀细胞,弃上清。用1×JC-1染色缓冲液洗2次,加入1 mL的1×JC-1染色缓冲液重悬细胞,600×g,4℃,离心3~4 min,沉淀细胞,弃上清。重复2次后用适量1×JC-1染色缓冲液使细胞重新悬浮。酶标仪激发光设置为490 nm,发射光设置为530 nm检测JC-1单体;激发光波长设置为525 nm,发射光波长设置为590 nm,检测JC-1聚合物。
1.8 Western blot检测TM-3细胞PHB2、PINK1、Parkin、P-Parkin蛋白表达水平
将处于对数增值期的TM-3细胞,以2×105个/mL的密度接种于100 mm培养皿,细胞贴壁后分别设置对照组、MEHP低、中、高剂量组和抑制剂组,细胞培养24 h。弃去各组培养基,用事先预冷的PBS洗2次,裂解细胞,将细胞收集至1.5 mL的离心管中,振荡30 s后在冰上放置4 min,重复操作5次后离心(4℃,12 000 r·min-1)5 min,得上清为全蛋白。测定蛋白浓度并对蛋白进行变性处理。配胶、上样、电泳、转膜、封闭2 h后加入一抗4℃冰箱过夜。二抗室温孵育1 h后曝光。采用Image J软件分析目的条带的灰度值。
1.9 统计学方法
数据采用SPSS 23.0统计学软件进行分析。每项实验均重复3次以上,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较用LSD-t法。P≤0.05为差异有统计学意义。
2 结果
2.1 3-MA抑制剂对TM-3细胞活性的影响
预实验设置3-MA为0、0.25、0.5、1.0、1.25、1.5 mmol·L-16个浓度梯度,干预24 h后测定OD值。CCK-8结果显示:TM-3细胞存活率呈现先上升后下降的趋势,与对照组相比,1 mmol·L-13-MA处理TM-3细胞24 h后细胞存活率为(99.56±2.51)%(P>0.05),见表1。确定后续3-MA抑制剂干预剂量为1 mmol·L-1。进一步检测各处理组对于细胞活性的影响,结果表明:与对照组相比,MEHP中剂量组细胞存活率降低(P<0.01);与MEHP中剂量组相比,抑制剂组细胞存活率降低(P<0.05),3组结果表现为:抑制剂组细胞存活率<MEHP染毒组细胞存活率<对照组,见表2。
表1 3-MA对TM-3细胞存活率的影响(±s)

表1 3-MA对TM-3细胞存活率的影响(±s)
与对照组比较*P<0.05,**P<0.01。
3-MA浓度/(mmol·L-1)0 0.25 0.5 1.0 1.25 1.5 n 3 3 3 3 3 3细胞存活率/%100.00±0.00 116.70±4.16**106.28±2.32*99.56±2.51 81.96±3.21**71.35±2.08**
表2 CCK-8法检测TM-3细胞存活率的变化(±s)
表2 CCK-8法检测TM-3细胞存活率的变化(±s)
与对照组比较*P<0.05,**P<0.01;与中剂量组比较#P<0.05。
组别对照组中剂量组抑制剂组n 3 3 3细胞存活率/%100.00±0.00 47.68±3.16**39.56±2.51*#
2.2 MEHP染毒对TM-3细胞ATP水平的影响
与对照组相比,MEHP各染毒组均可引起TM-3细胞ATP水平下降(P均<0.05);与低剂量组相比,高剂量组TM-3的ATP水平下降(P<0.05);与中剂量组相比,高剂量组、抑制剂组TM-3的ATP水平均降低(P均<0.05),见表3。
表3 不同浓度MEHP染毒对TM-3细胞ATP水平的影响(±s)

表3 不同浓度MEHP染毒对TM-3细胞ATP水平的影响(±s)
与对照组相比*P<0.05,**P<0.01;与低剂量组相比$P<0.05;与中剂量组相比#P<0.05。
组别对照组低剂量组中剂量组高剂量组抑制剂组F值P值n 3 3 3 3 3 ATP相对水平/(nmol·g-1)9.01±0.58 7.53±1.30*7.44±0.21*6.74±0.41**$#5.83±0.26*#28.96<0.05
2.3 MEHP染毒对TM-3细胞线粒体膜电位水平的影响
与对照组比较,中、高剂量组TM-3细胞线粒体膜电位均下降(P均<0.05),随着染毒浓度的增加,线粒体膜电位呈下降趋势;与低剂量组相比,中、高剂量组TM-3细胞线粒体膜电位水平均下降(P均<0.05);与中剂量组相比,高剂量组、抑制剂组细胞线粒体膜电位水平均降低(P均<0.05),见表4。
表4 MEHP对TM-3细胞线粒体膜电位的影响(±s)

表4 MEHP对TM-3细胞线粒体膜电位的影响(±s)
与对照组相比*P<0.05;与低剂量组相比$P<0.05;与中剂量组相比#P<0.05。
组别对照组低剂量组中剂量组高剂量组n 3 3 3 3 JC-1红色荧光聚合物 JC-1绿色荧光单体 红色荧光聚合物/红色荧光单体100.00±3.68 100.00±4.21 100.00±2.68 96.43±5.02 97.66±6.47 98.76±4.38 75.42±2.72 113.16±3.28 63.28±5.65*$70.62±4.33 125.82±2.56 55.23±3.27*$#抑制剂组 3 F值 114.3 P值 <0.05 66.93±1.32 140.28±0.34 44.17±0.85*#
2.4 MEHP染毒后TM-3细胞内PHB2、PINK1、Parkin、P-Parkin蛋白表达水平变化
与对照组相比,MEHP各染毒组TM-3细胞PHB2、PINK1、P-Parkin蛋白表达水平均升高(P均<0.05);低剂量组Parkin蛋白的表达水平与对照组相比差异无统计学意义(P>0.05),中、高剂量组Parkin蛋白的表达水平均低于对照组(P均<0.05);与低剂量组相比,中、高剂量组TM-3细胞中PHB2、PINK1、P-Parkin蛋白相对表达水平均上升(P均<0.05),中、高剂量组TM-3细胞中Parkin蛋白相对表达水平均下降(P均<0.05);与中剂量组相比,高剂量组TM-3细胞中PHB2、PINK1、P-Parkin蛋白相对表达水平均上升(P均<0.05),高剂量组TM-3细胞中Parkin蛋白相对表达水平下降(P<0.05),见图1。

图1 不同MEHP染毒对TM-3细胞线粒体自噬相关蛋白的影响
抑制剂组PHB2、PINK1、P-Parkin蛋白的相对表达水平均低于中剂量组(P均<0.05),Parkin蛋白的表达水平高于中剂量组(P<0.05),见图2。
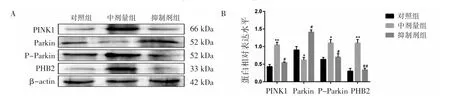
图2 不同处理组对TM-3细胞线粒体自噬相关蛋白的影响
3 讨论
DEHP为塑胶制品常用的一种塑化剂,无色、无味,因可作为食品包装、化妆品以及玩具的原料,在日常生活中随处可见,被列为人类潜在致癌物[13]。DEHP在肠道中经过水解酶的作用后大部分代谢为毒性更强、作用更久的MEHP[14]。有机物被细胞摄入后,其中储存的能量转换为ATP。因此,线粒体结构和功能受损后,最先受影响的是细胞的能量供应系统,进而继发一系列供能不足的反应。线粒体自噬是维持线粒体内环境稳定的重要过程,其中研究最为广泛的是PINK1/Parkin通路介导的线粒体自噬,它由PTEN诱导的PINK1和Parkin调节。正常情况下,线粒体外膜上的PINK1蛋白会被迅速水解,从而在细胞内维持低表达水平。但线粒体受损时,线粒体膜电位降低,PINK1蛋白不会被水解,会稳定地聚集于线粒体外膜上。其进一步招募Parkin蛋白转位到受损线粒体的外膜上,激活Parkin的泛素化活性,线粒体外膜破损,继而暴露线粒体内膜蛋白PHB2,从而进一步激活PINK1/Parkin介导的线粒体自噬下游通路。线粒体外膜破裂后暴露出的PHB2是与吞噬泡上LC3蛋白结合的一个关键位点,PHB2的缺失将会导致吞噬泡不能识别受损线粒体,阻断线粒体自噬[15]。研究[16]发现,MEHP所致的雄性生殖毒性机制涉及多种病理学变化,包括线粒体损伤和自噬功能障碍等。
本研究结果显示,与对照组相比,随着染毒剂量增加,细胞内ATP含量逐渐减少,中、高剂量组线粒体膜电位下降,提示MEHP染毒后TM-3细胞线粒体发生了损伤,线粒体ATP合成减少,膜电位下降。本课题组前期研究[12]表明,MEHP染毒可减少TM-3细胞睾酮的分泌,并引起线粒体损伤,与本研究结果相互验证。与中剂量组相比,加入自噬抑制剂后细胞内ATP水平和膜电位下降,提示MEHP染毒后诱导TM-3细胞发生了自噬,且自噬起保护作用。伊梦楠等[17]研究发现,MEHP可诱导自噬的发生,与本研究结果相互印证。Western blot结果显示,与对照组相比,MEHP染毒后TM-3细胞的PINK1、P-Parkin、PHB2表达水平升高,Parkin蛋白的表达水平降低,表明TM-3细胞中受损线粒体增多,PINK1无法进入线粒体内被降解清除,致使积聚于受损线粒体外膜上的PINK1通过募集游离于细胞质中的Parkin至线粒体外膜,从而启动TM-3细胞线粒体的自噬。高言[11]的研究显示,氟诱导TM-3细胞线粒体膜电位下降,PHB2、PINK1、P-Parkin蛋白表达量升高,上述发现与本研究结果相似。为了检测PINK1/Parkin途径介导的线粒体自噬在MEHP诱导TM-3细胞毒性中起何作用,利用自噬抑制剂3-MA,通过CCK-8法检测细胞增殖活性来判断3-MA对MEHP产生的细胞毒性并确定1.0 mmol·L-1的3-MA为后续实验浓度。从实验结果来看,3-MA干预后,MEHP对细胞活力的抑制作用增强,PINK1、PParkin、PHB2蛋白表达水平下降,Parkin蛋白的表达水平增高,提示加入3-MA抑制剂后,TM-3细胞线粒体自噬被抑制,MEHP产生的细胞毒性增大。
综上所述,MEHP可能通过激活PINK1/Parkin信号通路来诱导TM-3细胞线粒体的自噬,为阐明MEHP雄性生殖毒性的分子机制提供了科学的实验及理论依据。

