泊马度胺改善脑缺血小鼠神经功能的机制研究
王梦涵 张丽敏 杨贺城 王景涛 王建平 卢 宏郑州大学第一附属医院,河南 郑州 450052
脑卒中(cerebral stroke)分为出血性及缺血性,其中缺血性脑卒中(cerebral ischemic stroke)又称脑梗死(cerebral infraction),因具有高发病率、高致残率及高病死率的特点,使其跻身于中国致死病因的首位,据此,积极寻找有效治疗脑梗死方法或能改善这一现状[1]。当脑梗死事件发生后,多种细胞因子参与机体免疫反应,炎症介质的产生可以引起梗死区域神经元的损伤,而神经营养因子的产生也在神经元存活中起着关键作用[2]。脑梗死后的病理生理过程中,小胶质细胞(microglia,MG)与炎症反应密切相关[3],MG活化后促使炎症因子的表达上调,协同产生的氧自由基、基质金属蛋白酶等不仅导致缺血区域脑组织的损伤还能扩大脑梗死范围[4-5]。
泊马度胺是一种新型的免疫调节药物(immunomodulatory drug,IMiD),可下调单核细胞炎症因子的生成,而这一作用主要是通过增强天然杀伤(NK)细胞与T 淋巴细胞参与的免疫应答实现的[6]。在多发骨髓瘤(multiple myeloma,MM)的研究中泊马度胺被认为具有良好的抗炎作用[7]。关于泊马度胺对脑梗死的治疗未见报道,本研究拟通过MCAO 模型观察小鼠脑缺血后神经功能评分、细胞因子的表达、小胶质细胞的增生等,探讨泊马度胺在小鼠脑梗死后的神经保护作用及可能的作用机制。
1 材料和方法
1.1 实验动物分组清洁雄性C57/BL6 小鼠,体质量18~22 g。标准实验环境下实验动物自由进食水。实验动物按随机盲法的原则分组,分为Sham组、MCAO 组、Vehicle 组、Pom 组。每组15 只小鼠于造模成功后进行神经功能评分和免疫荧光染色。每组12 只造模成功3 d 后Western blotting 方法检测梗死侧脑组织炎症因子、营养因子的表达。
1.2 主要试剂兔抗BDNF、兔抗TNF-α、兔抗IL-1β、兔抗GDNF、过氧化物酶(HRP)标记的山羊抗兔IgG(上海生工);兔抗IBA1(日本Wako);羊抗兔FITC(美国Abcam)。
1.3 主要方法
1.3.1 造模及分组:实验动物术前禁食12 h,禁水4 h。10%水合氯醛(350 mg/kg)腹腔麻醉后采取仰卧位,颈正中切口分离右侧的颈动脉鞘,充分暴露颈内动脉(internal carotid artery,ICA)、颈外动脉(external carotid artery,ECA)和颈总动脉(common carotid artery,CCA)。对游离的颈总动脉进行结扎,同侧的颈内动脉暂时夹闭,线栓经离断的颈外动脉段插入,沿颈内动脉方向到达同侧大脑中动脉起始处,插入深度(8±2)mm~(10±2)mm。术毕固定插入的线栓,缝合创口,分笼饲养。手术过程中维持小鼠肛温约37 ℃,采取无菌操作的原则。Sham 组只暴露血管。MCAO 组、Vehicle 组、Pom 组暴露血管并插入线栓。Pom组及Vehicle组小鼠分别给予相同体积的泊马度胺(0.5 mg/kg)及PBS 溶液。Zea-Longa 评分1~3分视为成功模型。
1.3.2 神经行为学评价:采用改良的神经功能缺损评分(modified neurological severity scores,mNSS)评估实验动物的神经功能缺损情况。实验动物于造模后第1~35 天进行mNSS 评分,每7 d 进行一次评估。神经功能的评估项目包括小鼠运动、感觉、平衡、反射能力,mNSS 评分在12~16 分的小鼠入组实验。mNSS评分高则损害较重,分数为0~22分。
1.3.3 免疫荧光染色
1.3.3.1 脑组织切片制备:实验组小鼠腹腔麻醉,固定后使其心脏暴露,经左心室插入穿刺针至升主动脉处约0.5 cm 进行固定,采用温度37 ℃、压力150 mmHg(1 mmHg=0.133 kPa)PBS溶液经剪开的右心耳进行灌注,待实验组小鼠黏膜、四肢苍白后,4%多聚甲醛继续灌注,最终取出脑组织并用新的4%多聚甲醛固定24 h。脑组织按顺序置于4 ℃的浓度梯度分别为15%、20%、30%的蔗糖溶液沉底。脑组织置于冰冻切片机中,调整厚度约10 μm 的冠状位连续切片,切片置于防冻液—80 ℃保存。
1.3.3.2 脑组织免疫荧光染色:脑组织冰冻切片复温后置于4%的多聚甲醛固定10 min;用PBS溶液漂洗3次,5 min/次;5%山羊血清封闭切片1 h;切片甩去血清后,加入一抗并置于4 ℃的湿盒。过夜后,切片再次经PBS 溶液清洗3 次,5 min/次。室温条件下加入二抗并孵育2 h,PBS溶液再次清洗2次,5 min/次,整个操作过程避光进行,抗荧光剂封片后显微镜观察。
1.3.4 Western blotting检测
1.3.4.1 蛋白样品的制备及定量:各组小鼠实验第3天取脑,用预冷的组织剪将冠状切前囱前l.0 mm 至前囱后3.0 mm 梗死区脑组织剪碎。按1 g 脑组织与0.06 mL 的RIPA 裂解液的比例加入裂解液,并于冰上匀浆,充分摇匀。在4 ℃、12 000 r/min 条件下离心20 min,上清为样品蛋白。操作严格按照BCA 蛋白定量试剂盒说明,测定并且计算出样品的蛋白浓度。最后分装并于—80 ℃保存。
1.3.4.2 SDS-PAGE电泳:配置10 mL的12%分离胶,用去离子进行水封闭。室温条件下约30 min后弃去去离子水,配制3 mL的15%压缩胶,迅速加入至分离胶上并插入梳子。室温约15 min,待压缩胶聚合凝固后将梳子拔出并清洗,凝胶置于电泳槽中。按设计的顺序等剂量进行加样。连接所需电泳设备,设定电压80 V 跑胶至压缩胶底部,后电压110 V 跑胶至底部为止。转膜液浸泡保留的胶并待转膜。
1.3.4.3 转膜:用去离子水清洗经甲醇浸泡活化的PVDF膜,置于转膜液中备用。在转膜仪上,按滤纸、膜、胶、滤纸的顺序依次进行排列,在电流100 mA 50 min条件下转膜。
1.3.4.4 免疫反应:将5%脱脂奶粉与PVDF膜放于塑料薄膜中封口并于摇床封闭2 h。将PVDF膜从脱脂奶粉取出,放入含有一抗的塑料薄膜中封口4 ℃过夜。应用TBST 液将PVDF 膜清洗5 次,10 min/次。PVDF膜置于含有二抗的塑料薄膜中封口,在室温条件下摇床孵育2 h。最后应用TBST液清洗5次PVDF膜,10 min/次。
1.3.4.5 化学显像及分析:将清洗后的PVDF膜置于含有ECL 发光液的扫描仪中进行扫描。Western blotting图像分析软件分析内参条带和目的条带光密度值,光密度值的比值则为目的蛋白表达含量。
1.3.4.6 小胶质细胞数量评估及分析:采用图像分析软件Imaging-Pro-Plus(OLYMUPS)处理系统分析测量梗死灶周围MG Iba1 阳性数量。每张免疫荧光染色脑片均取相同部位视野进行软件分析。
1.4 统计数据分析采用SPSS 21.0 统计软件分析实验数据,采用均数±标准差(±s)形式表示,组内采用单因素方差分析法比较,组间采用LSD 法比较,P<0.05为差异有统计意义。
2 结果
2.1 泊马度胺对神经功能的影响采用mNSS 评分评估小鼠脑梗死后的神经功能缺损情况。与无神经功能缺损的Sham组小鼠相比,其他各组均出现不同程度的神经功能缺损。实验过程中,Pom 组小鼠缺损的神经功能在第7~35天表现出持续恢复。第7天时,尽管MCAO 组和Vehicle 组mNSS 评分也表现为下降的趋势,而Pom组评分则显著下降,重复测量方差分析显示组间差异有统计学意义(F=3.601,P<0.05),LSD 检验显示,Pom 组mNSS 评分相较MCAO组和Vehicle 组差异有统计学意义(P<0.05)。见图1、表1。
表1 脑梗死小鼠神经功能评分比较Table 1 Neurological function score of cerebral infarction mice (±s)
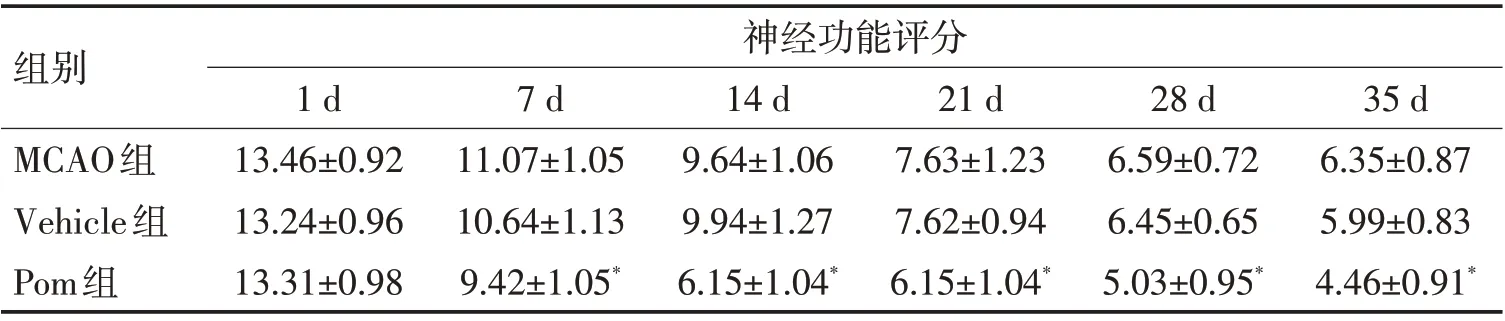
表1 脑梗死小鼠神经功能评分比较Table 1 Neurological function score of cerebral infarction mice (±s)
注:与MCAO组和Vehicle组相比,*P<0.05
组别MCAO组Vehicle组Pom组神经功能评分35 d 6.35±0.87 5.99±0.83 4.46±0.91*1 d 13.46±0.92 13.24±0.96 13.31±0.98 7 d 11.07±1.05 10.64±1.13 9.42±1.05*14 d 9.64±1.06 9.94±1.27 6.15±1.04*21 d 7.63±1.23 7.62±0.94 6.15±1.04*28 d 6.59±0.72 6.45±0.65 5.03±0.95*
2.2 泊马度胺对细胞因子的影响
2.2.1 泊马度胺对脑组织内TNF-α、IL-1β的影响:采用Western blotting 技术测定脑梗死组织周围的TNF-α、IL-1β水平。Sham 组小鼠脑组织内低水平表达TNF-α和IL-1β;与Vehicle组和MCAO组小鼠脑组织内高水平表达TNF-α和IL-1β不同,Pom 组小鼠脑组织的TNF-α、IL-1β表达水平明显降低,与Vehicle组和MCAO 组相比差异有统计学意义(P<0.01)。见图2、表2。
表2 不同时间点梗死侧脑组织匀浆中TNF-α、IL-1β的Western blotting结果比较 (±s)Table 2 Western blotting results of TNF-α and IL-1β in brain homogenate of infarct side at different time points (±s)
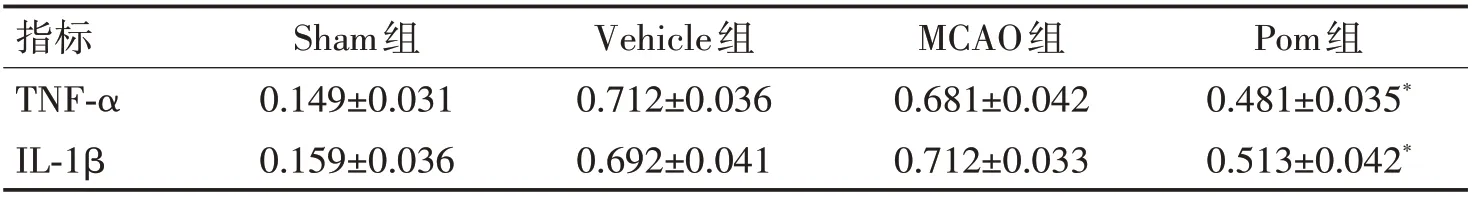
表2 不同时间点梗死侧脑组织匀浆中TNF-α、IL-1β的Western blotting结果比较 (±s)Table 2 Western blotting results of TNF-α and IL-1β in brain homogenate of infarct side at different time points (±s)
注:与Vehicle组和MCAO组相比,*P<0.05
指标TNF-α IL-1β Pom组0.481±0.035*0.513±0.042*Sham组0.149±0.031 0.159±0.036 Vehicle组0.712±0.036 0.692±0.041 MCAO组0.681±0.042 0.712±0.033
2.2.2 泊马度胺对脑组织内BDNF、GDNF 的影响:采用Western blotting 技术测定脑梗死组织周围的BDNF、GDNF水平。Sham组小鼠脑组织内低水平表达BDNF、GDNF。与MCAO 组和Vehicle 组升高的BNDF、GDNF表达水平相比,Pom组小鼠脑组织中营养因子蛋白表达水平达到最高。对小鼠脑组织BNDF、GDNF 蛋白表达进行分析,MCAO 组、Vehicle组和Pom 组结果差异均有统计学意义(P<0.01)。见图3、表3。
表3 不同时间点梗死脑组织匀浆中BDNF、GDNF的Western blotting结果比较 (±s)Table 3 Western blotting results of BDNF and GDNF in infarcted brain tissue at different time points (±s)

表3 不同时间点梗死脑组织匀浆中BDNF、GDNF的Western blotting结果比较 (±s)Table 3 Western blotting results of BDNF and GDNF in infarcted brain tissue at different time points (±s)
注:与Vehicle组和MCAO组相比,*P<0.05
指标BDNF GDNF Pom组0.693±0.039*0.731±0.032*Sham组0.181±0.031 0.171±0.034 Vehicle组0.413±0.036 0.412±0.043 MCAO组0.434±0.041 0.461±0.032
2.3 泊马度胺对小胶质细胞的影响脑梗死后第1、7、14、28天,与Sham组相比,其余各组脑梗死灶周围组织MG数目均增多,Pom组增加的MG数目与MCAO组及Vehicle 组相比明显减少,差异有统计学意义(P<0.05),MCAO 组与Vehicle 组MG 增加数目相比差异无统计学意义(P>0.05)。脑梗死后第7 天MG数目最多,第14、28天时数量明显下降。见图4~5。
3 讨论
实验表明,通过静脉注射泊马度胺可抑制MG过度增生来减轻缺血后其介导的炎症反应,促进神经营养因子的分泌,显著改善脑梗死小鼠神经功能的缺损情况,发挥神经保护作用。脑梗死发生后,组织缺血缺氧造成神经元的死亡[8-9],受损细胞释放损伤相关的细胞因子和兴奋性毒性谷氨酸[10-12],从而引发炎症级联反应[13]。MG激活作为炎症反应的重要一环[14-15],可产生多种介质,包括促炎细胞因子(TNF-α)[16]、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)[17],不仅通过产生毒性物质而加重神经元的损伤,而且通过产生BDNF等生长因子促进神经元修复[18-19]。
泊马度胺作为新一代免疫调节剂类药物[20],在小鼠视网膜抗炎实验中发现,其在抗炎浓度下不具有神经毒性。关于创伤性脑损伤(traumatic brain injury,TBI)的研究显示,单次给药泊马度胺(0.5 mg/kg)可减轻动物模型的病变大小,减少神经元的凋亡,显著改善运动功能障碍[21]。在难治性骨髓瘤实验中[22],有学者发现泊马度胺不仅通过抑制MM 细胞的功能产生抗骨髓瘤的作用,也能通过下调炎症因子TNF-α、IL-6、IL-8 等的表达,使靶细胞的存活率下降。脑梗死动物模型中,TNF-α和IL-1β在梗死后24 h 内脑脊液中显著升高[23-25],与梗死面积呈正相关[26-28]。而本实验中Pom组活化MG的数目明显减少,发现泊马度胺也同样抑制促炎细胞因子TNF-α、IL-1β表达,推测可能是通过抑制MG实现的。
小胶质细胞是脑内的免疫细胞,可产生多种神经营养因子,促进脑梗死后损伤脑组织的神经恢复。有研究者尝试将外源性MG直接移植入脑内,结果提示MG 对脑梗死有保护 作 用[29-30]。在 短 暂 性MCAO 组动物模型中,脑缺血发生2 d后移植MG有效减少凋亡的神经元,增加包括GDNF、BDNF 在内的神经营养因子的表达,促进神经功能恢复[31]。本实验发现,Pom 组GDNF、BDNF 神经营养因子表达明显高于Vechile 组,推测可能是小胶质细胞的分泌作用所致。
泊马度胺可以抑制脑梗死后MG 的过度活化,减轻其介导的炎症反应,促进神经营养因子的表达,显著改善缺损的神经功能。因此,泊马度胺可能是缺血性脑卒中潜在的治疗靶点。

