靶向治疗联合全脑同步加量调强放疗治疗脑转移瘤的疗效
韩全乡 王 磊 胡应亮 王 娜 丁照黎 张丽媛 宁怡蒙
郑州大学附属郑州中心医院 郑州市中心医院,河南 郑州 450000
脑转移瘤为常见的颅内肿瘤,其多发于侵袭性强的恶性肿瘤中,且发生后其生存时间仅为1~2 个月,预后极差[1]。全脑放疗为脑转移瘤的有效治疗方式之一,治疗后患者的中位生存时间虽有所提高,但仍较低,仅为3~6 个月[2-3]。近年来为进一步提高脑转移瘤的疗效,分子靶向治疗及调强放疗受到临床关注。有研究指出,全脑放疗基础上同步加量调强放疗可明显降低局部复发率,可根据需要调节靶区剂量,在提高肿瘤局部剂量的同时减少周边组织剂量[4-5]。另分子靶向治疗可将药物疗效定位于靶细胞生物分子上,提高药物治疗的特异性,抑制肿瘤细胞的增殖,增强治疗效果[6]。但目前临床关于靶向治疗联合全脑同步加量调强放疗应用于脑转移瘤对患者疗效及预后的影响国内少有文献报道。基于此,本研究分析靶向治疗联合全脑同步加量调强放疗治疗脑转移瘤的疗效及预后情况。
1 资料和方法
1.1 一般资料选取2018-10—2019-10 郑州中心医院收治的脑转移瘤患者120 例进行临床及随访研究。病例纳入标准:①原发性癌组织经确诊,且磁共振成像(MRI)证实为脑转移瘤者;②卡氏评分(KPS)≥60分;③均无法满足手术指征或拒绝手术治疗,但病灶无明显出血者。排除标准:①无需进行全脑放疗者;②心、肝、肾功能严重受损者;③放化疗禁忌证者;④合并骨髓抑制者;⑤预计生存期≤3个月;⑥精神疾病患者。剔除标准:不能耐受不良反应退出者。入选患者按照随机数字表分为观察组与对照组各60例。2组患者基线资料见表1。

表1 2组一般资料比较Table 1 Comparison of general data between the two groups
1.2 治疗方法加量调强放疗:2 组均使用加量调强放疗。放疗时,首先采用螺旋CT 进行扫描,层厚为3 mm,在MRI 图像上勾画肿瘤靶区。勾画要求:肿瘤靶区(gross tumor volume,GTV)主要为影像显示的病灶;除需要保护以外的脑组织定义为临床靶区(clinical target volume,CTV);在CTV 基础上四周外扩3 mm 定义为计划靶区(plan target volume,PTV)(图1~2)。治疗机使用trilogy加速器(美国瓦里安公司),采用CMS 的XIO 计划系统制定放疗计划,处方剂量为95% PTV 所受剂量。放疗剂量:全脑PTV 2 Gy/次,共20次;同时给予转移灶GTV 2.5~3.0 Gy/次,每周5 次,共20 次。目标剂量要求:海马平均剂量<10 Gy且最大剂量<17 Gy,尽量保持一侧功能。
药物治疗:2 组均给予甘露醇125 mL,1 次/d 或地塞米松5~10 mg,1 次/d。观察组在常规药物治疗的基础上联合贝伐株单抗靶向治疗,贝伐株单抗[生产企业:Roche Pharma(Switzerland)Ltd;国药准字:S20120069;规格:400 mg(16 mL)/瓶]5 mg/kg,2 周/次。靶向治疗的同时给予托烷司琼预防呕吐。
1.3 观察指标(1)近期疗效:治疗3 个月后,根据RECIST 1.1 版实体瘤疗效评价标准中完全缓解(complete remission,CR)、部 分 缓 解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)评估标准进行疗效评估(图3)。其中客观缓解率(objective response rate,ORR)=(CR+PR)/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。(2)不良反应:恶心呕吐、腹泻、便秘、中性粒细胞减少、血小板减少、白细胞下降、头痛。不良反应以WHO不良反应分级为标准:0级(无),Ⅰ级(轻度反应),Ⅱ级(中度可耐受),Ⅲ级(中度不可耐受),Ⅳ级(重度并威胁生命)。(3)生存时间分析:治疗后通过门诊、电话访问方式对患者随访4~24(12.3±5.4)个月,随访截至2021-10,记录2 组患者无进展生存时间(progression free survival,PFS),分析其预后影响因素。
1.4 统计学方法采用SPSS 22.0软件分析数据,计数资料用率(%)表示,行χ2检验,组间疗效比较采用Mann-Whitney U 秩和检验;符合正态分布的计量资料采用均数±标准差(±s)表示,行独立样本t 检验,生存时间采用Kaplan-Meier法分析,组间累积生存概率比较采用Log-Rank 检验;预后影响因素采用Cox回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组近期疗效比较120例脑转移瘤患者中共有412个脑转移灶,均完成随访。治疗3个月后,观察组患者ORR、DCR 高于对照组(63.33% vs 45%、85% vs 70%),差异均有统计学意义(P<0.05)。见表2,图4。
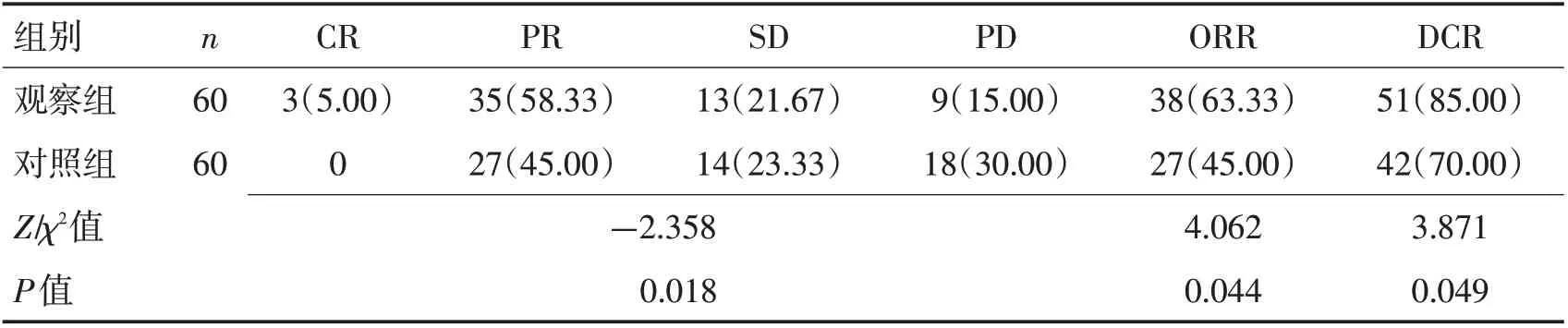
表2 2组近期疗效比较[n(%)]Table 2 Comparison of short-term efficacy between the two groups[n(%)]
2.2 2组不良反应比较2组患者均出现恶心呕吐、腹泻、便秘、中性粒细胞减少、血小板减少、白细胞下降、头痛等不良反应。2组不良反应经药物减量或暂停及对症处理好转,均未出现毒性反应相关死亡病例,同时2组不良反应多集中在Ⅰ~Ⅱ级,且差异均无统计学意义(P>0.05)。见表3,图5。
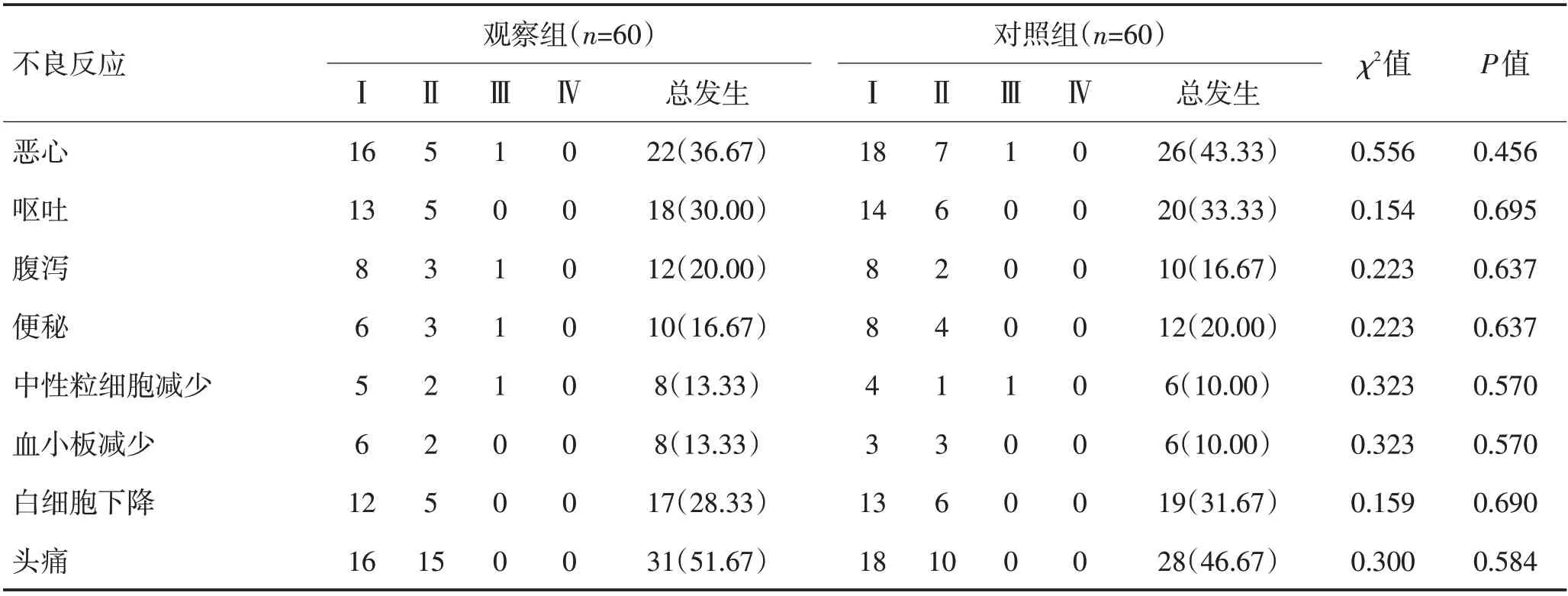
表3 2组不良反应比较Table 3 Comparison of adverse reactions between the two groups
2.3 2组患者预后影响因素单因素分析至随访结束,患者均未失访,且PFS为32例(26.67%)。所有患者中,男性和女性PFS 分别为12.4 个月和12.3 个月(P=0.299);年龄≥65 岁和<65 岁的PFS 分别为12.5个月和12.8 个月(P=0.975);转移灶数目>3 个和≤3个的PFS 分别为12.6 个月和12.5 个月(P=0.916);神经功能障碍有和无的PFS分别为12.6个月和12.5个月(P=0.865);RPA分级I级、II级及III级PFS分别为15.5个月、11.6个月及10.2个月(P<0.001);颅外病灶控制与未控制者PFS 分别为14.9 个月和10.7 个月(P<0.001);中线结构偏移及未偏移的PFS 分别为13.6 个月和11.4 个月(P=0.017);治疗方案为靶向治疗+放疗及单纯放疗的PFS 分别为14.1 个月和10.9个月(P=0.001),见表4,图6。
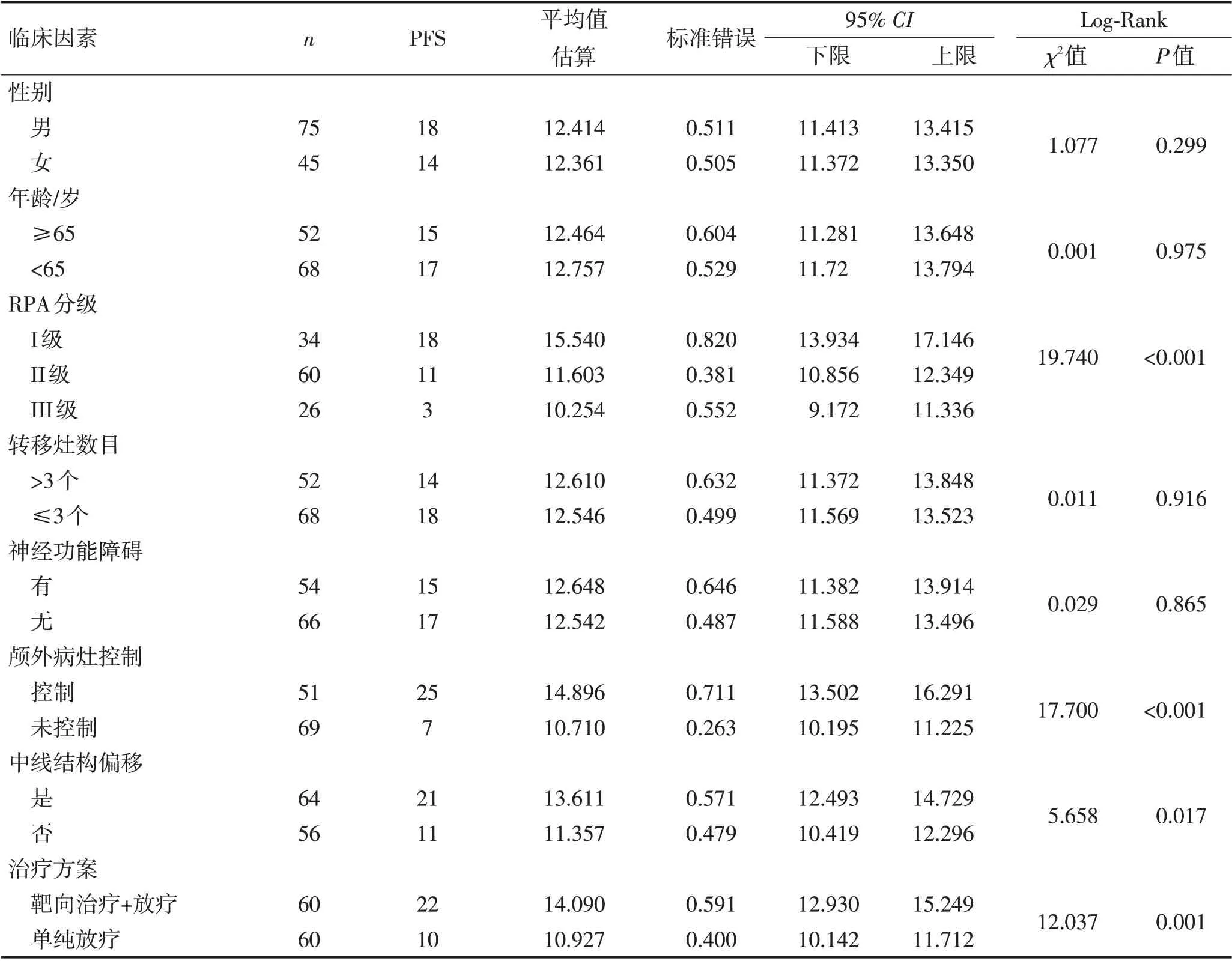
表4 2组患者预后影响因素的Kaplan-Meier分析Table 4 Kaplan-Meier analysis of prognostic factors in two groups of patients
2.4 2 组患者预后影响因素的Cox 多因素分析Cox分析显示,RPA分级B=0.669,OR=1.952,P<0.05;颅外病灶控制B=1.028,OR=2.795,P<0.05;中线结构偏移B=0.848,OR=1.581,P<0.05,治疗方案B=0.669,OR=2.336,P<0.05,提示RPA 分级、颅外病灶控制情况、中线结构偏移及治疗方案为脑转移瘤患者疾病进展的危险因素。见表5。

表5 2组患者预后影响因素的Cox多因素分析Table 5 Cox multivariate analysis of prognostic factors in two groups of patients
3 讨论
恶性肿瘤脑转移的发生率高,其常见原发病灶包括肺部肿瘤、消化道肿瘤及乳腺肿瘤等[7-8]。临床资料显示,脑转移瘤发生后多提示预后差,其自然生存时间低,可严重威胁患者的生命安全[9]。全脑放射治疗为脑转移瘤的主要治疗方式,其可缩小患者肿瘤灶,抑制肿瘤的生长,延长脑转移瘤患者的生存时间[10]。但有研究指出,全脑放射治疗对颅内肿瘤的控制率仅为60%左右,且治疗后中位生存时间只有3~6 个月[11]。而在全脑放疗基础上同步加量调强放疗可同时将多个肿瘤病灶进行整合,其采用多野同中心照射技术,各个照射野可进一步分为多个子野,且各个子野的照射强度可根据需要进行调节,因此有效提高了肿瘤靶区的照射剂量,同时降低低危及海马区、脑干等脑组织的照射剂量及体积[12]。同时,全脑同步加量调强放疗具有无剂量重叠特点,其在杀灭肿瘤病灶的同时可对每个脑转移灶进行高效率照射,降低肿瘤局部的复发率。另靶向治疗为目前临床研究的另一重点领域,其主要以与肿瘤细胞增殖、分裂相关的介导信号通路的关键酶为药物的针对靶点,具有特异性高、治疗效果佳及不良反应少等优点[13]。靶向治疗应用于脑转移瘤中主要是通过对肿瘤细胞可产生特异性亲和力的物质,其将药效靶向作用于脑转移瘤的范围中,进而有效抑制脑转移瘤的增殖及转移,进一步增强疗效,延长患者的生存时间[14]。贝伐株单抗为靶向治疗药物之一,其进入人体后可显著增强血管的通透性,应用于放射治疗中可显著缩小脑损伤体积,缓解脑细胞缺氧状态,促进患者神经功能的恢复。贝伐株单抗可直接将癌细胞杀死,在不损伤正常脑组织及细胞的同时,抑制肿瘤血管的生成,也因此安全性及治疗效果更佳。本研究中,治疗3个月后观察组ORR、DCR均高于对照组,提示全脑同步加量调强放疗联合靶向治疗脑转移瘤的近期疗效更佳,因此治疗方案优势明显。
脑转移瘤的恶性程度高,全脑同步加量调强放疗联合靶向治疗在延长患者生存时间的同时,也会不可避免地产生不良反应。已有研究指出,靶向治疗药物在抑制肿瘤生长、转移作用的同时,其安全性较好,不良反应主要为轻度的呕吐、头痛及腹泻[15]。本研究中2组均出现恶心呕吐、腹泻、便秘、中性粒细胞减少、血小板减少、白细胞下降、头痛等不良反应,但各不良反应多集中在I~II级,且均无显著差异。该结果与国内外较多报道相符,具有一致性[16],提示全脑同步加量调强放疗联合靶向治疗脑转移瘤不良反应较少,患者耐受性较好。可能原因:全脑同步加量调强放疗在保证病灶放射治疗剂量适宜的同时,降低海马、脑干等脑组织的放疗剂量及范围,更好地保护脑组织,因此安全性均较高。
既往研究显示,单纯采用全脑放射治疗脑转移瘤患者的中位生存期仅为5 个月,且1 a 生存率为19%左 右[17]。而MUSUNURU 等[18]研究采用全脑同步加量调强放疗对脑转移瘤进行治疗,疗效显著提高,且PFS 为12.9 个月,1 a 的生存率为40%左右。本研究中,在全脑同步加量调强放疗的基础上联合靶向治疗,观察组的PFS显著高于对照组,且多因素Cox分析显示,治疗方案为脑转移瘤患者疾病进展的危险因素,提示全脑同步加量调强放疗联合靶向治疗的效果好,可有效提高患者的生存时间。脑转移瘤的预后除与靶向治疗有关外,还与原发病灶控制情况、脑外肿瘤控制情况有关[19]。有研究显示,原发灶的控制与否对患者PFS具有一定影响。有文献指出,RPA 分级为脑转移瘤患者生存率的独立影响因素。本研究中RPA分级Ⅲ级、颅外病灶未控制、中线结构未偏移的患者PFS 明显缩短。多因素Cox 分析显示,RPAⅢ级、颅外病灶未控制、中线结构未偏移均为脑转移瘤患者疾病进展的危险因素。故临床可针对脑转移瘤患者加以靶向治疗,并针对性地对患者原发病灶及颅外病灶进行控制,以提高患者的生存时间,改善其预后。

