动态轴向压缩色谱高效制备丹酚酸A工艺研究
★ 刘地发 王振 周鹏 余水平 王章伟(1.暨南大学 广州 510635;2.创新天然药物与中药注射剂国家重点实验室 江西 赣州 341000;3.江西青峰药业有限公司 江西 赣州341000)
丹参水溶性酚酸类化合物的研究是国内新药研究的热点,目前已有注射用丹参多酚酸和注射用丹参多酚酸盐等多个品种上市销售。丹酚酸类化合物有较强的抗氧化和清除自由基的功能,其中丹酚酸 A(salvianolic acid A)活性最强[1]。文献报道,丹酚酸 A 具有抗氧化[2-4]、抗血栓[5]、抗炎[6]等多重药理作用,对脑缺血及缺血再灌损伤具有明显保护作用[7-9]。然而,丹参药材中丹酚酸A的天然含量非常低[10],高效制备高纯度丹酚酸A难度系数大。目前关于丹酚酸A的制备工艺多属于实验室级别[11-12],采用常规制备方法成本高,步骤繁琐,且丹酚酸A纯度达不到标准,工艺重现性差,难以实现规模化生产,无法满足新药开发的需求。因此,有必要寻找一种简便快速的制备方法,以便更好地开发利用丹酚酸A。
工业制备色谱是大规模分离和制备活性成分的重要方法,其高效的优势在中药分离纯化研究中的作用逐渐突显。其中,动态轴向压缩技术(Dynamic axial compression,DAC)作为一种新型的制备色谱技术,因其柱效高、重现性好、分离效率高、制备量大等优点受到越来越多的关注[13]。文献报道,该技术已用于栀子苷[14]、银杏内酯 B[15]、断氧化马钱子苷[16]、芍药苷[17]等化合物的纯化制备,并获得良好的收益。本实验旨在采用动态轴向压缩工业色谱技术,以正相硅胶为填料,建立一种快速大量制备高纯度丹酚酸A的方法,实现批量化生产,促进相关新药的研究进程,同时也为从其他植物中制备高纯度单一天然药物成分提供一条新的思路和方法。
1 仪器与材料
1.1 仪器
Waters 2695高效液相色谱仪(美国沃特世公司);ACE Excel 3 C18-PFP 色谱柱(3.0 μm,4.6 mm×150 mm,广州菲罗门科学仪器有限公司);UV-2550紫外-可见分光光度计(日本岛津公司);Nicolet iS5红外光谱仪(赛默飞世尔科技有限公司);XS105DU/ML204T 电子天平(梅特勒-托利多科技有限公司);Waters Xevo G2-XS Q-TOF 质谱仪(美国沃特世公司);BRUKER AV-400 型核磁共振谱仪(瑞士布鲁克公司);DAC-HB 150动态轴向压缩工业色谱系统(150 mm ×650 mm,江苏汉邦科技有限公司)。
1.2 材料
丹参购自陕西商洛丹参GAP种植基地,经江西中医药大学葛菲教授鉴定为唇形科植物丹参Salvia miltorrhizaBge.的干燥根和根茎;丹酚酸 A对照品为实验室自制,质量平衡法含量99.2%(江西青峰药业有限公司,批号:20181210);柱层析正相硅胶(300~400目,青岛海湾精细化工有限公司);甲醇(色谱纯,国药集团化学试剂有限公司);溴化钾(光谱纯,中世沃克〈天津〉科技发展股份有限公司);乙腈(色谱纯,国药集团化学试剂有限公司);磷酸(分析纯,南京化学试剂有限公司);95%乙醇(药用级,梅河口市阜康酒精有限责任公司);环己烷(分析级,天津市科密欧化学试剂股份有限公司);叔丁基甲基醚(分析级,天津市光复精细化工研究所);双蒸水(自制)。
2 方法与结果
2.1 色谱条件
ACE Excel 3 C18-PFP 色谱柱(3.0 μm,4.6 mm×150 mm);流动相为甲醇∶乙腈(50∶50,A)-0.1%磷酸溶液(B);流速:0.7 mL/min,进样体积 10 μL,柱温:25 ℃;检测波长:286 nm。洗脱梯度见表1。

表1 丹酚酸A液相检测洗脱梯度表
2.2 质谱条件
Waters Xevo G2-XS Q-TOF质谱仪记录其质谱图。离子源:ESI离子源,扫描模式:PositiveTOF,毛细管电压 2 500 V,离子源温度:120 ℃,脱溶剂气温度:450 ℃,脱溶剂气流量:600 L/h,锥孔气流量:50 L/h,质荷比扫描范围100~1 200 Da,流动相乙腈-0.1%甲酸水(1∶1),流速 0.2 mL/min,柱温:40 ℃,色谱柱:Waters Acquity UPLC BEH C18(2.1 mm×100 mm,1.7 μm)。
2.3 丹酚酸A粗品制备
丹参药材粉碎,加水(10倍、8倍、6倍)温浸提取3次,提取液减压浓缩、醇沉,滤过,滤液调pH后转化,离心。离心液通过大孔吸附树脂柱富集纯化,收集目标洗脱液,减压浓缩、叔丁基甲基醚萃取,萃取液减压浓缩至稠膏,即得丹酚酸A粗品,备用。丹酚酸A粗品纯度80%以上。
2.4 动态轴向压缩色谱分离
2.4.1 柱层析填料选择硅胶介质是天然产物批量制备的主要角色,利用硅胶表面与溶质分子之间的范德华力或硅胶表面的硅羟基与待分离物质之间的氢键作用,达到良好的分离纯化效果。根据丹酚酸A粗品的性质和杂质情况,以正相硅胶(300~400目)为填料进行分离纯化。预实验结果表明硅胶能有效去除丹酚酸A粗品中的色素和杂质,得到的目标产品性状好。综合考虑选择300~400目正相硅胶作为分离填料纯化丹酚酸A粗品。
2.4.2 色谱洗脱溶剂选择以薄层色谱法(TLC)为依据,根据不同溶剂的性质,选择洗脱体系。实验比较正己烷-叔丁基甲基醚、环己烷-叔丁基甲基醚溶剂体系不同配比,对“2.3”项下的丹酚酸A粗品进行单向展开,杂质的比移值(Rf值)在0.2~0.3之间。以斑点数、分离度、拖尾现象为柱色谱分离能力的判断指标,对分离溶剂系统进行评价和筛选,选择分离度好、无脱尾的系统作为色谱分离的洗脱剂。结果表明,环己烷-叔丁基甲基醚、正己烷-叔丁基甲基醚系统对样品均有较好的分离作用。
经查阅文献,正己烷属低毒类溶剂,且具有高挥发性、高脂溶性,并有蓄积作用。正己烷主要通过呼吸道、皮肤、消化道等进入人体,对中枢、周围神经系统损害,对皮肤黏膜的刺激作用,长期接触可致多发性周围神经病变,神经传导速度减慢,甚至肌肉萎缩,严重者可引起肝肾损害[18]。结合工业化生产要求及溶剂本身的性质(安全性、质量可控性、沸点等)、溶剂使用原则、溶剂价格等进行综合评价,选择环己烷-叔丁基甲基醚系统作为色谱分离的洗脱剂。通过 TLC 初步确定柱色谱洗脱剂的洗脱梯度为:先用环己烷-叔丁基甲基醚(4∶6,V/V)洗脱,再用环己烷-叔丁基甲基醚(3∶7,V/V)洗脱。
2.4.3 纯化硅胶用量筛选采用动态轴向压缩柱(150 mm× 650 mm),以正相硅胶(300~400 目)为填料制备丹酚酸A。取“2.3”项下丹酚酸A粗品(含丹酚酸A200g),加适量硅胶(300~400目)拌样,干燥。另按丹酚酸A与层析硅胶(300~400目)1∶10、1∶15、1∶20、1∶25不同重量比例,进行柱层析,柱层析参数如下:洗脱流速500 mL/min,紫外检测器在线跟踪检测(检测波长:286 nm),洗脱剂体系及洗脱梯度为:先用环己烷-叔丁基甲基醚(4∶6,V/V)洗脱至丹酚酸A出现,再用环己烷-叔丁基甲基醚(3∶7,V/V)洗脱至无丹酚酸A时洗脱结束。合并纯度大于98%的洗脱流份,减压浓缩,干燥,即得。结果表明:纯化硅胶用量为1∶10、1∶25时,收得的丹酚酸A质量符合要求,但收率低,成本高;纯化硅胶用量在1∶15~1∶20范围时,样品质量、收得率符合工艺要求,因此确定纯化硅胶比例定为1∶15~1∶20,结果见表2。
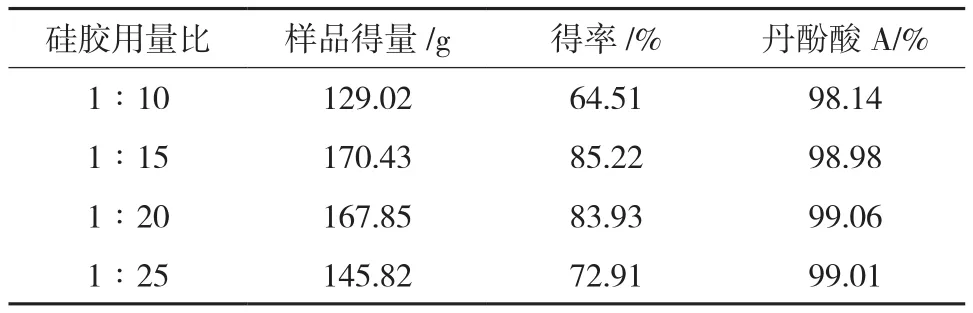
表2 纯化硅胶用量筛选结果汇总表
2.4.4 洗脱流速筛选采用动态轴向压缩柱(150 mm×650 mm),以正相硅胶(300~400目)为填料制备丹酚酸A。取“2.3”项下丹酚酸A粗品(含丹酚酸A200 g),加适量硅胶(300~400目)拌样,干燥,按丹酚酸A与层析硅胶(300~400目)重量比1∶20进行柱层析,柱层析参数如下:洗脱流速控制300~1 200 mL/min,紫外检测器在线跟踪检测(检测波长:286 nm),洗脱剂体系及洗脱梯度为:先用环己烷-叔丁基甲基醚(4∶6,V/V)洗脱至丹酚酸A出现,再用环己烷-叔丁基甲基醚(3∶7,V/V)洗脱至无丹酚酸A时洗脱结束。合并纯度大于98%的洗脱流份,减压浓缩,干燥,即得。结果表明:洗脱流速控制300~900 mL/min时,收得的丹酚酸A质量符合要求,且制备得率高,结果见表3。
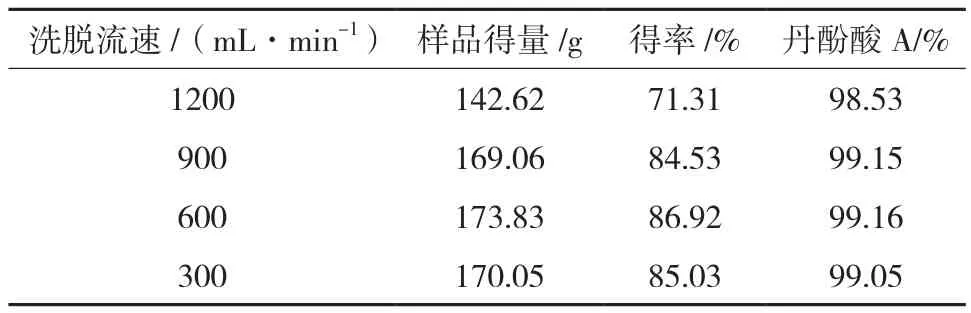
表3 洗脱流速筛选结果汇总表
2.4.5 洗脱剂用量考察采用动态轴向压缩柱(150 mm×650 mm),以正相硅胶(300~400目)为填料制备丹酚酸A。取“2.3”项下丹酚酸A粗品(含丹酚酸A200 g),加适量硅胶(300~400目)拌样,干燥,按丹酚酸A与层析硅胶(300~400目)重量比1∶20进行柱层析,柱层析参数如下:洗脱流速控600 mL/min,紫外检测器在线跟踪检测(检测波长:286 nm),洗脱剂体系及洗脱梯度为:先用环己烷-叔丁基甲基醚(4∶6,V/V)洗脱13倍柱体积(91 L),再用环己烷-叔丁基甲基醚(3∶7,V/V)洗脱8倍柱体积(56 L)。合并纯度大于98%的洗脱流份,减压浓缩,干燥,即得。结果表明:纯化时先采用环己烷-叔丁基甲基醚(4∶6,V/V)洗脱10倍柱体积(70L),再采用环己烷-叔丁基甲基醚(3∶7,V/V)洗脱6倍柱体积(42 L),收得的流份经处理后丹酚酸A质量符合要求,且制备效率高。各洗脱流份丹酚酸A纯度变化趋势见图1。
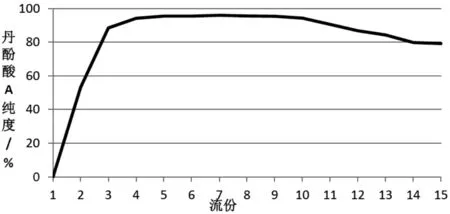
图1 洗脱流份中丹酚酸A纯度变化趋势图
2.4.6 工业色谱纯化工艺采用动态轴向压缩柱(150 mm× 650 mm),以正相硅胶(300~400 目)为填料制备纯化丹酚酸A。取“2.3”项下丹酚酸A粗品,加适量硅胶(300~400目)拌样,干燥,干法上样(纯化硅胶用量比例为1∶20),流动相为环己烷-叔丁基甲基醚系统,紫外检测器在线跟踪检测(检测波长:286 nm)。洗脱程序如下:环己烷-叔丁基甲基醚(4∶6,V/V)洗脱10倍柱体积(70L),环己烷-叔丁基甲基醚(3∶7,V/V)洗脱6倍柱体积(42 L),洗脱流速控制 600 mL/min。合并纯度大于98%的洗脱流份,减压浓缩,干燥,即得丹酚酸A成品。
2.5 丹酚酸A纯度检测
2.5.1 对照品溶液的制备精密称定丹酚酸A工作对照品10 mg,置100 mL量瓶中,用稀释剂溶解并稀释至刻度,再精密量取0.7 mL,置100 mL量瓶中,用稀释剂稀释制成每1 mL中约含丹酚酸A 0.7 μg的溶液,摇匀,即得。
2.5.2 供试品溶液的制备精密称定“2.4.6”项下丹酚酸 A 10 mg,置 50 mL 量瓶中,用稀释剂溶解并稀释成每1 mL含丹酚酸A 0.2 mg的溶液,摇匀,即得。
2.5.3 样品测定精密量取供试品溶液、对照溶液各10 μL,按“2.1”项下色谱条件测定,分别注入液相色谱仪,记录色谱图,以面积归一化法计算丹酚酸A主峰纯度为99.10%,相对保留时间为19.8 min,色谱图见图2。
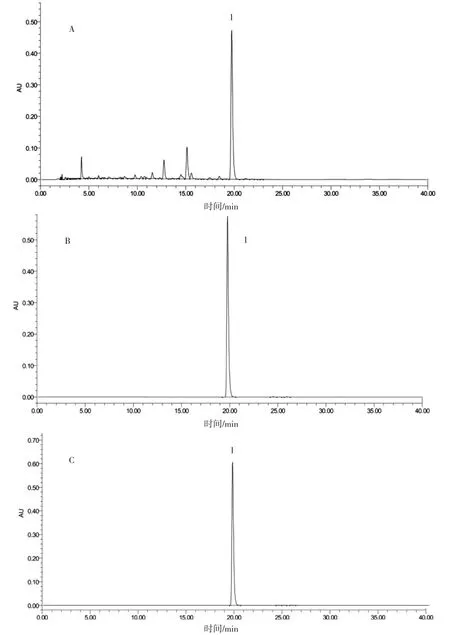
图2 丹酚酸A工业色谱纯化前后HPLC色谱图
2.6 丹酚酸A结构分析
2.6.1 UV鉴定取“2.4.6”项下丹酚酸A成品10 mg,精密称定,加水溶解制成每1 mL含丹酚酸A 10 μg的溶液,按紫外-可见分光光度法(中国药典2020年版四部通则0401),在190~400 nm范围内扫描测定。本品的最大吸收波长在198,254,286 nm处,提示结构中有强共轭系统,符合丹酚酸A紫外光谱特征。
2.6.2 IR鉴定取“2.4.6”项下丹酚酸A成品及对照品适量,分别采用KBr(溴化钾∶样品=100∶1)压片法,参考《中国药典》2015年版四部通则0402红外分光光度法测定,将样品的红外光吸收图谱与对照品图谱进行对比分析可知:氢键缔合的-OH的吸收峰在3324 cm-1;羧酸-C=O的吸收峰在1 686 cm-1;苯环骨架-C=C-的吸收峰 在 1 601 cm-1、1 519 cm-1;羧 酸 -COO- 的 吸收峰在 1 284 cm-1;反式双键 RCH=CHR 的吸收峰在 968 cm-1,Ar-H 的吸收峰在 807 cm-1。结果表明:本品结构中含-OH、羧基、苯环、-COO-、CH=CH、-CH2-等基团,红外光谱数据与丹酚酸A红外信号特征相符。
2.6.3 结构鉴定本品为黄色无定形粉末;ESI MSm/z:493.1139[M-H]-,分 子 式:C26H22O10。1H-NMR(400 MHz,DMSO-d6)δ:2.84(1H,dd,J=14.4,8.4 Hz,H-7''-a),2.96(1H,dd,J=14.4,4.4 Hz,H-7''-b),5.02(1H,dd,J=8.4,4.4 Hz,H-8''),6.32(1H,d,J=15.6 Hz,H-8'),6.47(1H,dd,J=8.0,2.0 Hz,H-6''),6.49(1H,d,J=16.0 Hz,H-7),6.60(1H,d,J=8.0 Hz,H-5''),6.65(1H,d,J=2.0 Hz,H-2''),6.73(1H,d,J=8.4 Hz,H-5),6.77(1H,d,J=8.4 Hz,H-4'),6.80(1H,dd,J=8.4,2.0 Hz,H-6),6.99(1H,d,J=2.0 Hz,H-2),7.03(1H,d,J=16.0 Hz,H-8),7.20(1H,d,J=8.4 Hz,H-5'),7.91(1H,d,J=15.6 Hz,H-7')。13C-NMR(100 MHz,DMSO-d6)δ:36.7(C-7''),73.4(C-8''),113.4(C-2),114.7(C-4'),114.7(C-8'),115.9(C-5''),116.3(C-5),117.0(C-2''),119.3(C-6),119.4(C-8),119.8(C-5'),120.7(C-6''),124.1(C-6'),127.6(C-1'),127.8(C-1''),129.4(C-1),136.3(C-7),143.6(C-2'),144.5(C-4''),145.4(C-3''),145.5(C-7'),146.0(C-3),146.3(C-4),147.7(C-3'),166.7(C-9'),171.4(C-9'')。数据与文献[19]报道一致,确定其为丹酚酸 A(salvianolic acid A),结构式见图3。

图3 丹酚酸A化学结构式
3 讨论
丹酚酸A具有较强的药理活性,对该成分的研究具有较大的运用价值。由于丹酚酸A在丹参药材中含量极低,且化合物的标准品比较昂贵,直接用于新药开发成本较高。综合大规模制备成本和分离效果等方面因素,本实验建立了一种快速大量制备高纯度丹酚酸A的方法,制备的丹酚酸A纯度99.0%以上。具体为:以丹参药材为原料,经提取、浓缩、转化、大孔吸附树脂富集,然后用动态轴向压缩工业色谱分离制备丹酚酸A,制备速度快、效率高,克服了常规制备方法成本高,步骤繁琐、重现性差等缺点。采用正相硅胶填料有成本低、分离度好、产品纯度高等特点,为丹酚酸A的工业化生产提供参考,也为本品后期的新药开发提供了充足的原料。

