miR-495靶向Notch1对神经胶质瘤细胞增殖、迁移及侵袭的影响
胡耀文,李 鑫*,武利伟,解 靖,刘振杰,赵新岗
(1.河北省保定市第一中心医院神经外一科,河北 保定 071000;2.首都医科大学三博脑科医院神经外科,北京 100000)
神经胶质瘤是临床常见的原发性颅内恶性肿瘤,发病率高,治疗困难,因其转移快速、侵袭性强而预后极差、且易复发,对患者生命健康造成极大威胁[1-3]。微小RNA(micro RNA,miRNA)是一类内源性的非编码RNA,可与靶基因非翻译区靶向结合,从而调控其翻译表达。miR-495作为一种miRNA,可通过调控多种基因表达而介导肿瘤的发生发展,miR-495在人类胶质瘤、子宫内膜癌、非小细胞肺癌等多种肿瘤中表达下调,促进其表达,可明显抑制癌细胞增殖并促进其凋亡,发挥显著的抑癌作用[4-6]。Notch1基因可调控细胞增殖、凋亡、分化等多种生理进程,并可通过调控细胞周期和上皮间质转化(epithelial-to-mesenchymal transition,EMT)过程而介导前列腺癌、乳腺癌、口腔鳞癌等多种肿瘤的生长及侵袭转移,下调其表达,可延缓EMT进程,抑制癌细胞增殖,降低其侵袭转移力[7-9]。另外,在关于口腔鳞癌的研究中发现,miR-495可靶向下调Notch1基因表达,进而抑制口腔鳞癌细胞的增殖和侵袭[9]。但miR-495靶向Notch1对神经胶质瘤细胞增殖、迁移及侵袭的影响,目前还未有明确全面的阐述,本研究对此进行初步探索。
1 材料与方法
1.1 试剂与细胞
人神经胶质瘤细胞U87(货号l110238)购买于上海北诺生物科技有限公司;胰蛋白酶-EDTA消化液(货号T1300)、DMEM培养基(货号31600)、优级胎牛血清(货号S9020)、青链霉素混合液(货号P1400)、LipofectamineTM2000(货号11668)、高效RIPA裂解液(货号R0010)、CCK-8试剂盒(货号CA1210)、BCA蛋白浓度测定试剂盒(货号PC0020)、逆转录试剂盒(货号T2240)、结晶紫染色液(货号G1062)购买于北京索莱宝科技有限公司;Opti-MEM培养基(货号31985062)购买于美国Thermo Fisher Scientific公司;AnnexinV/PI凋亡检测试剂盒(货号556547)购买于美国BD公司;miR-495、U6、Notch1、GAPDH引物购买于上海生工生物工程股份有限公司;miR-495 mimics、miR-495 mimics阴性对照购买于上海吉玛基因有限公司;基质胶(货号wlb1062)购买于上海瓦兰生物科技有限公司;RNAiso Plus(货号9108)购买于日本Takara公司;SYBR Green Master Mix(货号A8605)购买于美国ABI公司;兔源Anti-β-actin一抗(货号ab227387)、兔源Anti-caspase-3一抗(货号ab32351)、兔源Anti-Bax一抗(货号ab32503)、兔源Anti-Vimentin一抗(货号ab193555)、兔源Anti-E-cadherin一抗(货号ab76319)、兔源Anti-Notch1一抗(货号ab52627)、羊抗兔二抗(货号ab150077)购买于美国Abcam公司。
1.2 主要仪器
多功能酶标仪、流式细胞仪、凝胶成像系统购买于美国Thermo Fisher Scientific公司,型号分别是VARIOSKANLUX、Attune NxT、IBright CL 1500;光学显微镜购买于德国LEICA公司;核酸浓度测定仪购买于THERMO公司,型号Nanodrop little;高通量DNA合成仪、荧光定量PCR仪购买于美国Applied biosystems公司,型号分别是3900、7900 Fast;电泳仪、转膜仪购买于美国Bio-Rad公司,型号分别是EPS 300、Power-pac 3000。
1.3 实验方法
1.3.1 qRT-PCR实验检测神经胶质瘤组织和癌旁组织中miR-495表达 收集本院神经外科志愿者手术切除的神经胶质瘤组织和癌旁组织各6例,以RNAiso Plus分别提取其中总RNA,使用逆转录试剂盒均将其反转录为cDNA后,配制20 μL的qRTPCR反应体系:DEPC水6 μL+上游引物 0.8 μL+下游引物0.8 μL+ cDNA2 μL+ SYBR Green Master Mix10 μL+ ROX染料0.4 μL,均加入qRT-PCR反应管中,混匀后放入荧光定量PCR仪中进行反应,反应条件参照说明书的指导设定,以U6作为miR-495的内参基因,通过2-ΔΔCt算法分析数据,获得组织中miR-495的相对表达量。qRT-PCR引物序列见表1。
1.3.2 体外培养并分组转染细胞 快速解冻后复苏购买的人神经胶质瘤细胞U87,离心5 min(1 000 r·min-1),弃去上清液,将细胞沉淀以5 mL完全培养基(DMEM培养基+10%胎牛血清+100 U·mL-1青链霉素溶液)重新悬浮,混匀后接种在25 cm2培养瓶,平放入37 ℃细胞培养箱(5% CO2、95%湿度)中,进行无菌培养。
取上述处于对数生长期的U87细胞,接种在12孔细胞培养板中,放入37℃细胞培养箱无菌培养24 h,随机分为对照组、miR-495 mimics阴性对照组、miR-495 mimics组3组,参照说明书和文献[10],分别使用50 μLOpti-MEM无血清培养基溶解miR-495 mimics阴性对照、miR-495 mimics,同时使用100 μLOpti-MEM无血清培养基溶解2 μL LipofectamineTM2000,配制LipofectamineTM2000溶液,然后各取50 μL与上述miR-495 mimics阴性对照及miR-495 mimics溶液混合,轻轻震荡均匀后,静置20 min,将培养板中完全培养基吸除,加入Opti-MEM无血清培养基,以配制的miR-495 mimics及miR-495 mimics阴性对照LipofectamineTM2000溶液处理细胞,6 h后吸除Opti-MEM无血清培养基,加入新的完全培养基继续培养,24 h后收集各组细胞,重复上述操作5次,收集5份细胞备用。
1.3.3 CCK-8实验检测细胞活力 取上述处于对数生长期的U87细胞,接种在96孔细胞培养板中,密度为每毫升1.0×105个,放入37℃细胞培养箱无菌培养24 h,参照1.3.2中的方法分组并转染细胞,每组设6个重复孔,并设6个孔不接种细胞,只加入完全培养基,做空白对照,转染后继续无菌培养细胞24 h,然后吸除完全培养基,加入新的完全培养基,并每孔加入CCK-8试剂继续培养2 h,放入多功能酶标仪中,测量450 nm波长下各孔吸光度,通过公式:细胞活力(%)=(实验组吸光度-空白对照组吸光度)/(对照组吸光度-空白对照组吸光度)×100%,计算各组细胞活力。
1.3.4 流式细胞术检测细胞凋亡率 1.3.2中收集的1份各组细胞各取含1×106个细胞的细胞悬液,离心5 min(1 000 r·min-1),弃除上清液,采用PBS溶液漂洗细胞沉淀后再次离心,弃除上清液,加入500 μL Binding Buff er+10 μL AnnexinV-FITC+5 μLPI的混合液,轻轻震荡均匀后,37 ℃避光孵育15 min,弃除上清液,加入500 μL PBS溶液,轻轻吹打混匀后,放入流式细胞仪中检测,通过Muticycle AV软件分析所得数据,计算各组细胞凋亡率。
1.3.5 Transwell小室侵袭实验及细胞划痕实验 1)分别检测细胞侵袭、迁移力Transwell小室侵袭实验[11]:Transwell上室中提前加入基质胶,4 ℃包被过夜,在Transwell下室中加入完全培养基,取1.3.2中收集的各组细胞1份,测定其密度后,分组接种在Transwell上室中,每个小室中含细胞1×105个,放入37 ℃细胞培养箱无菌培养24 h,弃去下室培养基及上室内细胞,以PBS漂洗下室细胞后加入4%多聚甲醛固定,然后以结晶紫染液孵育10 min染色后,显微镜下任选5个视野对细胞拍照并计数,重复3次,取平均值。2)细胞划痕实验[11]:取1.3.2中收集的各组细胞1份,测定其密度后,分组接种在6孔细胞培养板中,使用无菌直尺做标地物,以无菌枪头划一条直线,以PBS洗去划痕中细胞后,将细胞放回培养箱中继续培养24 h,显微镜下任选5个视野拍照并计数划痕中细胞,重复3次,取平均值。
1.3.6 qRT-PCR实验检测细胞miR-495和Notch1 mRNA表达水平 取1.3.2中收集的各组细胞1份,以RNAiso Plus分别提取其中总RNA后,参照1.3.1中的方法进行qRT-PCR实验,检测各组细胞中miR-495和Notch1 mRNA表达水平,以U6作为miR-495的内参基因,以GAPDH作为Notch1的内参基因。qRT-PCR引物序列见表1。
1.3.7 免疫印迹实验检测细胞凋亡相关蛋白、EMT相关蛋白及Notch1蛋白表达 取1.3.2中收集的各组细胞1份,以高效RIPA裂解液于冰水浴中裂解,2 h后4℃离心20 min(3 000 r·min-1),弃除上清液,以BCA法测定其中总蛋白浓度后,将各组蛋白调整至同一浓度,每组分别取20 μL加入上样孔中,110 V恒定电压下电泳后湿转,以5%脱脂牛奶室温孵育硝酸纤维膜2 h,封闭膜上蛋白,以兔源Antiβ-actin、Anti-caspase-3、Anti-Bax、Anti-Vimentin、Anti-E-cadherin、Anti-Notch1一抗孵育裁剪下的目的蛋白条带,4℃过夜后使用TBST溶液洗3次,加入羊抗兔二抗孵育,于摇床上室温轻摇2 h后,使用TBST溶液再次洗3次,条带上滴加增强型化学发光剂显色,放入凝胶成像系统中拍照,采用Image Lab软件分析条带上蛋白灰度值,计算出其相对表达量。
1.4 统计学方法
通过软件SPSS 24.0统计分析实验数据,计量数据以平均数±标准差(±s)表示,组间比较使用单因素方差分析,进一步两组之间比较行LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 神经胶质瘤组织和癌旁组织中miR-495表达水平比较
见表2。
表2 神经胶质瘤组织和癌旁组织中miR-495表达水平比较(±s,n= 6)

表2 神经胶质瘤组织和癌旁组织中miR-495表达水平比较(±s,n= 6)
注:与癌旁组织比较,# P<0.05
组别 miR-495/U6癌旁组织 1.01±0.27神经胶质瘤组织 0.42±0.08#
2.2 各组U87细胞活力比较
见表3。
表3 各组U87细胞活力比较(±s,n = 6) %

表3 各组U87细胞活力比较(±s,n = 6) %
注:与对照组比较,# P<0.05
组别 细胞活力对照组 100.00±0.00 miR-495 mimics阴性对照组 98.79±20.05 miR-495 mimics组 47.02±8.73#
2.3 各组U87细胞凋亡情况比较
见图1、表4。

图1 流式细胞术检测各组U87细胞凋亡结果
表4 各组U87细胞凋亡率比较(±s,n = 6) %

表4 各组U87细胞凋亡率比较(±s,n = 6) %
注:与对照组比较,# P<0.05
组别 细胞凋亡率对照组 3.51±0.57 miR-495 mimics阴性对照组 3.49±0.60 miR-495 mimics组 56.72±8.54#
2.4 各组U87细胞迁移情况比较
见图2、表5。

图2 细胞划痕实验检测各组U87细胞迁移结果(×200)
表5 各组U87细胞迁移数比较(±s,n = 6) 个

表5 各组U87细胞迁移数比较(±s,n = 6) 个
注:与对照组比较,# P<0.05
组别 细胞迁移数对照组 203.15±42.56 miR-495 mimics阴性对照组 198.96±50.23 miR-495 mimics组 27.13±6.35#
2.5 各组U87细胞侵袭情况比较
见图3、表6。
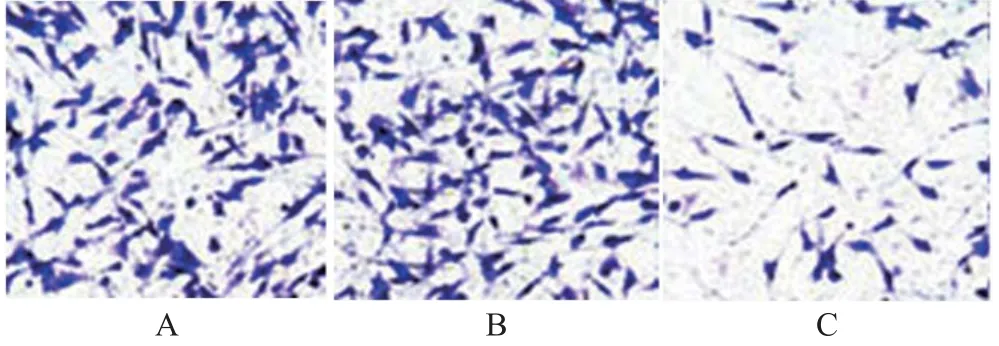
图3 Transwell侵袭实验检测各组U87细胞侵袭结果(×400)
表6 各组U87细胞侵袭数比较(±s,n = 6) 个

表6 各组U87细胞侵袭数比较(±s,n = 6) 个
注:与对照组比较,# P<0.05
组别 细胞侵袭数/个对照组 178.64±35.72 miR-495 mimics阴性对照组 171.57±42.68 miR-495 mimics组 23.69±6.03#
2.6 各组U87细胞凋亡相关蛋白(Caspase-3、Bax)及EMT相关蛋白(E-cadherin、Vimentin)表达水平比较
见表7、图4。
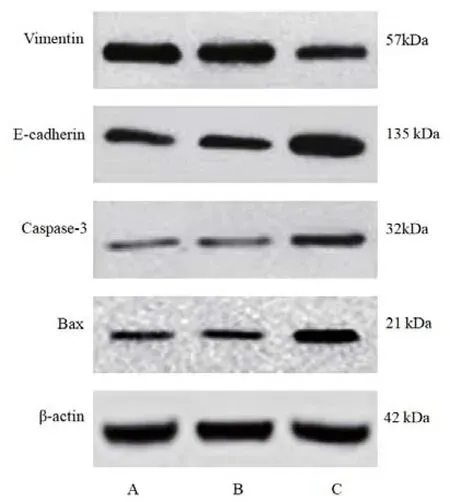
图4 免疫印迹检测各组U87细胞凋亡及EMT相关蛋白表达结果
表7 各组U87细胞凋亡及EMT相关蛋白表达比较(±s,n= 6)

表7 各组U87细胞凋亡及EMT相关蛋白表达比较(±s,n= 6)
注:与对照组比较,# P<0.05
组别 Caspase-3/β-actin Bax/β-actin Vimentin/β-actin E-cadherin/β-actin对照组 0.37±0.06 0.41±0.08 1.31±0.26 0.68±0.13 miR-495 mimics阴性对照组 0.39±0.07 0.42±0.09 1.32±0.28 0.70±0.15 miR-495 mimics组 0.92±0.23# 0.90±0.21# 0.76±0.14# 1.34±0.29#
2.7 各组U87细胞miR-495和Notch1表达水平比较
见图5、表8。
表8 各组U87细胞miR-495和Notch1表达水平比较(±s,n= 6)

表8 各组U87细胞miR-495和Notch1表达水平比较(±s,n= 6)
注:与对照组比较,# P<0.05
组别mRNA相对表达 蛋白相对表达miR-495/U6 Notch1/GAPDH Notch1/β-actin对照组 1.01±0.24 1.02±0.25 0.96±0.18 miR-495 mimics阴性对照组 1.00±0.26 0.99±0.27 0.95±0.17 miR-495 mimics组 2.34±0.52#0.41±0.08# 0.28±0.05#
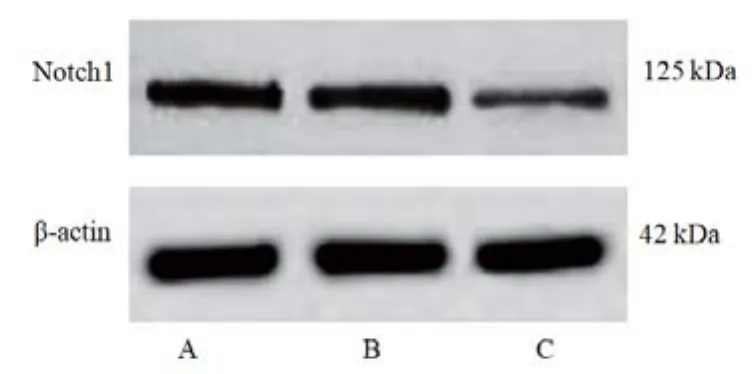
图5 免疫印迹检测各组U87细胞Notch1蛋白表达结果
3 讨论
神经胶质瘤是一种中枢神经系统恶性肿瘤,以生长迅速、侵袭强劲、转移速度快为显著特点,如今临床常用治疗手段为手术后进行放、化疗,但总体疗效并不明显,患者平均生存时间只有约18个月,因此探索新的作用靶点对神经胶质瘤的临床治疗具有重要的价值[12-13]。miR-495是一种抑癌基因,介导人胶质瘤、子宫内膜癌、非小细胞肺癌等多种肿瘤的发生发展[4-6],促进其表达,可明显抑制口腔鳞癌及胃癌细胞的增殖、迁移及侵袭过程[14-15]。另外,miR-495在胶质瘤组织中表达显著下调,并与患者3年总存活率呈正相关,与胶质瘤的恶性程度呈负相关,因而miR-495可作为治疗胶质瘤新的潜在靶点[16]。本研究通过qRT-PCR实验检测神经胶质瘤组织和癌旁组织中miR-495表达水平,结果显示,相比癌旁组织,神经胶质瘤组织中miR-495表达水平显著降低,而以miR-495 mimics提高U87细胞中miR-495表达,可显著降低其细胞活力、迁移和侵袭数、Vimentin蛋白表达,并显著升高细胞凋亡率、Caspase-3、Bax和E-cadherin蛋白表达,表明miR-495可介导人神经胶质瘤的发生发展过程,上调其表达,可抑制胶质瘤细胞增殖,促进其凋亡,并抑制其转移侵袭性。
Notch1是miR-495的一个靶基因,miR-495可负靶向调控Notch1基因表达[9,17],促进高糖诱导的视网膜神经节细胞凋亡,抑制miR-495表达,可保护视网膜神经节细胞免于高糖造成的损伤[17]。另外,Notch1可介导食管癌、宫颈癌、前列腺癌等多种肿瘤的生长过程,下调其表达,可显著降低食管癌细胞活力,抑制其侵袭和迁移;以Notch1抑制剂DAPT处理宫颈癌细胞,可增强顺铂对其的杀伤力;抑制Notch1信号,可明显降低前列腺癌异种移植瘤的生长[18-19]。但miR-495是否通过靶向调控Notch1表达而影响神经胶质瘤细胞的增殖、迁移及侵袭,目前还没有明确阐述,对此进行了初步研究,结果显示,以miR-495 mimics处理U87细胞,可显著降低Notch1 mRNA和蛋白表达,表明miR-495能靶向下调Notch1表达,诱导神经胶质瘤细胞凋亡,降低其细胞活力,并减轻其迁移及侵袭。
综上所述,miR-495可减弱神经胶质瘤细胞增殖活性,促使其凋亡,并降低其侵袭转移能力,靶向下调Notch1表达可能是其作用机制,为神经胶质瘤的临床治疗提供了新的理论依据,并为其找到了一种新的治疗策略,但本研究未通过上调并下调Notch1基因表达来进行对照验证,存在一定不足,后续还应深入研究。

