抗甲状腺抗体对ICIs治疗晚期恶性肿瘤疗效评估价值
闫九玲,孙翠玲,胡文军
(阜阳市人民医院肿瘤科,安徽 阜阳 236000)
恶性肿瘤指细胞突破机体控制,向外异常增生,其特点为由原发部位无限制向周围浸润、扩张,压迫周围组织、器官,最终引起器官衰竭、影响脏器功能,导致患者死亡。流行病学资料显示,我国恶性肿瘤的发生率持续上升,危害严重[1]。新型肿瘤免疫治疗免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)已成为恶性肿瘤治疗的重要手段之一,但仅有少数的晚期恶性肿瘤患者对免疫治疗有应答[2]。因此,发现有效的生物标志物应用恶性肿瘤治疗尤为重要。甲状腺自身抗体是身体自身免疫系统失调产生的某些免疫球蛋白,可能对甲状腺造成一定破坏。研究[3-4]指出,针对转移性肾癌患者,在治疗期间甲状腺自身抗体水平较高,提示甲状腺功能异常,甲状腺体自身病变导致的甲状腺激素合成、分泌减少,导致甲状腺功能障碍,出现低代谢状态,可能影响ICIs治疗疗效。但在ICIs治疗期间,甲状腺毒性的发生和甲状腺抗体状态是否可能预测ICIs治疗恶性肿瘤患者的治疗结果尚不清楚[5-6]。本研究探讨抗甲状腺抗体在ICIs治疗晚期恶性肿瘤临床疗效评估的预测价值,报道如下。
1 资料与方法
1.1 一般资料
选择2019年7月-2021年7月本院收治的78例恶性肿瘤患者,男44例,女34例;年龄37~76岁,平均(53.24±5.31)岁;体质量指数(BMI)16.12 ~ 26.21 kg·m-2,平均(23.21±3.12)kg·m-2;吸烟12例,饮酒13例;自身免疫性疾病家族史14例,肝病家族史9例。本研究经医院伦理会审批通过。
1.2 纳入与排除标准
纳入标准:1)经组织学或细胞学证实为恶性肿瘤[7],且为III-IV期,参照《免疫检查点抑制剂治疗恶性肿瘤的PET/CT评价专家共识(2020版)》[8]行ICIs治疗;2)根据RESIT评价标准,至少有1个可测量病灶,包括原发灶、转移灶或淋巴结;3)甲状腺功能正常;4)均接受促甲状腺素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、TPO-Ab、TG-Ab及TR-Ab检查;5)KPS评分60分以上;6)患者均签署知情同意书。排除标准:1)意识不清或精神障碍患者;2)妊娠期或哺乳期女性;3)伴有严重脏器功能障碍者;4)原发性甲状腺相关疾病;5)其他可能影响甲状腺功能的疾病患者。
1.3 方法
1.3.1 资料收集 收集患者性别、体质量指数、年龄、自身免疫性疾病家族史、肝病家族史、吸烟、饮酒、糖尿病、高脂血症、有无接受靶向治疗、高血压、肿瘤类型、ICIs种类、淋巴结转移资料。
1.3.2 TSH、FT3、FT4检测 治疗1个周期后,采用放射免疫分析法检测TSH、FT3、FT4,采用由武汉赛培生物科技有限公司提供的试剂盒,货号分别为SP10791、SP1055、SP10802,按说明书操作,采用电化学发光全自动免疫分析仪(罗氏公司,型号:Cobase 601)进行检测。
1.3.3 抗甲状腺过氧化物抗体、甲状腺球蛋白抗体、甲状腺刺激性免疫球蛋白检测 治疗1个周期后,抽取空腹静脉血4 mL,离心,分离,采用酶联免疫吸附实验检测抗甲状腺过氧化物抗体(TPO-Ab)水平,试剂盒由上海酶联生物科技有限公司提供,货号为ml025777;采用化学发光法检测甲状腺球蛋白抗体(TG-Ab)、甲状腺刺激性免疫球蛋白(TR-Ab)水平,试剂盒由上海酶联生物科技有限公司提供,货号分别为ml059945、ml060015。采用美国雅培公司的Abbott Axsym化学发光免疫分析仪进行检测。
1.3.4 ICIs治疗 患者均接受至少3个周期ICIs。ICIs治疗包括使用PD-1/PD-L1抗体。
1.4 疗效评估
采用实体肿瘤疗效评价标准进行评估[9]。完全缓解:所有的症状、体征完全消失至少4周;部分缓解:目标病灶最长径缩小≥30%或病灶最大直径和最大垂直径的乘积缩小≥50%,体征完全消失至少4周、疾病稳定:病情无明显变化至少4周,估计肿瘤大小减少<50%,疾病进展:有新病变出现,或原有病变估计>25%。治疗客观有效率=(完全缓解+部分缓解)例数/总例数×100%。
1.5 统计学方法
采用SPSS 20.0进行数据分析,计数资料以例(%)表示,χ2检验;计量资料以均数±标准差(±s)表示,t检验,采用Logistic回归分析治疗1个周期后ICIs治疗效果的影响因素,绘制受试者工作特征(ROC)曲线以分析治疗1个周期后不同指标预测ICIs治疗恶性肿瘤临床疗效的效能,以非参数秩和法检验曲线下面积(AUC)差异。以P<0.05表示差异具有统计学意义。
2 结果
2.1 ICIs治疗恶性肿瘤临床疗效结果
在ICIs治疗恶性肿瘤3个周期后,完全缓解6例、部分缓解42例、疾病稳定20例、疾病进展10例,ICIs治疗客观有效率为61.53%(48/78)。
2.2 ICIs治疗恶性肿瘤临床患者TSH、FT3、FT4、TPO-Ab、TG-Ab及TR-Ab水平比较
治疗1个周期后,ICIs治疗有效患者FT3、TPO-Ab、TG-Ab、TR-Ab水平均低于治疗无效患者(P<0.05),见表1。
表1 ICIs治疗恶性肿瘤临床患者TSH、FT3、FT4、TPO-Ab、TG-Ab及TR-Ab水平比较(±s )
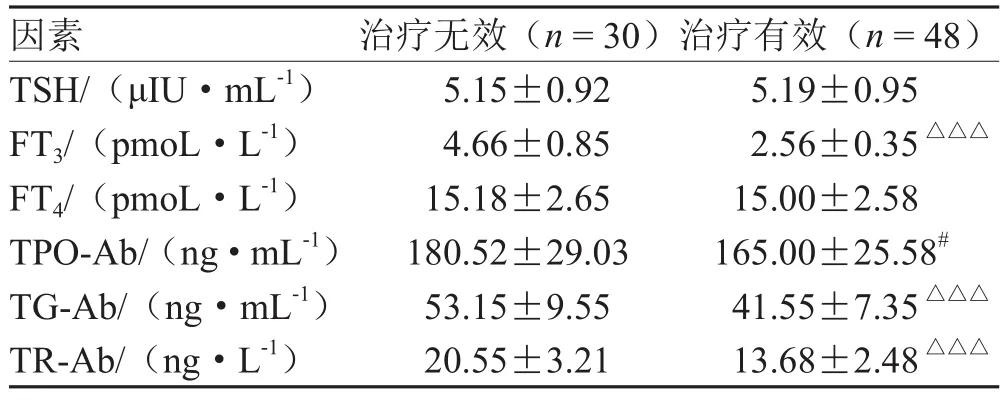
表1 ICIs治疗恶性肿瘤临床患者TSH、FT3、FT4、TPO-Ab、TG-Ab及TR-Ab水平比较(±s )
注:与治疗无效比较,# P<0.05,△△△P<0.001
因素 治疗无效(n = 30)治疗有效(n = 48)TSH/(μIU·mL-1) 5.15±0.92 5.19±0.95 FT3/(pmoL·L-1) 4.66±0.85 2.56±0.35△△△FT4/(pmoL·L-1) 15.18±2.65 15.00±2.58 TPO-Ab/(ng·mL-1) 180.52±29.03 165.00±25.58#TG-Ab/(ng·mL-1) 53.15±9.55 41.55±7.35△△△TR-Ab/(ng·L-1) 20.55±3.21 13.68±2.48△△△
2.3 TPO-Ab、TG-Ab、TR-Ab水平与ICIs治疗恶性肿瘤临床疗效的关系
ICIs治疗无效患者女性、自身免疫性疾病家族史、肝病家族史、吸烟、饮酒、糖尿病、高脂血症、高血压人数、鳞状细胞癌、腺癌、程序性死亡配体(PD-L1)、淋巴结转移、接受靶向治疗人数占比高于治疗有效患者,治疗无效患者FT3、TPO-Ab、TG-Ab、TR-Ab均高于治疗有效患者,差异具有统计学意义(P<0.05)。见表2。经Logistic回归分析,结果显示FT3、TPO-Ab、TG-Ab、TR-Ab、淋巴结转移均是ICIs治疗恶性肿瘤临床疗效的影响因素(P<0.05)。见表3。
表2 2组可能影响因素对比(±s ) 例(%)
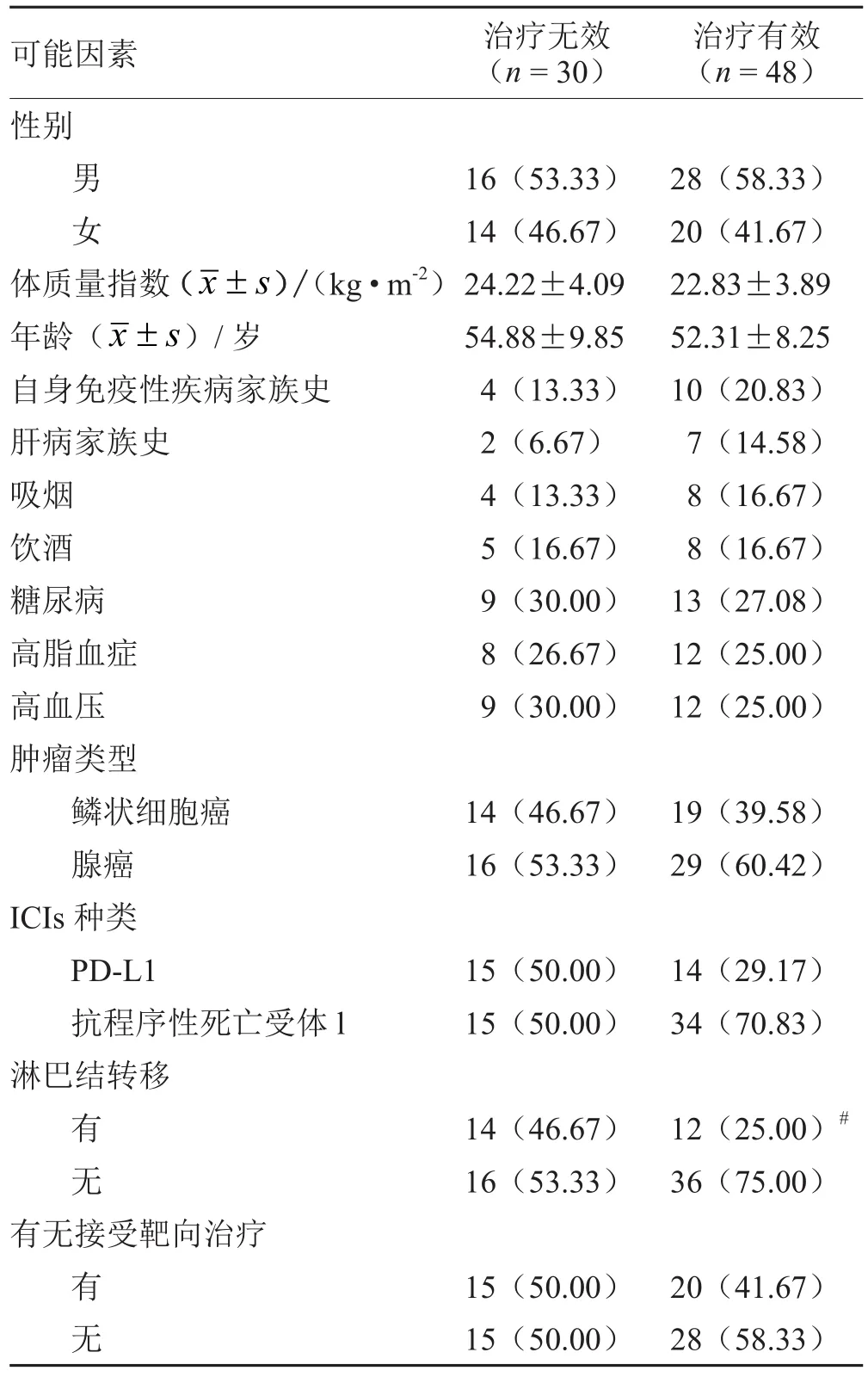
表2 2组可能影响因素对比(±s ) 例(%)
注:与无淋巴结转移比较,# P<0.05
可能因素 治疗无效(n = 30)治疗有效(n = 48)性别男16(53.33) 28(58.33)女14(46.67) 20(41.67)体质量指数(images/BZ_39_658_1237_687_1274.png±s )/(kg·m-2)24.22±4.09 22.83±3.89年龄(images/BZ_39_658_1237_687_1274.png±s )/岁 54.88±9.85 52.31±8.25自身免疫性疾病家族史 4(13.33) 10(20.83)肝病家族史 2(6.67) 7(14.58)吸烟 4(13.33) 8(16.67)饮酒 5(16.67) 8(16.67)糖尿病 9(30.00) 13(27.08)高脂血症 8(26.67) 12(25.00)高血压 9(30.00) 12(25.00)肿瘤类型鳞状细胞癌 14(46.67) 19(39.58)腺癌 16(53.33) 29(60.42)ICIs种类PD-L1 15(50.00) 14(29.17)抗程序性死亡受体l 15(50.00) 34(70.83)淋巴结转移有14(46.67) 12(25.00)#无16(53.33) 36(75.00)有无接受靶向治疗有15(50.00) 20(41.67)无15(50.00) 28(58.33)
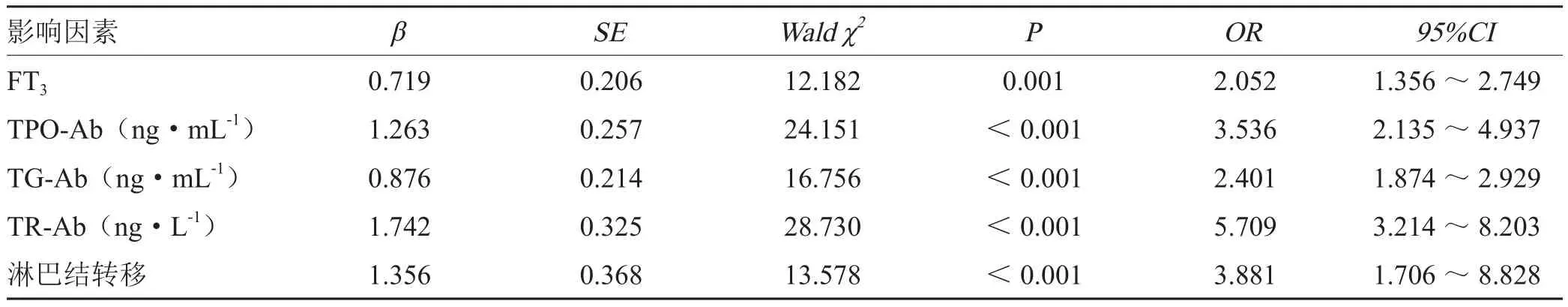
表3 Logistic多元回归分析
2.4 TPO-Ab、TG-Ab、TR-Ab对ICIs治疗恶性肿瘤临床疗效的预测价值
TPO-Ab、TG-Ab、TR-Ab联合预测ICIs治疗恶性肿瘤临床疗效的特异度、AUC均高于单独预测(灵敏度:χ2= 4.043,P= 0.009;χ2= 7.680,P= 0.006;χ2= 7.680,P= 0.006;AUC:Z= 5.678,P= 0.009;Z= 1.632,P= 0.002;Z= 2.854,P= 0.003),灵敏度与单独预测对比差异均无统计学意义(χ2=1.364,P= 0.243;χ2= 0.739,P= 0.390;χ2= 0.000,P= 1.000),见表4,图1。
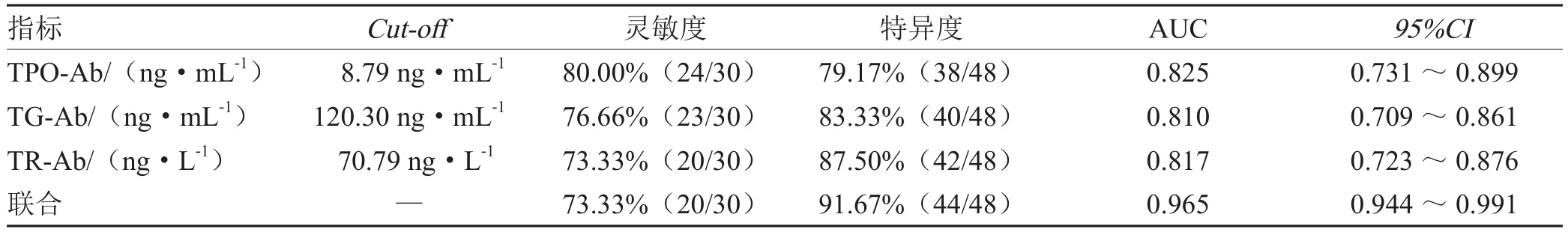
表4 TPO-Ab、TG-Ab、TR-Ab对ICIs治疗恶性肿瘤临床疗效的预测分析

图1 TPO-Ab、TG-Ab、TR-Ab对ICIs治疗恶性肿瘤临床疗效的ROC曲线
3 讨论
恶性肿瘤是主要由控制细胞生长增殖机制失常而引起的疾病。恶性肿瘤的特点是癌细胞无限制、无止境地增殖,压迫、侵犯周围组织及器官,而后通过血液、淋巴道转移至远处组织器官,进而使人体产生一系列症状,常表现为消瘦、无力、贫血以及严重的脏器功能受损等,影响患者的日常生活。近年来,靶向程序性细胞死亡受体和配体的免疫检查点抑制剂改变了晚期癌症的治疗方式。免疫治疗的进展极大地推动了人类抗肿瘤的历程,使部分晚期肿瘤患者实现长期生存,甚至治愈的可能。新型抗肿瘤药物ICIs的应用越来越广泛,但ICIs治疗期间甲状腺抗体状态是否可能预测ICIs治疗患者的治疗效果尚不清楚。有报道[10]指出,ICIs治疗有效率约为51%~63%,本研究中ICIs客观有效率为61.53%,与上述报道数据接近,提示ICIs治疗恶性肿瘤具有一定的临床疗效。本研究进一步探讨抗甲状腺抗体联合检测在ICIs治疗晚期恶性肿瘤临床疗效的相关性,以期指导临床选择ICIs的治疗优势人群,同时观察抗甲状腺抗体在ICIs治疗晚期恶性肿瘤临床疗效评估的预测价值。
本研究结果发现,ICIs治疗有效患者FT3、TPO-Ab、TG-Ab、TR-Ab水平均低于治疗无效患者,提示晚期恶性肿瘤患者的FT3、TPO-Ab、TG-Ab、TR-Ab水平较高。临床研究[11-13]指出,晚期恶性肿瘤患者由于自身组织完整性破坏,血甲状腺素结合抑制物大量渗入血液循环,通过与甲状腺结合球蛋白结合,降低FT3水平。TPO-Ab是临床上常用来检查甲状腺疾病病因的一个抗体。研究[14-16]发现,TPO-Ab作为桥本甲状腺疾病的标志性抗体,通过与TPO-Ab受体结合可诱导晚期恶性肿瘤患者内皮细胞凋亡,引发甲状腺免疫性损伤,其水平表达上升。血清Tg-Ab水平与甲状腺癌的发生与发展密切相关,在甲状腺良性结节和甲状腺癌的鉴别诊断中有重要的临床价值[17]。研究[18-19]指出,恶性肿瘤患者中TR-Ab水平明显增加,可作为肿瘤病变的标志。TR-Ab是一种多克隆抗体,包括甲状腺刺激性抗体和甲状腺刺激阻滞性抗体,TR-Ab在判断晚期恶性肿瘤患者预后方面有着较为广泛地应用。
本研究发现,抗甲状腺抗体TPO-Ab、TG-Ab、TR-Ab均是ICIs治疗晚期恶性肿瘤临床疗效的影响因素,提示抗甲状腺抗体TPO-Ab、TG-Ab、TR-Ab与ICIs治疗晚期恶性肿瘤临床疗效有关。血清TPOAb、TG-Ab增高,提示甲状腺功能减退由自身免疫性甲状腺炎所致,TPO-Ab是临床上常用来检查甲状腺疾病病因的一个抗体,在甲状腺合成过程当中所必需的酶。如果出现甲状腺过氧化物酶抗体,标志着伴有甲状腺功能损害,或者潜在损害。研究[20]表明,TPO-Ab水平在评估ICIs治疗恶性肿瘤临床疗效的发生中具有重要价值。近年来,TPO-Ab水平高表示甲状腺功能亢进,是反映甲状腺功能敏感的指标。在肿瘤病变中,TG-Ab表达水平增加,并且与病情严重程度呈正相关[21]。
本研究发现,TPO-Ab、TG-Ab、TR-Ab联合预测ICIs治疗晚期恶性肿瘤临床疗效的灵敏度和AUC均高于单独预测,特异度则与单独预测相当,提示TPO-Ab、TG-Ab、TR-Ab均对ICIs治疗晚期恶性肿瘤临床疗效具有一定的预测价值,联合预测效能高于各指标单独预测效能。联合预测可从不同层面对患者治疗效果进行评估,提高了预测灵敏度,且特异度并未明显削弱。因此,临床上通过联合监测TPO-Ab、TG-Ab、TR-Ab,有助于对ICIs治疗晚期恶性肿瘤临床疗效进行早期评估。
综上所述,ICIs治疗有效患者甲状腺自身抗体TPO-Ab、TG-Ab、TR-Ab水平均下降,且患者ICIs治疗有效率为61.53%,治疗无效患者TPO-Ab、TGAb、TR-Ab水平均高于治疗有效患者,甲状腺自身抗体TPO-Ab、TG-Ab、TR-Ab联合对ICIs治疗晚期恶性肿瘤患者临床疗效预测效能良好,可有效预测恶性肿瘤的发生。

