α-细辛醚缓解大鼠外周神经痛的作用机制研究
范炜斌 殷炜铭 张小丽 王友梅 卢洪慧 林彬
神经病理性疼痛(neuropathic pain,NP)指体感觉系统损伤或疾病导致的疼痛,通常表现为慢性的持续性或反复性疼痛,其发病率约为6.9%~10.0%[1]。NP成因和机制复杂,现有药物对许多患者的效果并不令人满意[2]。因此,从天然植物中寻找具有潜在抗炎和镇痛作用的新化学物质成为镇痛治疗领域的研究方向。石菖蒲是天南星科菖蒲属植物石菖蒲的干燥根茎,已被证实对多种心血管疾病具有确切的防治作用[3-4]。α-细辛醚是石菖蒲根茎提取物中含量最高的具有药用价值的化合物[5-6],被证实可通过抑制γ-氨基丁酸转氨酶活性以降低γ-氨基丁酸(gamma-aminobutyric acid,GABA)分解代谢,上调谷氨酸脱羧酶67表达使GABA合成增加,上调γ-氨基丁酸A型受体表达以增强GABA介导的抑制功能,发挥抗癫痫作用[7-8]。NF-κB是炎性反应的核心调控分子,活化的NF-κB转位到核内与相关DNA序列结合后诱发下游通路炎症因子,如环氧合酶-2、TNF-α、IL-1等的转录和表达[9]。α-细辛醚可能通过阻断NF-κB的活化来抑制这些炎症因子的表达,从而缓解疼痛[10]。坐骨神经结扎(chronic constriction injury,CCI)大鼠是目前公认的神经病理性疼痛模型[11-12],本研究通过分析α-细辛醚对CCI模型大鼠行为学的影响来探讨α-细辛醚的镇痛作用及其机制,以期为开发新药缓解NP提供参考。
1 材料和方法
1.1 药品和试剂 α-细辛醚购于上海阿拉丁生化科技股份有限公司。BCA蛋白试剂盒购于上海碧云天生物技术有限公司。Rat IL-6 ELISA试剂盒和Rat TNF-α ELISA试剂盒均购于杭州联科生物技术股份有限公司,批号分别为EK306/3-48和EK382/3-48;p65抗体购自Cell Signaling公司,批号:8242S;IL-6抗体购自SANTA公司,批号:SC32296;TNF-α抗体购自Abcam公司,批号:ab205587。将α-细辛醚均匀分散在0.4%吐温-80溶液(国药集团化学试剂有限公司)中,制成1 g/L和5 g/L的混悬液。
1.2 实验动物 24只6~8周雄性SD大鼠,体重约220~260 g,SPF级,购自上海斯莱克实验动物有限公司,合格证号:20170005024951,使用许可证号:SYXK(浙)2015-0008。饲养于20~25℃、相对湿度40%~70%的实验动物房,试验前在动物房环境中适应1周。维持饲料由江苏省协同医药生物工程有限责任公司提供,符合GB14924.3—2010执行标准。
1.3 分组、建模及给药处理 取24只大鼠按随机数字法分成假手术组、溶媒组、低剂量组、高剂量组,每组6只。适应性饲养后,将溶媒组大鼠用水合氯醛腹腔麻醉,取左侧卧位并固定于手术台上,消毒,铺巾,在右股骨下方约1 cm平行于股骨切开皮肤,用小剥离子经股二头肌间隙钝性分离肌肉,暴露坐骨神经,用神经剥离子轻柔将坐骨神经与周围软组织分离;在坐骨神经分成3支前的主干部位游离神经7 mm左右、在距神经起始处(3支分叉处)上方2 mm处,用4.0含铬羊肠线结扎坐骨神经4道,每道间隔约1 mm,被结扎的神经长度为4~5 mm。注意结扎的松紧度,以打结时可见肌肉轻微抽动为准;局部0.9%氯化钠溶液冲洗,间断缝合肌肉筋膜、皮下组织以及皮肤;术毕将大鼠放入鼠笼,于温暖、安静环境自由喂养。低剂量组和高剂量组作相同处理,假手术组除不结扎坐骨神经外,其余同溶媒组。各组大鼠造模当天开始给药,连续灌胃14 d,低剂量组、高剂量组分别给予1 g/L和5 g/L的α-细辛醚混悬液,溶媒组和假手术组均给予0.4%吐温-80溶液,给药剂量均为10 ml/kg。
1.4 机械痛阈测定 采用Von Frey细丝法。造模前,造模后第1、3、5、7、10、14天,用 Von Frey纤维细丝测定大鼠机械性缩足阈值(mechanical paw withdrawal threshold,MPWT)。将大鼠单独置于一带有金属筛网的有机玻璃箱内适应至少20 min,使用Von Frey纤维细丝刺激大鼠右后腿足底中部。大鼠出现快速抬足远离细丝或舔足行为视为阳性反应,反之为阴性反应。当阳性反应或阴性反应出现后,再给予相邻小一级力度或者相邻大一级力度的刺激,如此连续进行5次,每次刺激间隔30 s,记录最后刺激所用的刺激强度值。
1.5 热觉痛阈测定 采用热板法。造模前,造模后第1、3、5、7、10、14天,将大鼠放置于热板仪中适应30 min。之后打开热板仪,控制温度为52℃,放入大鼠的同时开始计时,记下当大鼠出现快速抬右足或舔足行为的时间。每只大鼠测试5次,每次间隔5 min,取平均值。行为学测试结束后,处死各组大鼠,取血清和脊髓,用于后续检测。
1.6 大鼠脊髓p65、IL-6、TNF-α蛋白表达检测 采用Western blot法。将各组大鼠脊髓组织分别放入裂解液中,充分匀浆后4℃11 000 r/min离心20 min,取上清为蛋白样本。参照BCA蛋白试剂盒方法测定大鼠脊髓样本p65、IL-6、TNF-α蛋白相对表达量,以待测蛋白与β-actin的灰度值比值表示。
1.7 大鼠血清IL-6和TNF-α含量检测 采用ELISA法。参照IL-6和TNF-α检测试剂盒方法进行。
1.8 统计学处理 使用GraphPad Prism 5统计软件。计量资料以表示。4组间比较采用单因素方差分析,两两比较采用最小显著差法。P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠机械痛阈的比较 与造模前比较,造模后第1天的假手术组大鼠MPWT轻微降低,溶媒组、低剂量组和高剂量组大鼠MPWT均显著降低,并在第3天降至最小值,表明造模成功。从术后第5天起,与溶媒组相比,低剂量组和高剂量组MPWT开始明显升高(均P<0.05),术后第7~10天MPWT显著增加(均P<0.05),接近假手术组水平。可见给予α-细辛醚连续灌胃减轻了CCI造模所致的神经病理性疼痛,且呈剂量相关性。见表1。
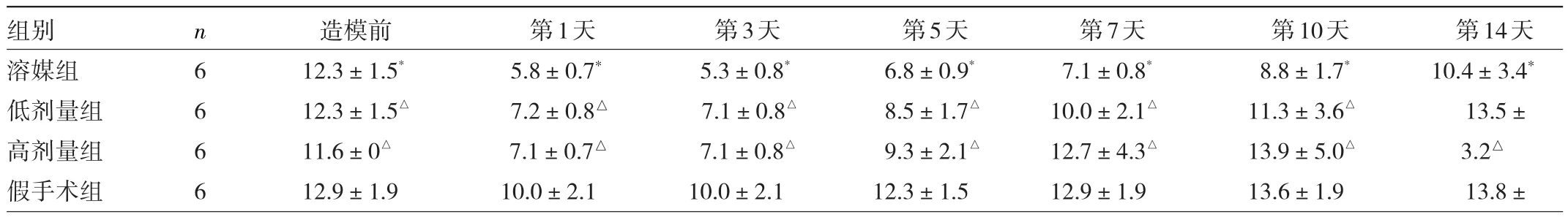
表1 4组大鼠的机械痛阈比较(g)
2.2 4组大鼠热觉痛阈的比较 与造模前比较,造模后第1天假手术组大鼠热觉痛阈有轻微降低,溶媒组、低剂量组和高剂量组大鼠热觉痛阈均显著降低(均P<0.05)。与造模前比较,溶媒组大鼠的热觉痛阈在术后第1天即显著降低,并在第7~14天维持极低值。低剂量组和高剂量组大鼠的热觉痛阈也在第7天降到了极低值,但比溶媒组高。从造模后第10天起,与溶媒组相比,低剂量组和高剂量组热觉痛阈均开始明显升高(均P<0.05),且高剂量组比低剂量组升高更明显,见表2。

表2 4组大鼠的热觉痛阈比较(s)
2.3 4组大鼠脊髓组织中p65、IL-6、TNF-α蛋白表达水平的比较 与假手术组相比,溶媒组p65、IL-6、TNF-α的蛋白相对表达量均显著升高(P<0.01)。与溶媒组相比,低剂量组和高剂量组脊髓组织中p65、IL-6、TNF-α的荧光密度均降低,相比其他3组,高剂量组大鼠脊髓组织中p65、IL-6、TNF-α的蛋白相对表达量显著降低(P<0.01);与溶媒组相比,低剂量组p65蛋白相对表达量显著下调(P<0.05),但两组IL-6和TNF-α的蛋白相对表达量比较,差异均无统计学意义(均P>0.05)。见图1。

图1 4组大鼠脊髓组织中p65、IL-6、TNF-α蛋白表达的比较(a:蛋白电泳图;b-d:蛋白相对表达量)
2.4 4组大鼠血清IL-6和TNF-α质量浓度的比较与假手术组相比,溶媒组IL-6和TNF-α质量浓度均上调,差异均有统计学意义(均P<0.01);与溶媒组相比,低剂量组IL-6和TNF-α质量浓度均下调,差异均有统计学意义(均P<0.05);与溶媒组相比,高剂量组IL-6和TNF-α质量浓度均下调,差异均有统计学意义(均P<0.01),见图2。
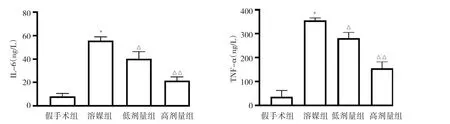
图2 4组大鼠血清样本IL-6和TNF-α质量浓度比较
3 讨论
一直以来,炎症和疼痛的药物治疗存在较大挑战。目前治疗NP的药物主要有抗抑郁药、抗惊厥药、非甾体类抗炎药和阿片类药物等4种,但长期使用易造成药物相关不良事件,显著影响了镇痛治疗的持续性、依从性和有效性,造成患者精神和生理功能的紊乱[13]。伴随着现代药理学与制剂技术的发展,越来越多的研究人员转向传统中草药研究,寻找新的治疗炎症及疼痛的天然药物[14-15]。
炎症是机体应对微生物病原体感染以及物理、化学刺激而发生的生理防御过程,受一系列炎症介质和细胞因子的严格调节;受到疼痛刺激时,机体内单核细胞选择性运输到刺激部位,并分化为促炎巨噬细胞,产生TNF-α、IL-1β、IL-6、IL-10和其他炎症介质来促进组织炎症[16-17]。TNF-α和IL-6是炎症发生时的主要促炎细胞因子,触发初级传入伤害感受器的激活,导致痛觉过敏[18]。
NF-κB信号通路是调节细胞增殖、生长、分化,参与炎症反应的关键信号通路,在慢性炎症疾病和神经病理性疼痛中发挥了重要的调控作用。p65常与核因子κB抑制蛋白α(I-kappa-B-alpha,IκBα)以同源或异源二聚体形式构成炎症主要调节转录因子NF-κB;受到外界刺激时,IκBα通过蛋白酶体途径参与NF-κB和p65的磷酸化,并发生水解,NF-κB易位到细胞核中,随后激活参与细胞生长、分化和存活的多个下游基因的表达[19]。本研究发现:α-细辛醚处理后大鼠脊髓和血清中TNF-α和IL-6相对表达量均显著下调,脊髓中p65相对表达量显著下调。此外,α-细辛醚抑制了CCI诱导的p65磷酸化,进而消除NF-κB作用,抑制IL-6和TNF-α的产生;随剂量加大,抑制程度上升。这提示α-细辛醚可能通过阻断NF-κB信号通路的激活发挥治疗神经病理性疼痛的作用,且具有一定剂量依赖的特性。
α-细辛醚是中国传统药材石菖蒲的主要活性化合物,已被证实具有多种生物学功能[20-21],如抗氧化、抗抑郁、抗焦虑、抗癫痫、抗肿瘤作用等。Sutariya等[10]发现:α-细辛醚对肾病综合征有治疗作用,在多柔比星诱导的肾病综合征中,α-细辛醚能显著抑制蛋白尿,降低胆固醇和甘油三酯并改善肾小球硬化。这种作用也是通过抑制NF-κB通路,下调IL-6、TNF-α等炎症标志物来介导的。
本研究初步证实了石菖蒲提取物α-细辛醚的抗炎活性,其机制可能是通过抑制NF-κB通路,抑制p65、IL-6、TNF-α的表达而产生镇痛作用。α-细辛醚很可能成为镇痛药物的候选药物之一。

