CAR-T免疫疗法在肺癌中的应用研究进展
陈彬羽 沈凯誉 高文仓
免疫疗法被认为是21世纪肿瘤学治疗领域最重要的发现,2018年度诺贝尔生理或医学奖颁给了因发现肿瘤负性免疫调节抑制治疗方法的2位科学家,使得免疫疗法成为当前肿瘤学最活跃的研究领域。嵌合抗原受体 T细胞(chimeric antigen receptor T cell,CAR-T)免疫疗法作为肿瘤免疫治疗的重要组成部分,主要用于血液肿瘤,但用于实体性肿瘤,尤其是肺癌,目前还在探索阶段。为此,本文对目前CAR-T免疫疗法在肺癌中的应用研究进展作一综述,为进一步实验研究及临床研究提供参考依据。
1 CAR-T的结构和功能
CAR-T免疫疗法通过基因工程技术将靶向肿瘤抗原的抗原嵌合受体(chimeric antigen receptor,CAR)引入到自体或异体T细胞内,使T细胞表达靶向肿瘤抗原的CAR,从而特异性识别肿瘤抗原,清除癌细胞,达到临床缓解甚至根治肿瘤的目的,是一种过继性免疫治疗方法。CAR由细胞外抗原结合区、铰链区、跨膜区和细胞内信号转导区4部分组成[1](图1),起着识别肿瘤相关抗原、细胞内信号转导、活化T细胞的作用[2-3](图2)。CAR-T被广泛用于血液系统肿瘤的治疗。如针对CD19靶点的CAR-T可以显著缓解甚至治愈易复发性和难治性B淋巴细胞肿瘤,临床数据显示完全缓解率达68%~93%[4]。在CD19表达较低的急性B淋巴细胞白血病及非霍奇金淋巴瘤则较常表达CD20[5]、CD22[6]等靶点,这种同时靶向双靶点的双特异性CAR-T细胞的出现,克服了单靶点治疗的局限性[7]。随着研究的进展,许多其他的作用靶点也先后被发现,如 CD83[8]、CD47[9]、CD126[10]等。
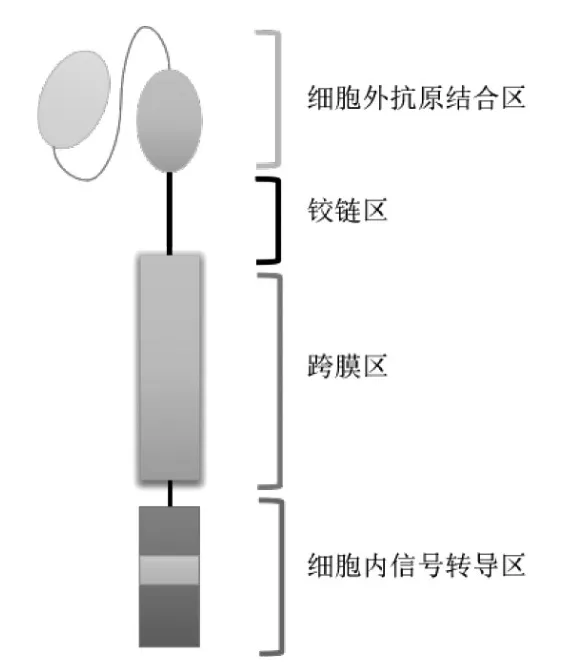
图1 CAR结构

图2 CAR功能
2 CAR-T治疗肺癌的靶点选择
CAR-T治疗肺癌的研究仍处于早期探索阶段,根据不断发现的特异性靶点调整CAR-T结构,现已取得了一些进展。临床试验中非小细胞肺癌(non-small cell lung cancer,NSCLC)等实体瘤的靶向抗原见表1。
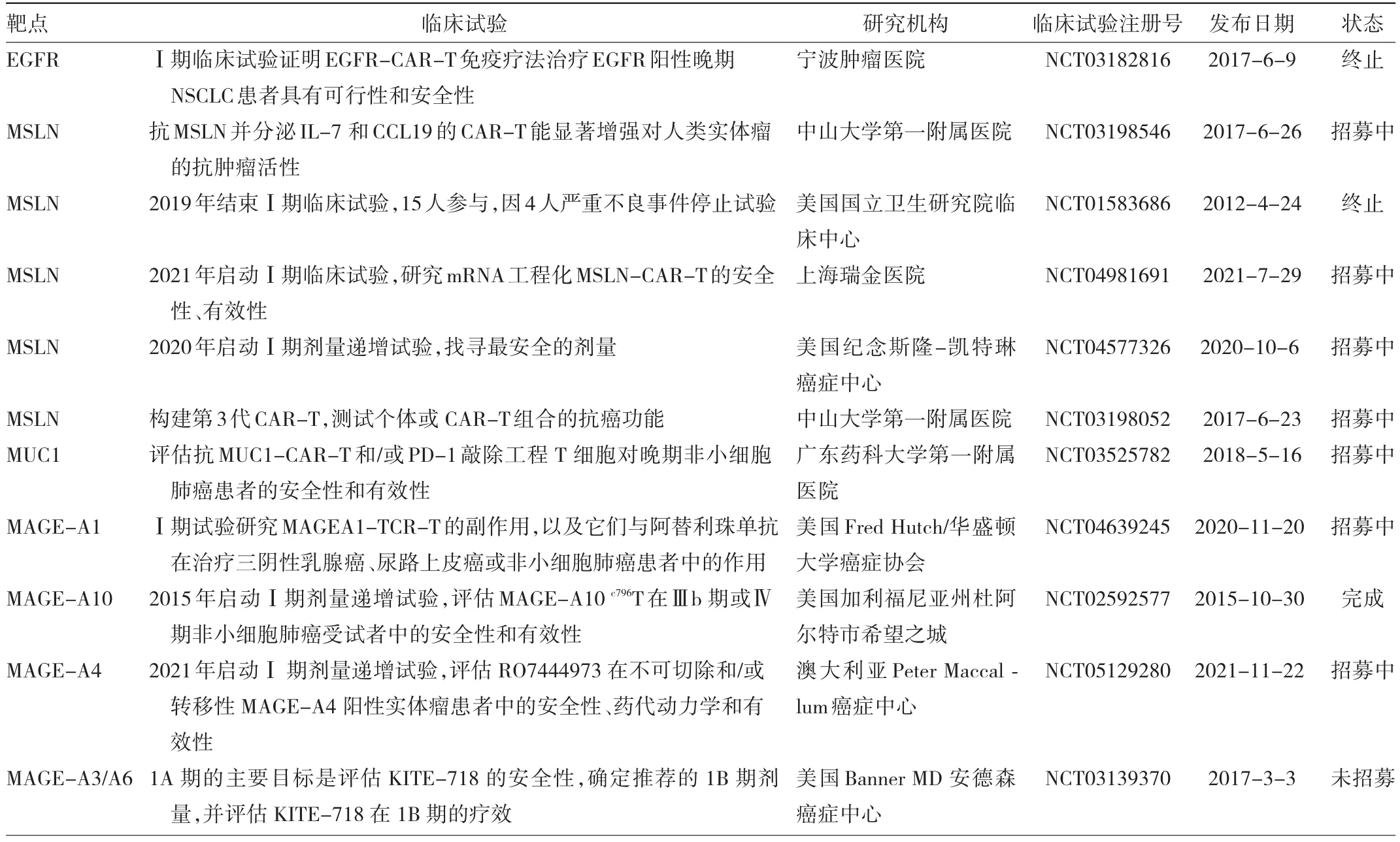
表1 临床试验中NSCLC等实体瘤的靶向抗原
2.1 表皮生长因子受体(epidermal growth factor receptor,EGFR) EGFR是一种糖蛋白受体,活化的EGFR可通过信号转导刺激磷脂酰肌醇激酶-AKT-雷帕霉素靶蛋白-(phosphatidylinositide-AKT-mammalian target of rapamycin,PI3K-AKT-mTOR)、信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等通路,最终导致细胞增殖和癌变[11]。在NSCLC中,大多数的EGFR突变与肿瘤增殖、转移有关[12],目前除可用EGFR-TKI酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)方案治疗外[13],也可以用以EGFR为靶点的CAR-T浸润肿瘤组织。2017年宁波肿瘤医院的一项Ⅰ期临床试验(NCT03182816)对9例晚期复发/难治性EGFR阳性NSCLC患者输注CAR-T后,6例患者病情稳定,2例患者病情恶化,1例患者表现出部分反应并持续了13个月以上。该研究评估了此疗法具可行性和安全性[14]。此外有研究发现:NSCLC患者肿瘤部位趋化因子CXC配体13[chemokine(C-X-C motif)ligand 13,CXCL13]高表达,可与T细胞上表达的趋化因子CXC受体5(C-X-C chemokine receptor type 5,CXCR5)结合。通过设计表达EGFR和CXCR5的CAR-T,证明EGFR-CXCR5-CART具有与EGFR-CAR-T相似的杀伤活性,且添加CXCR5可促进T细胞迁移,为NSCLC患者的治疗提供了新途径[15]。因此,抗EGFR-CAR-T治疗EGFR阳性肺癌患者是有一定疗效的,但其安全性和治疗效果仍需经过更多的临床研究来评估。
2.2 间皮素(mesothelin,MSLN) MSLN是一种细胞表面糖蛋白,在正常组织中低表达,在大多数卵巢癌、胰腺癌、肺癌及恶性间皮瘤等恶性肿瘤中过度表达[16-17],是一种较为理想的CAR-T治疗靶点。多项临床前和临床研究发现:MSLN参与肿瘤的恶性转化,并与肿瘤的侵袭性有明确的关联,导致肿瘤细胞侵袭局部组织并最终转移[18]。Zhao等[19]设计了靶向MSLN的第3代CAR-T(在细胞膜上表达M28z10T蛋白),表达M28z10的T细胞对MSLN阳性肺癌细胞株的抗肿瘤作用增强并延长T细胞的作用时间,在肺癌患者来源的异种移植物中显示出较强的抗肿瘤活性。中山大学第一附属医院2017年注册的一项Ⅰ期临床试验(NCT03198546)将可分泌人类IL-7和趋化因子配体19(chemokine ligand 19,CCL19)(简称7×19)的CART注入表达MSLN的晚期实体瘤患者血液中,其中1例患者在抗MSLN-(7×19)-CAR-T治疗静脉输注后的第240天肿瘤几乎完全消失[20]。美国国立卫生研究院临床中心(NCT01583686)靶向MSLN的CAR-T治疗肺癌转移后肿瘤,15例参与研究,发生贫血1例,淋巴细胞计数减少2例,PLT减少1例,可见MSLN-CAR-T免疫疗法的安全性有待提高,此试验也因进展缓慢于2019年终止。近年来,研究者利用基因工程对CAR-T的结构进行优化,如上海瑞金医院进行的mRNA工程化MSLN-CAR-T的临床试验(NCT04981691)、美国纪念斯隆-凯特琳癌症中心进行的含抗程序性细胞死亡蛋白1成分的MSLN-CAR-T的临床试验(NCT04577326)等正在招聘中。
2.3 黏蛋白(mucoprotein,MUC1) MUC1是一种高分子量(>200 kD)糖蛋白,通常在肿瘤组织中高表达,正常组织中低表达。研究发现:MUC1在肺癌中高表达,且在多个肺癌组织中被发现异常糖基化,帮助癌细胞转移扩散,并与NSCLC患者较差的总生存率相关[21]。中山大学第一附属医院肿瘤团队构建了靶向包括MUC1在内的多种第3代CAR-T,其抗癌功能已通过多种体外和体内实验验证,正在招募个体,就MUC1-CAR-T免疫疗法对晚期难治性实体瘤患者的安全性、耐受性和初步疗效首先进行测试(NCT03198052),将 MUN1联合其他靶点共同治疗肺癌。如Wei等[22]设计了前列腺干细胞抗原(prostate stem cell antigen,PSCA)和MUC1双重定向的CAR-T,可以有效抑制异种移植小鼠的NSCLC肿瘤生长。此外,一项使用MUC1-CAR-T联合敲除程序性死亡因子-1(programmed death 1,PD-1)治疗晚期NSCLC的Ⅰ/Ⅱ期临床研究(NCT03525782)正在进行,以评估此种疗法的安全性和有效性。因此,联合使用靶向MUC1和其他靶点的CAR-T可能协同作用于肺癌的疗效,但联合靶点的选择和治疗方案的安全性还需更多的临床实验进行研究和完善。
2.4 黑色素瘤抗原(melanoma antigen,MAGE) MAGE家族属于肿瘤-睾丸抗原(cancer testis antigen,CTA)中的1个亚家族,其中MAGE-A1是细胞表面抗原,由主要组织相容性复合体(major histocompatibility complex,MHC)分子呈递,介导黑色素瘤细胞的细胞毒性T细胞识别[23-24]。Fanipakdel等[25]对101例肺癌患者的样本进行了横断面研究,发现MAGE-A1在肺腺癌中更常见,可能为潜在的癌症生物标志物。Mao等[26]设计了一种新型MAGE-A1-CAR-T(mCAR-T),这种mCART对体内外所有MAGE-A1阳性的肺腺癌细胞系、肿瘤模型均有显著抑瘤效果。目前,华盛顿大学癌症协会进行靶向MAGE-A1的CAR-T的Ⅰ期临床试验(NCT04639245)正在招募中。针对靶向MAGE-A4、MAGE-A3/A6、MAGE-A10的CAR-T对肺癌等实体瘤的疗效与安全性的临床试验也正在进行(NCT02592577、NCT05129280、NCT03139370)。
随着越来越多的分化抗原被发现在肺癌组织中高度表达,靶向对应抗原的CAR-T也被设计出来,如CD56-CAR-T[27]、 CD47-CAR-T[9]、 B7-H3-CAR-T[28]、CD126-CAR-T[10]等已被证明能在肺癌模型中杀伤和抑制癌细胞,其中利用B7-H3-CAR-T免疫治疗癌症的临床试验(NCT03198052)也正在进行中。虽然一些T细胞参数仍然可以优化,但成功使用CAR-T治疗实体肿瘤已被证明是具有挑战性的,肿瘤内在机制和相关的肿瘤微环境在抑制抗肿瘤反应中同样具有重要作用。
3 CAR-T治疗肺癌面临的问题及展望
3.1 突破肿瘤微环境的干扰 在治疗中,相较于血液系统肿瘤,实体肿瘤还存在肿瘤微环境(tumor microenvironment,TME)和细胞外机制(extracellular matrix,ECM)对CAR-T的干扰。随着肿瘤进展,TME会产生相应变化,如产生免疫检查点抑制CAR-T,导致疗效不佳,甚至出现严重反应。而免疫检查点抑制微环境是引起T细胞耗竭和影响CAR-T免疫应答能力的重要因素。
PD-1和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)是TME中有效抑制T细胞功能的免疫检查点。PD-1是免疫反应的协同抑制因子,可以与程序性死亡配体-1(programmed cell death protein 1,PD-L1)结合减少PD-1阳性细胞的增殖,抑制它们分泌细胞因子并诱导细胞凋亡[29]。Takada等[30]证明PD-L1与肺癌中的男性、吸烟、癌症晚期、血管浸润、鳞状细胞癌组织学和野生型EGFR基因突变呈正相关。抗PD1/PD-L1单克隆抗体通过阻断PD1/PD-L1信号通路,可增强细胞毒性T细胞的杀伤作用[31]。有研究者通过基因编辑设计了1个共表达PD-1的CAR-T,通过产生PD-1抗体,来辅助化疗后获得完全缓解的患者,增强疗效[32]。Pai等[33]开发了一种针对检查点CTLA-4的抗CTLA-4双可变域免疫球蛋白,可消耗肿瘤浸润性而非组织驻留性的调节性T细胞,在保证抗肿瘤功效的同时,降低肿瘤患者的免疫相关不良事件。因此,选择合适的免疫检查点,构建共表达这些免疫相关因子的CAR-T,可很大程度改善TME对CAR-T的干扰。
3.2 细胞因子释放综合征(cytokine release syndrome,CRS) CAR-T免疫疗法虽然有显著的靶向优势,但由于CAR-T作用的持久性和无法轻易逆转而产生的免疫激活,会导致急性全身性炎症反应,甚至危及生命。CRS可以是轻度的,也可以进展为严重低血压、毛细血管渗漏和缺氧,涉及多个脏器功能障碍等重度疾病。轻度CRS患者可对症治疗,对于重度患者,研究表明,托珠单抗是治疗严重或危及生命的CRS的有效方法,可迅速缓解症状[34],早期使用还可降低CRS的发生率。Hong等[35]对81例患者进行了2种不同治疗途径以评估可能诱发CRS的临床特征,研究发现CAR-T组的细胞因子,如IL-6(由激活的巨噬细胞和单核细胞释放)、IL-2、IL-10和γ干扰素IFN-γ的增加更为显著,提示IL-6可能是CRS的主要驱动因素;控制IL-6等细胞因子的产生和释放,可能会降低CRS的发生率。研究者同样也观察到血清粒细胞巨噬细胞刺激因子(granulocyte-macrophage colony-stimulating factor,GMCSF)水平、铁蛋白、CRP指标等异常,但目前还未有早期检测指标来预测患者是否会发生严重的CRS,这也是今后深入研究的方向。
为解决CAR-T免疫疗法造成的不良事件,提高安全性,研究者运用基因编辑技术对CAR结构进行优化改良。Mishra等[10]发现靶向CD126的CAR-T与可溶性白细胞介素 6受体(soluble interleukin 6 receptor,sIL-6R)的结合可以减轻细胞因子释放综合征,表达CD126的CAR-T为许多毒性风险低的肿瘤提供了新的治疗靶点。Chu等[36]使用慢病毒转导产生抗异硫氰酸荧光素(fluorescein isothiocyanate,FITC)的 CAR-T,在体外,抗FITC-CAR-T的选择性激活和增殖严格依赖于叶酸-FITC和叶酸受体表达靶细胞的共存,并且可通过叶酸-FITC开关进行剂量滴定,有效控制CART治疗过程中机体产生的过度免疫,提高CAR-T的反应性和安全性。
综上所述,CAR-T免疫疗法已进入飞速发展阶段,但在实体瘤方面进展缓慢。肺癌的靶点如EGFR、MSLN、MUC1、MAGE等被陆续发现,但大部分停留在基础研究阶段。T细胞、肿瘤细胞和肿瘤微环境间存在相互作用,可诱导免疫抑制,最终抑制抗肿瘤反应。而CAR-T脱靶所产生的毒性,也是如今此种免疫疗法安全性问题的关注重点。改进给药方式、寻找更加准确优质的靶点、利用基因工程优化CAR-T的结构、确定CRS的预测因素等可能有助于解决这些问题。有理由相信,CAR-T免疫疗法将会给广大的肺癌患者带来生存上的获益。

