月季RcNAC72基因的克隆及表达分析
包 颖
生命科学与技术
月季RcNAC72基因的克隆及表达分析
包 颖
(唐山师范学院 生命科学系,河北 唐山 063000)
为揭示月季NAC转录因子的功能,以月季“月月粉”生根的组培苗为材料克隆得到一个基因,命名为。生物信息学分析表明,基因全长为1 672 bp,开放阅读框(ORF)为1 059 bp,可编码353个氨基酸。基因序列比对发现,RcNAC72在N端具有保守的结构域,与草莓FvNAC72-like、桃PpNAC72、梅花PmNAC72-like、苹果MdNAC91蛋白序列分别有88.34%、80.74%、80.70%、79.96%的相似性。系统进化树分析结果表明,RcNAC72与梅花PmNAC72-like、桃PpNAC72、甜樱桃PaNAC72、樱花PsNAC72,亲缘关系较近。实时荧光定量PCR分析表明,高盐、水杨酸、茉莉酸甲酯均可诱导基因上调表达,高盐,水杨酸,高盐与水杨酸共处理时,根系中的相对表达量明显高于叶片。综上推测基因主要在月季根中作为调节因子参与盐胁迫响应。
月季“月月粉”;RcNAC72;基因克隆;表达分析
NAC转录因子家族是近10年新发现的最大的一类植物特有的转录因子[1]。NAC是由NAM、ATAF、CΜC这三者的首字母而命名的,其中NAM基因是在研究矮牵牛的时候被发现的,ATAF1、ATAF2、CΜC2的基因结构与NAM相似,均在研究拟南芥的时候被发现[2-3]。NAC转录因子的C端为氨基酸序列具有高度多样性的转录调控区,能激活转录也能抑制转录。由于转录调控区的结构具有不稳定性,使得NAC蛋白能够与目标蛋白互作,从而使NAC转录因子在植物应答非生物胁迫和病原菌侵染等生物胁迫的过程中起到重要的调控作用[4]。
研究证明,拟南芥类基因可被盐胁迫诱导表达,盐胁迫处理后的拟南芥植株根部组织中33个基因的表达水平发生改变,其中26个基因上调表达,7个基因下调表达[5]。Tyagi等利用水稻基因芯片数据库分析了水稻族基因在高盐、干旱、低温胁迫后的表达水平,发现45个盐胁迫响应基因,其中33个上调表达,12个下调表达[6]。干旱、高盐等逆境胁迫或脱落酸(ABA)能诱导水稻和拟南芥等类基因的表达,而且功能研究也证明这些类基因在抗旱、耐盐反应中具有重要作用[7-8]。
古老月季品种“月月粉”(‘Old Blush')因其为二倍体且是月季育种的重要亲本之一,所以是月季分子生物学研究的重要材料[9]。盐碱地区的环境胁迫严重制约着园林植物景观规划的发展,盐胁迫导致大多数月季品种生长不良、病虫害加重,严重影响月季的生长发育和观赏效果。目前,国内外对月季抗盐性的研究主要集中在生理水平,对于月季耐盐性分子机理研究较少[10]。目前还没有关于月季响应盐胁迫NAC类转录因子的研究报道。因此,克隆类基因,研究其在月季响应盐胁迫的时空表达模式具有重要的理论意义。
本研究利用前期已经完成的月季“月月粉”在盐胁迫下的转录组测序数据[11],筛选获得1个表达水平具有显著性差异的类基因。为验证月季“月月粉”转录因子RcNAC72是否参与盐胁迫逆境应答,我们分析了基因对盐胁迫以及激素(茉莉酸甲酯MeJA和水杨酸SA)的诱导表达模式。同时进一步对月季RcNAC72进行生物信息学分析,预测其生物学功能。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
月季“月月粉”购自昆明杨月季园艺有限责任公司。将其栽植于唐山师范学院温室内,并进行扦插繁殖。选取生长健壮、无病虫害、植株大小一致的“月月粉”当年生扦插苗作为实验材料。
1.1.2 试剂
月季总RNA提取采用EASY spin植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司);反转录采用Prime Script® RT reagent Kit With gDNA Eraser(Perfect Real Time)试剂盒,(宝生物工程(大连)有限公司)Real time- PCR荧光染料混合液SYBR® Premix Ex Taq™(宝生物工程(大连)有限公司)。
1.2 实验方法
1.2.1 总RNA提取与cDNA合成
RNA的提取采用EASY spin植物RNA快速提取试剂盒;利用Roche公司反转录试剂盒获得cDNA。上述操作过程均按照试剂盒说明书进行。
1.2.2 RcNAC72基因的克隆
利用月季“月月粉”cDNA序列为模板设计CDS全长扩增引物(详见表1)并进行PCR扩增。PCR反应体系为10×KOD Buffer 5 μl;MgSO4 3 μl;dNTPs 5 μl;cDNA 1 μl;上下游引物各1.5 μl;KOD Plus高保真酶1 μl;用无菌ddH20补齐至20 μl。混匀离心后于PCR仪中进行扩增。PCR反应程序:94 ℃ 2 min;94 ℃ 15 s,56.1 ℃ 30 s,68 ℃ 1 min以上程序35个循环;68 ℃ 5 min;4℃反应终止。将PCR产物进行琼脂糖凝胶电泳检测,利用TaKaRa Mini BESTAgarose Gel DNA Extraction Kit试剂盒(大连TaKaRa公司)回收目的条带,并与pMD18-T载体连接。连接产物转化大肠杆菌,蓝白斑筛选,挑取白色单菌落鉴定,根据菌落PCR结果,将鉴定出的阳性克隆交由诺赛生物工程有限公司测序。
1.2.3 月季转录因子RcNAC72的生物信息学分析
根据本课题组前期月季“月月粉”盐胁迫转录组测序结果和月季全基因组数据[12],获取基因CDS和基因全长序列。根据所获得的基因的cDNA和基因全长序列,使用DNAMAN软件分析RcNAC72氨基酸序列同源性;使用clutaLX进行氨基酸序列比对分析,使用MEGA 6.0软件进行系统进化树分析。
1.2.4 胁迫处理
选取根系生长健壮的“月月粉”幼苗,用1/2的营养液水培缓苗一周。之后用全Hoagland营养液进行盐胁迫(200 mmol·L-1NaHCO3)、激素处理(1 μmol·L-1MeJA,200 μmol·L-1SA)、盐与激素共处理(200 mmol·L-1NaHCO3+1 μmol·L-1MeJA,200 mol·L-1NaHCO3+200 μmol·L-1SA),每个处理分别于处理后0 h、2 h、6 h、12 h、2 4 h、48 h进行月季根系和叶片的取样,并置于-80 ℃冰箱中保存备用。每个处理5株,3次重复。本实验中盐处理浓度参照丁晗[13]的方法,MeJA处理浓度参照严加坤等[14]的方法,SA处理浓度参照付乃鑫等[15]的方法。
1.2.5 实时荧光定量PCR分析
采用软件Primer5.0设计的实时荧光定量引物,内参基因为,引物序列见表1。

表1 实验中所用的引物
利用ABI7500荧光定量PCR仪检测基因的表达量。20 μL反应体系:3 μl cDNA模板,1 μl上游引物,1 μl下游引物,10 μl SYBR®Premix Ex Taq II(2×),5 μl ddH2O。反应程序为:94 ℃,30 s;94 ℃,5 s;60 ℃,2 min;40个循环。每处理进行3次生物学重复和3次平行样重复。相对表达量采用2-ΔΔCt法计算,其中:
∆t=t,RcMYB102-tRcActin
ΔΔt=Δt(h)-Δt(0)
所有数据均用SPSS软件进行统计分析。
2 结果与分析
2.1 月季RcNCA72生物信息学分析
根据前期盐胁迫转录组测序数据和月季全基因组数据,获得了月季72基因的cDNA和基因序列全长(图1)。
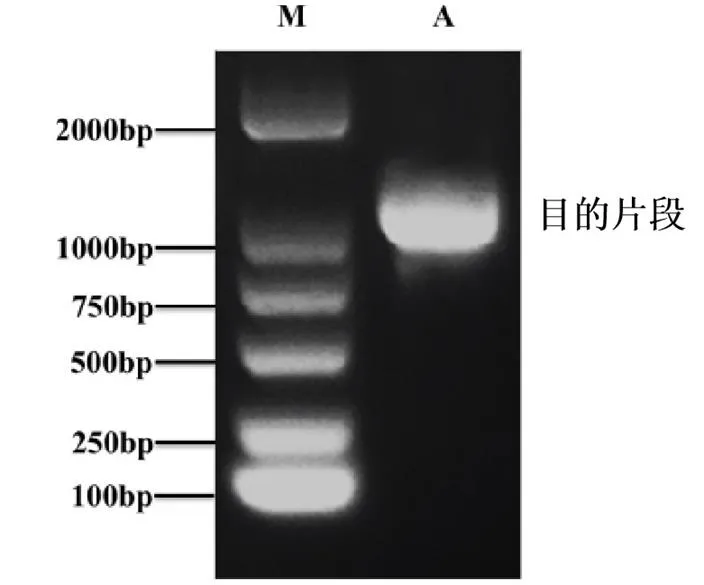
M: DNA分子量标记;A: RcNAC72基因PCR扩增产物

图2 RcNAC72与其他植物NAC类同源蛋白序列多重比对
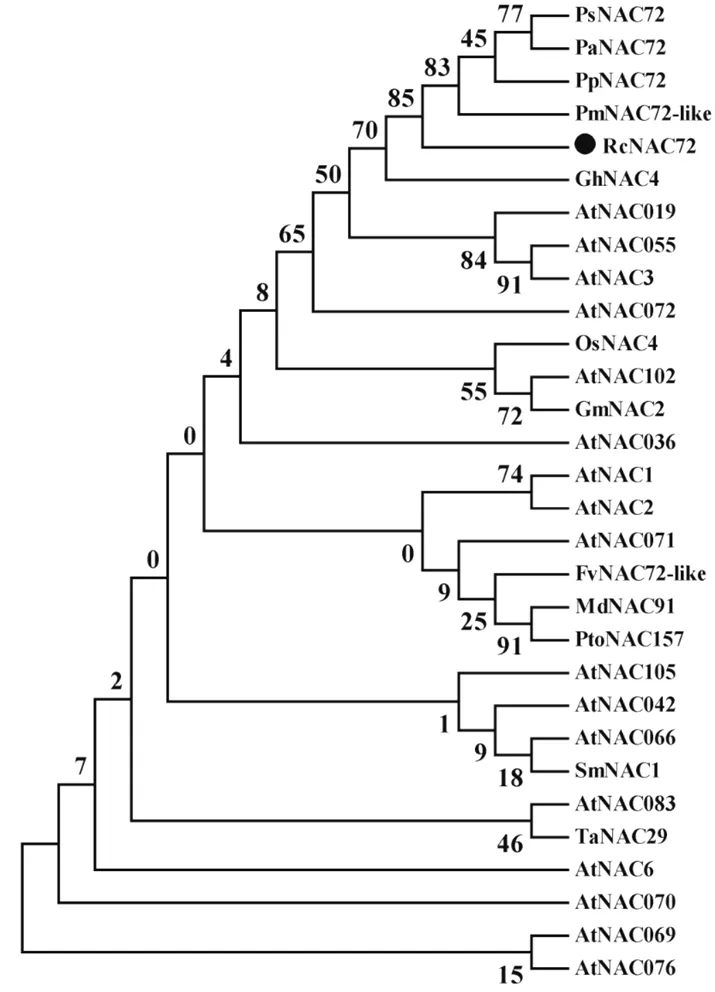
图3 月季RcNAC72与其他物种的系统进化树
测序结果表明,基因全长1 672 bp,开放阅读框(ORF)1 059 bp,编码353个氨基酸。利用DNAMAN软件对RcNAC72蛋白序列进行同源性比对分析表明,RcNAC72蛋白序列与同科的草莓FvNAC72-like、桃PpNAC72、梅花PmNAC72- like、苹果MdNAC91蛋白序列分别有88.34%、80.74%、80.70%、79.96%的相似性;利用clutaLX软件进行氨基酸序列比对分析表明RcNAC72存在N-端保守氨基序列(如图2所示)。利用MEGA 6.0软件构建RcNAC72蛋白与其他植物的NAC类蛋白的氨基酸序列进化树结果表明,RcNAC72与梅花PmNAC72-like、桃PpNAC72、甜樱桃PaNAC72、樱花PsNAC 72处于同一分支,亲缘关系较近(如图3所示)。
2.2 月季RcNAC72在不同处理下的表达模式分析
盐胁迫、外源激素SA和MeJA处理均能诱导基因的上调表达(图4)。
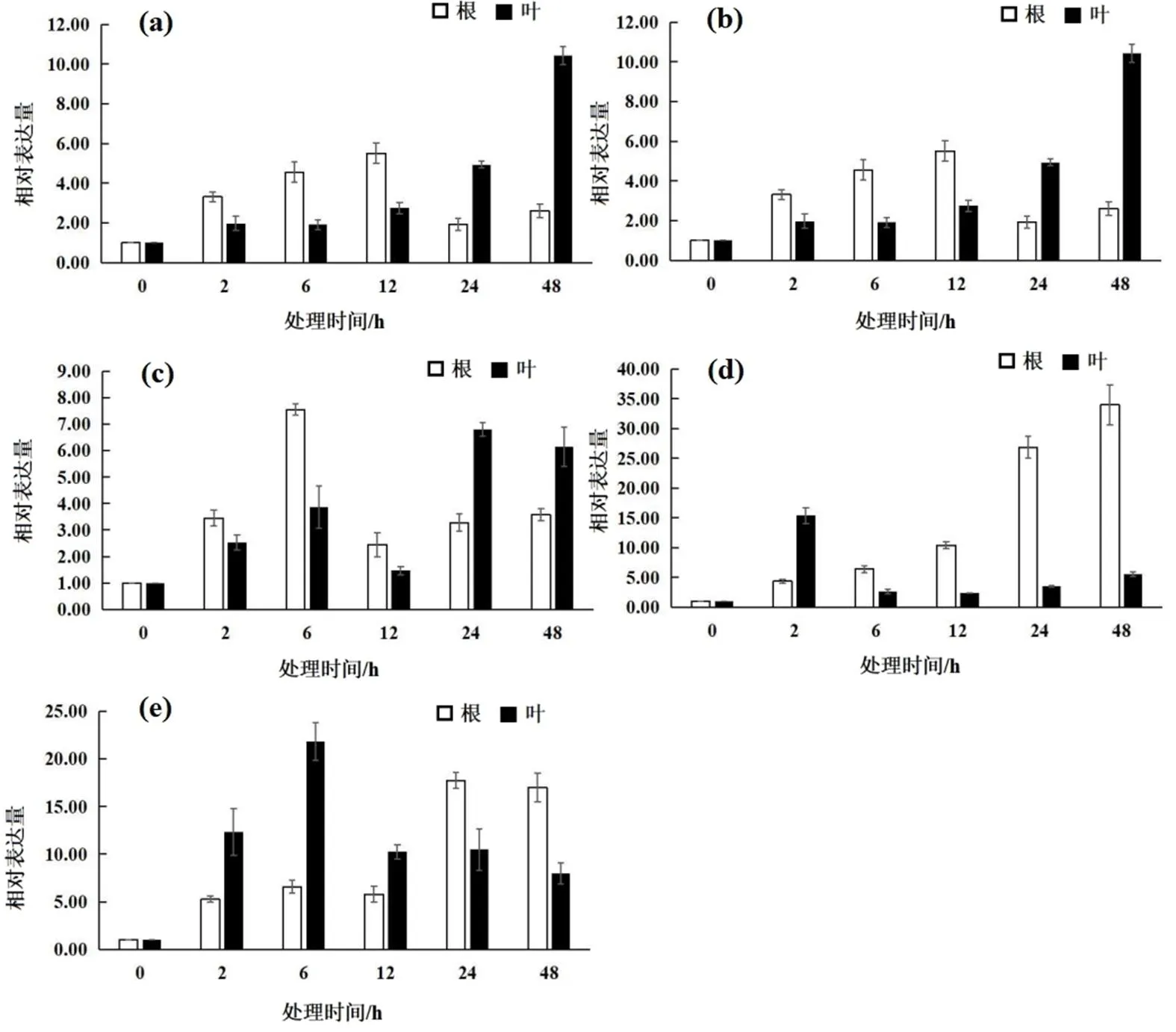
a: 盐胁迫处理;b: 水杨酸处理;c: 茉莉酸处理;d: 盐与水杨酸共处理;e: 盐与茉莉酸共处理
研究结果显示,在高盐处理下,根与叶中基因相对表达量均呈显著上升趋势,在处理48 h达到峰值,分别为对照的25.38倍和25.42倍。在外施水杨酸处理下,根中基因相对表达量在12 h达到峰值,为对照组的5.51倍,随后下降;叶中基因相对表达量在48 h达到峰值,为对照组的10.44倍。在外施MeJA处理下,叶中基因相对表达量在6 h达到峰值,为对照组的7.55倍,而根中基因相对表达量在24 h达到峰值,为对照组的6.80倍。高盐与SA共处理下,根与叶中基因相对表达量均呈显著上升趋势,且根中基因相对表达量较单独处理显著升高。高盐与MeJA共处理下,根中基因相对表达量在24 h达到峰值,为对照组的17.70倍;叶中基因相对表达量在6 h达到峰值,为对照组的21.82倍。上述结果表明,基因在叶和根中的表达模式存在明显的差异,并且高盐、SA、高盐与SA共处理时,根中的相对表达量明显高于叶片中,推测基因主要在月季根中起到重要作用。
3 讨论
盐胁迫不仅会导致植株产生多种表型变化,如植物失水、黄化、落叶和萎蔫,还会引起植物体内的生理变化,如活性氧的过度积累加速了植物萎蔫[16]。植物通过信号转导、光合作用和能量代谢等生物途径调节对盐胁迫的反应。植物应对环境中各种非生物胁迫的方式复杂而有序,而转录因子调控是其中一种重要的途径。研究表明NAC家族在植物的生长发育过程以及响应非生物胁迫的过程中起着重要的调节作用[17]。随着研究的不断深入,越来越多的报道证实NAC转录因子与植物响应高盐胁迫密切相关[18-20]。
沙柳基因在盐胁迫和高温胁迫下均可应答,且较为显著[21]。郭文芳等研究发现柚和柠檬对低温、干旱、高盐和脱落酸(ABA)等胁迫的响应都较敏感,表达量均有明显变化,且在干旱和高盐胁迫时和表达随时间推移呈逐渐上升趋势[22]。邵帅等研究表明茄子在受赤霉素(GA)、低温和高盐诱导后上调表达,且在根中优先表达,这一表达模式与本研究结果相似[23]。一些植物激素在盐胁迫响应过程中也起着重要的调节作用,在盐胁迫条件下,苹果MdNAC047直接与乙烯启动子结合并激活其转录,增加了乙烯反应基因的表达,从而增强了苹果对盐胁迫的耐受性[24]。吉璐研究发现南荻基因在高盐、干旱、MeJA和SA诱导下都上调[25]。拟南芥AtNAC055和AtNAC019均可响应茉莉酸的应答。在本研究中,RcNAC72响应SA应答较MeJA更为敏感。
综上,本研究从月季“月月粉”中克隆分离了一个与盐胁迫应答相关的转录因子编码基因,并对其序列结构和表达模式进行了初步研究。本研究结果为研究基因的盐胁迫分子机制和耐盐功能提供了依据,同时为利用基因工程技术改良月季抗逆性提供了基础数据。
[1] Nakashima K, Takasaki H, Mizoi J, et al. NAC trans- cription factors in plant abiotic stress responses[J]. BBA Gene Regul Mech, 2012, 1819(2): 97-103.
[2] Souer E, Houwelingen A, Kloos D, et al. The no apical meristem gene of petunia is required for pattern formation in embryos and flowers and is expressed at meristem and primordial boundaries[J]. Cell, 1996, 85(2): 159-170.
[3] Aida M, Ishida T, Fukaki H, et al. Genes involved in organ separation in: ananalysis of the cup-shaped cotyledon mutant[J]. Plant Cell, 1997, 9(6): 841-857.
[4] 潘凌云,马家冀,李建民,等.植物盐胁迫应答转录因子的研究进展[J].生物工程学报,2022,38(1):1-16.
[5] Jiang Y Q, Deyholos M K. Comprehensive transcriptional profiling of NaCl-stressedroots reveals novel classes of responsive genes[J]. BMC Plant Biol, 2006, 25(6): 25-32.
[6] Almeida DM, Almadanim MC, Lourenço TAbreu IA, et al. Screening for abiotic stress tolerance in rice: salt, cold, and drought. environmental responses in plants[J]. Methods in Molecular Biology, 2016, 1398(2): 155-182.
[7] Hu HH, You J, Fang Y J, et al. Characterization of transcription factor gene SNAC2 conferring cold and salt tolerance in rice[J]. Plant Mol Biol, 2008, 67(2): 169-181.
[8] Takasaki H, Maruyama K, Kidokoro S,et al. The abiotic stress-responsive NAC-type transcription factor OsNAC5 regulates stress-inducible genes and stress tolerance in rice[J]. Mol Genet Genomics, 2010, 284(3): 173-183.
[9] 晏慧君.月季丁香酚合成酶基因RcEGS1的功能研究[D].昆明:云南大学,2019:14-16.
[10] 思妮.耐盐月季的选育及表达拟南芥AtDREB2A-CA对月季耐盐性的研究[D].天津:天津大学,2012:40-42.
[11] Bao Y, Chen C, Fu L, et al. Comparative transcriptome analysis of‘Old Blush’ provides insights into the crucial factors and signaling pathways in salt stress response[J]. Agronomy Journal, 2021, 113(4): 3031-3050.
[12] Raymond O, Gouzy J, Just J, et al. The rosa genome provides new insights into the domestication of modern roses[J]. Nature Genetics, 2018, 50(4): 772.
[13] 丁晗.野生玫瑰耐盐相关基因RrNHX1和RrVHA-c的克隆与表达分析[D].扬州:扬州大学,2014:44-45.
[14] 严加坤,严荣,汪亚妮.外源茉莉酸甲酯对盐胁迫下玉米根系吸水的影响[J].广东农业科学,2019,46(1):1-6.
[15] 付乃鑫,贺明荣,诸葛玉平,等.外源SA对盐胁迫下冬小麦幼苗生长的缓解效应及其机理[J].中国农业大学学报,2019,24(3):10-17.
[16] 包颖,魏琳燕,陈超.水杨酸和茉莉酸甲酯对盐胁迫下月季品种月月粉生理特性的影响[J].云南农业大学学报(自然科学),2020,35(6):1040-1045.
[17] 张丹,马玉花.NAC转录因子在植物响应非生物胁迫中的作用[J].生物技术通报,2019,35(12):144-151.
[18] Puranik S, Bahadur R P, Srivastava P S, et al. Molecular cloning and characterization of a membrane associated NAC family gene, SiNAC from foxtail millet [(L.) P. Beauv.] [J]. Mol Biotech, 2011, 49(2): 138- 150.
[19] 刘彬,曹尚杰,王营,等.过表达细叶百合LpNAC6基因增强烟草的耐盐性[J].北京林业大学学报,2020,42(4):69- 79.
[20] 翟玲侠,于崧,侯玉龙,等.芸豆盐碱响应NAC转录因子的分子特性分析[J].华北农学报,2021,36(6):16- 25.
[21] 杨海峰,薄高峰,于兴旺,等.沙柳SpsNAC042基因克隆及逆境表达分析[J].西北林学院学报,2021,36(5):11-17.
[22] 郭文芳,刘德春,杨莉,等.柑橘抗逆基因NAC83的克隆与表达分析[J].园艺学报,2015,42(3):445-454.
[23] 邵帅,徐岭贤,王绍辉,等.茄子SmNAC1基因的克隆与表达分析[J].园艺学报,2014,41(5):975-984.
[24] An J P, Yao J F, Xu R R, et al. An apple NAC transcription factor enhances salt stress tolerance by modulating the ethylene response[J]. Physiol Plant, 2018, 164(3): 279-289.
[25] 吉璐.南荻抗逆相关NAC转录因子的克隆及功能鉴定[D].长沙:湖南农业大学,2013:29-30.
Gene Cloning and Expression Analysis of
BAO Ying
(Department of Life Sciences, Tangshan Normal University, Tangshan 063000, China)
In order to reveal the function of the NAC transcription factor in, an NAC gene namedwas cloned from root fissue culture of“Old Blush”. Bioinformatics analysis showed that the full length ofgene was 1 672 bp, and the open reading frame (ORF) was 1 059 bp, encoding 353 amino acids. Sequence alignment revealed that RcNAC72 had a conserved domain at the N-terminal, and its protein sequences were 88.34%, 80.74%, 80.70% and 79.96% similar to those of FvNAC72-like, PpNAC72, PmNAC72-like and MdNAC91, respectively. The results of phylogenetic tree showed that RcNAC72 was phylogenetically closed to PmNAC72-like, PpNAC72, PaNAC72 and PsNAC72. Real-time fluorescence quantitative analysis showed that high salt, salicylic acid, methyl jasmonate could induce the increasing expression of. Theexpression level ofgene in roots was significantly higher than that in leaves. In conclusion,gene mainly acts as a regulatory factorinrootsin response to salt stress.
; RcNAC72; gene cloning; expression analysis
S688
A
1009-9115(2022)03-0044-06
10.3969/j.issn.1009-9115.2022.03.013
河北省自然科学基金面上项目(2021105002),唐山师范学院校内科研项目(2022C54)
2021-12-18
2022-03-17
包颖(1983-),女,河北廊坊人,博士,讲师,研究方向为月季遗传育种与逆境分子生物学。
(责任编辑、校对:范永山)

