体外细胞模型实验探讨钠钾氯同向转运体对血脑屏障渗透性的调控机制
张泽瀚,陶丙岩,张 鼎,张 军
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 神经外科,北京 100853
血脑屏障(blood brain barrier,BBB)的破坏是创伤性颅脑损伤(traumatic brain injury,TBI)的核心特征之一[1]。血脑屏障是一种特殊的、选择性透过的屏障,对于维持大脑内环境稳态至关重要。它由血管内皮细胞、基底膜、周细胞、星形胶质细胞和小胶质细胞组成[2]。当TBI发生时,其直接损伤造成脑血管内皮细胞之间紧密连接中断,随后神经炎症、兴奋性中毒、氧化应激和离子稳态破坏相继出现,对血脑屏障完整性造成进一步破坏[3-4]。研究表明,血脑屏障的破坏是导致脑损伤、感染和长期神经元缺陷的重要原因,其损伤程度与患者不良预后密切相关[5]。此外,血脑屏障破坏诱发的血管源性水肿与TBI后颅内高压密切相关,加剧了脑组织外部的水分向脑组织内部转移的过程[6]。因此最大程度减轻血脑屏障的损伤对于治疗TBI具有十分重要的意义。钠钾氯同向转运体Ⅰ型(Na+-K+-2Cl-,NKCC1)是中枢神经系统中广泛分布的细胞膜离子转运蛋白,在神经元、神经胶质、毛细血管和脉络丛内皮细胞中广泛表达,在维持细胞内离子稳态、细胞体积和调节神经炎症中发挥着重要的作用[7-10]。以往研究发现,在使用控制性皮质冲击设备构建的小鼠TBI模型中,抑制NKCC1受体具有保护血脑屏障完整性的作用,并且可以显著改善小鼠的神经功能状态[9]。然而,其具体的调节机制仍不清楚,针对NKCC1对血脑屏障的调控机制,我们利用一种体外模型进行实验探讨。
材料与方法
1 实验材料 LPS和胰蛋白酶购自美国Sigma公司,MCC950购自美国Selleck生物科技公司,布美他尼(bumetanide,BMT)购自美国MCE公司,永生化的bEnd3内皮细胞和BV2小胶质细胞系购自中国协和细胞库,兔抗小鼠NLRP3抗体购自Abcam公司,兔抗小鼠Caspase-1抗体、兔抗小鼠ASC抗体和兔抗小鼠GADPH抗体购自美国CST公司,兔抗小鼠ZO-1抗体购自美国Santa公司,HRP标记的山羊抗兔二抗购自中杉金桥生物技术有限公司,FITC标记的荧光二抗购自正能生物科技有限公司,白细胞介素-1β(interleukin-1β,IL-1β)和基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9) ELISA试剂盒购自中国Elabscience公司,荧光素钠购自中国索莱宝生物技术有限公司,0.4 µm Transwell小室购自中国耐思公司,胎牛血清购自美国Gibco公司,链霉素/青霉素购自美国Hyclone公司,跨内皮电阻仪采用Millicell®ERS-2系统测量。
2 细胞培养 bEnd3小鼠脑微血管内皮细胞系和BV2小鼠小胶质细胞系培养于配置好的完全培养基(DMEM/F12基础培养基 + 10%胎牛血清 + 1%双抗)中,两种细胞在5% CO2、37℃的恒温培养箱中培养。每隔2 d换液1次,当细胞密度达到80%时进行传代。
3 体外血脑屏障模型的构建和分组 血脑屏障模型采用Transwell小室作为支持物建立,Transwell小室是一个包含在6孔板中的含有膜结构的容器,通过将bEnd3小鼠脑微血管内皮细胞均匀接种于容器的膜上,加入配置好的培养基并进行细胞培养,膜上的血管内皮细胞会逐渐增殖并形成紧密的细胞连接,从而构成血脑屏障的基础。此外,Transwell小室的外室还可以接种其他种类的细胞,在本实验中将BV2小胶质细胞接种于外室,以研究细胞之间的相互作用。
4 实验分组 在实验1中,共分为2组:1)bEnd3血管内皮细胞(bEnd3)单培养组;2)bEnd3 + BV2小鼠小胶质细胞共培养组。在实验2和实验3中,共分为3组:1)bEnd3单培养组;2)bEnd3 + BV2共培养组;3)Blank空白对照组。在实验4中,共分为4组:1)bEnd3单培养组;2)bEnd3单培养 +脂多糖(lipopolysaccharide,LPS)组;3)bEnd3 +BV2共培养组;4)bEnd3 + BV2共培养 + LPS组;LPS处理浓度为1 µg/mL。在实验5的单培养模型中,共分为4组:1)bEnd3组;2)bEnd3 + LPS组;3)bEnd3 + LPS + 布美他尼(bumetanide,BMT;布美他尼为钠钾氯同向转运体特异性抑制剂)组;4)bEnd3 + BMT组。 在共培养模型中,共分为4组:1)bEnd3 + BV2共培养组;2)bEnd3 + BV2共培养 + LPS组;3)bEnd3 + BV2共培养 + LPS +BMT组;4)bEnd3 + BV2 + BMT组;LPS处理浓度为1 µg/mL,BMT处理浓度为1 µmol/L,处理时间为24 h。在实验6中,共分为4组:1)BV2组;2)BV2 + LPS组;3)BV2 + LPS + BMT组;4)BV2 +BMT组。LPS处理浓度为1 µg/mL,BMT处理浓度为1 µmol/L,处理时间为24 h。在实验7中,共分为4组:1)bEnd3 + BV2共培养组;2)bEnd3 +BV2共培养 + LPS组;3)bEnd3 + BV2共培养 +LPS + MCC950(NLRP3炎症小体的特异性抑制剂)组;4)bEnd3 + BV2共培养 + MCC950组。LPS处理浓度为1 µg/mL,MCC950处理浓度为10 µmol/L,处理时间为24 h。
5 Transwell小室跨内皮电阻(trans-epithelial electrical resistance,TEER)实验 参照文献中的方法[11],将接种了血管内皮细胞的Transwell小室置于室温下平衡30 min,使用STX03电极进行测量,将电极短端浸入培养板内部,长端浸入外部。测量时短端和长端与液面垂直且不接触小室壁,测量3次取平均值。采用同样方法测量未接种细胞组电阻值。TEER=(接种微血管内皮细胞组电阻值-未接种微血管内皮细胞组电阻值) × 有效膜面积,单位Ω·cm2,效膜面积为小室内嵌膜结构的面积。
6 4 h渗漏实验 在体外建立的BBB模型TEER电阻值达到最大时,在超净工作台中,将模型中小心将Transwell小室的培养基吸出,然后分别在内室和外室加入新鲜的培养基,并保证内室的液面差相较于外室至少大于0.5 cm,然后将Transwell小室放入培养箱中,4 h后再次观察液面差的保持情况,若依然维持了大于0.5 cm的页面差,则提示建立的BBB模型具有较好的屏障特性。
7 荧光素渗透实验 分别配置浓度为1 mg/L、0.5 mg/L、0.1 mg/L、0.02 mg/L和0.004 mg/L的荧光素钠溶液,使用荧光酶标仪(激发波长485 nm,发射波长530 nm)测量吸光值,绘制标准曲线。测定并计算荧光素钠体外透过bEnd3单层的量。首先在接受池中加入0.6 mL D-Hanks 液,在供给池中加入0.2 mL含有荧光素钠的 D-Hanks 液,浓度为10 mg/L,1 h后从接受池中取100 µL溶液,使用多功能酶标仪测定荧光强度,再通过荧光素钠标准曲线,计算荧光素钠透过Transwell小室的量。根据清除率计算公式[12],A=(CA × VA)/(T ×C0);通透系数=A/S计算出荧光素钠的通透系数,评估体外血脑屏障模型的通透性。 CA为下室的溶液浓度;VA为下室的溶液体积;C0为上室的溶液初始浓度;T为观察时间;S为上室PET膜的底面积,本实验的S为1.12 cm2。通过清除体积对时间作图,其斜率表示清除率。在建立体外血脑屏障模型后,分别检测bEnd3血管内皮细胞单培养组、bEnd3血管内皮细胞与BV2小胶质细胞共培养组、空白对照组(即未在Transwell小室内接种细胞)中的荧光素钠的清除率和清除体积。
8 免疫荧光测量NLRP3和紧密连接蛋白ZO-1的荧光强度 使用4%多聚甲醛固定BV2小鼠小胶质细胞和bEnd3微血管内皮,PBS清洗3次,每次5 min,用含有0.5% Trion-X100的PBS通透20 min,山羊血清室温封闭30 min后加入相应一抗并于4℃过夜;第2天,PBST清洗后,加入FITC标记的荧光二抗室温孵育1 h,含有抗荧光淬灭剂的DAPI染细胞核,封片,荧光显微镜观察细胞的荧光强度,Image J计算平均荧光强度。
9 Western blot 检测炎症小体相关蛋白表达量在实验6中,洗涤并收集BV2小胶质细胞,加入150 µL含有1%蛋白酶抑制剂的RIPA裂解缓冲液中,冰上裂解30 min,4℃下13 500 r/min离心10 min。使用BCA试剂盒进行蛋白定量,蛋白质等质量上样进行电泳。电泳结束后转膜,200 mA恒流于电泳液中转膜2 h。PVDF膜在TBST配制的5%脱脂牛奶中室温封闭1 h。4℃一抗孵育过夜:兔多克隆抗NLRP3抗体(1∶2 000),兔多克隆抗ASC抗体(1∶1 000),兔多克隆抗Caspase-1抗体(1∶1 000),兔单克隆抗GADPH抗体(1∶10 000)。用TBST缓冲液洗膜3次,每次10 min。HRP标记的山羊抗兔(1∶10 000)二抗室温下孵育1 h。采用化学增强发光法进行显色,使用Image J对实验条带进行灰度值分析。
10 酶联免疫吸附实验检测IL-1β和MMP-9的含量 取细胞上清液, 4℃下1 500 r/min离心10 min,使用ELISA试剂盒,按照说明书,使用酶标仪在450 nm波长下测量吸光值,根据同时生成的标准参考曲线计算IL-1β和MMP-9的水平。
11 统计学方法 使用 GraphPad Prism 8.0进行统计及作图,所有数据以±s表示,两组间比较采用t检验,多组间比较采用单因素或多因素方差分析,两两比较采用Tukey检验。P<0.05为差异有统计学意义,所有实验均独立重复3次。
结 果
1 体外血脑屏障模型的完整性 每天分别测量bEnd3细胞单培养组和bEnd3与BV2细胞共培养组的TEER,结果显示两组的TEER逐渐增加,并于第7天达到最大值,bEnd3细胞单培养组TEER为(160.2±7.344) Ω·cm2,bEnd3与BV2细胞共培养组的TEER为(159.4±7.287) Ω·cm2,两组之间TEER差异无统计学意义,提示bEnd3细胞单培养组与bEnd3与BV2细胞共培养组构建的血脑屏障模型,屏障的完整性无明显区别。见图1。
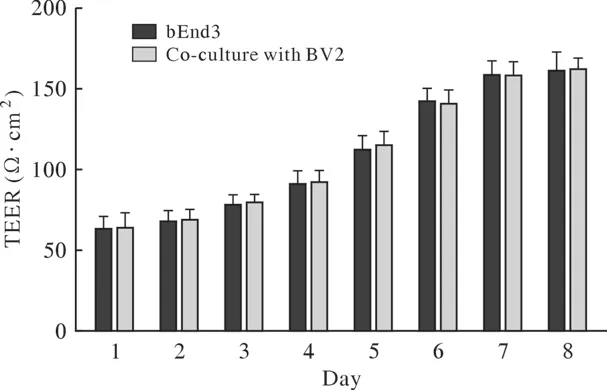
图1 两种血脑屏障模型培养期间的TEER变化Fig.1 Changes in the resistance values of the two blood brain barrier models during culture
2 体外血脑屏障模型的屏障功能 4 h渗透实验结果显示,bEnd3细胞单培养组、bEnd3与BV2细胞共培养组、空白对照组在渗透实验开始前,Transwell小室中形成了大于0.5 cm的液面差,在4 h后,bEnd3细胞单培养组和bEnd3与BV2细胞共培养组均保持了大于0.5 cm的液面差,而空白对照组液面差消失,表明建立的两种模型均具有良好的屏障功能。见图2。

图2 4 h渗透实验 A 实验开始时的液面差;B:实验结束后的液面差Fig.2 4-hour penetration test A: The liquid level difference before the experiment; B: The liquid level difference after the experiment
3 荧光素钠清除率测定 bEnd3细胞单培养组、bEnd3与BV2细胞共培养组、空白对照组的荧光素钠清除率结果如图3所示,y=0.4993x表示bEnd3与BV2细胞共培养组荧光素钠清除率,清除体积(29.72±0.931 9) µL;y=0.5225x表示bEnd3细胞单培养组的荧光素钠清除率,清除体积(29.96±1.205) µL;y=2.8965x表示空白对照组的荧光素钠清除率结果,清除体积(176.6±9.516) µL。
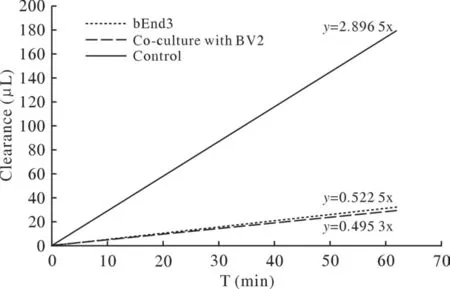
图3 荧光素钠在单培养模型、共培养模型、空白对照组中的清除率Fig.3 The clearance rate of sodium fluorescein in the single culture,the co-culture model and the control group
4 小胶质细胞促进了血脑屏障的损伤 在单培养和共培养模型中加入1 µg/mL LPS,并于6 h、12 h、24 h分别测量两种模型的TEER,结果如图4所示,在LPS处理6 h后,相对于bEnd3组,bEnd3 + LPS组的TEER未出现明显下降,(P>0.05);相对于bEnd3 + LPS组,bEnd3 + BV2 + LPS组TEER明显降低(P<0.05)。在12 h和24 h时,加入LPS处理的组别TEER进一步降低,且bEnd3 + BV2 + LPS组的TEER始终低于bEnd3 +LPS组(P<0.01)。6 h渗透率显示(图5),相对于bEnd3组,bEnd3 + LPS组渗透率无明显变化(P>0.05)。相较于bEnd3 + LPS组,bEnd3 + BV2 +LPS组渗透率显著增加(P<0.001)。
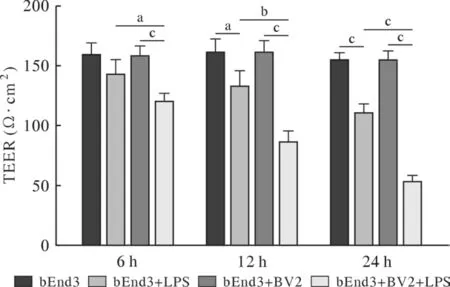
图4 LPS处理6 h、12 h和24 h对两种血脑屏障模型TEER的影响(aP<0.05, bP<0.01, cP<0.001)Fig.4 Effect of LPS on TEER of two blood brain barrier models after 6 h, 12 h and 24 h of treatment (aP<0.05, bP<0.01,cP<0.001)
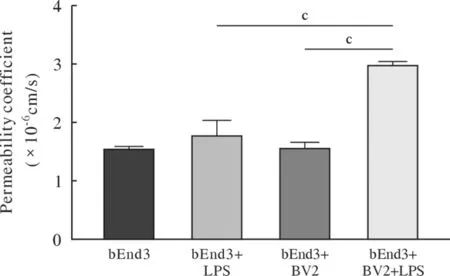
图5 LPS处理6 h对两种血脑屏障模型渗透率的影响(cP<0.001)Fig.5 Effect of LPS on permeability of two blood brain barrier models after 6 h of treatment (cP<0.001)
5 抑制小胶质细胞中的NKCC1受体减轻了血脑屏障的损伤 在bEnd3细胞单培养模型中,使用1 µg/mL LPS处理24 h后,LPS组的TEER相较于对照组明显降低(P<0.001)。LPS组的渗透系数相较于对照组明显增加(P<0.001),而LPS + BMT组的TEER与渗透系数较LPS组相比,差异无统计学意义(图6A,图6B)。在bEnd3与BV2细胞共培养模型中,使用1 µg/mL LPS处理24 h后,LPS组TEER相较于对照组明显降低(P<0.001),LPS组的渗透系数相较于对照组明显增加(P<0.001)。LPS + BMT组的TEER较LPS组明显增加(P<0.05),LPS + BMT组的渗透系数较LPS组明显降低(P<0.01)。提示抑制NKCC1对于体外构建的血脑屏障模型的保护作用是通过小胶质细胞发挥(图6C,图6D)。
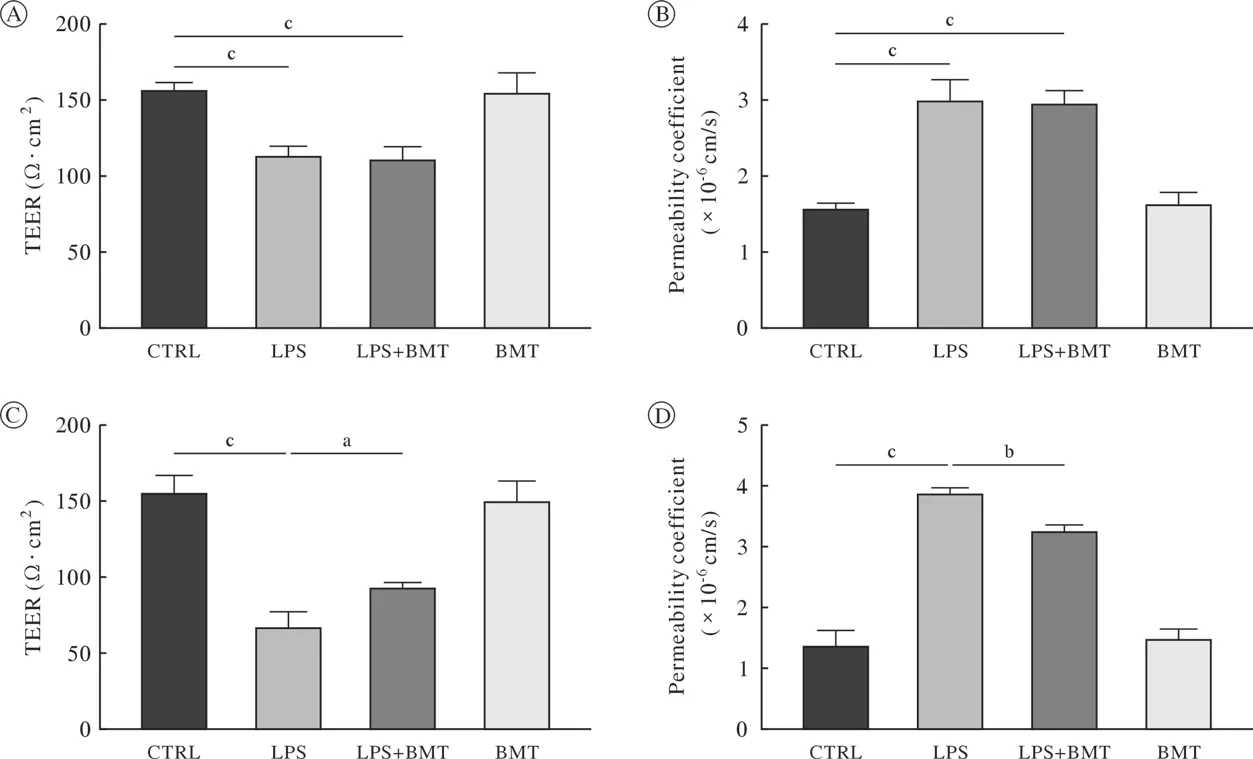
图6 布美他尼对LPS处理24 h后的单培养和共培养血脑屏障模型中TEER和渗透系数的影响(aP<0.05, bP<0.01, cP<0.001)A:bEnd3组中布美他尼对LPS处理后模型TEER的影响;B:bEnd3组中布美他尼对LPS处理后模型渗透性系数的影响;C:bEnd3 +BV2共培养模型中布美他尼对LPS处理后模型TEER的影响;D:bEnd3 + BV2共培养模型中布美他尼对LPS处理后模型渗透性系数的影响Fig.6 Effects of bumetanide on TEER and permeability in blood brain barrier models treated with LPS for 24 h in single culture and co-culture models (aP<0.05, bP<0.01, cP<0.001)A: Effect of bumetanide on TEER after LPS treatment in a single-culture blood-brain barrier model; B: Effect of bumetanide on permeability coefficient after LPS treatment in a single-culture blood-brain barrier model; C: Effect of bumetanide on TEER after LPS treatment in blood-brain barrier model of bEnd3 and BV2 microglia co-cultured. D: Effect of bumetanide on permeability coefficient after LPS treatment in blood-brain barrier model of bEnd3 and BV2 microglia co-cultured
6 BMT抑制了小胶质细胞中NLRP3的表达以及IL-1β和MMP-9的分泌 采用1 µmol/L BMT对BV2小胶质细胞进行1 h预处理,结果如图7A、图7B所示,与对照组相比,LPS组中的NLRP3炎症小体,ASC和Caspase-1表达含量明显增加(P<0.001)。相对于LPS组,LPS + BMT组中NLRP3炎症小体,ASC和Caspase-1表达含量明显降低(P<0.01)。免疫荧光结果见图7C、图7D,相比于对照组,LPS组的NLRP3炎症小体荧光强度明显增加,LPS + BMT组中NLRP3的荧光强度明显降低。提示BMT抑制了BV2细胞中NLRP3炎症小体的表达。ELISA结果如图7E、图7F所示,与对照组相比,LPS组细胞上清液中IL-1β和MMP-9的表达含量明显增加(P<0.05)。相对于LPS组,LPS + BMT组细胞上清液中IL-1β和MMP-9表达含量明显降低(P<0.05)。
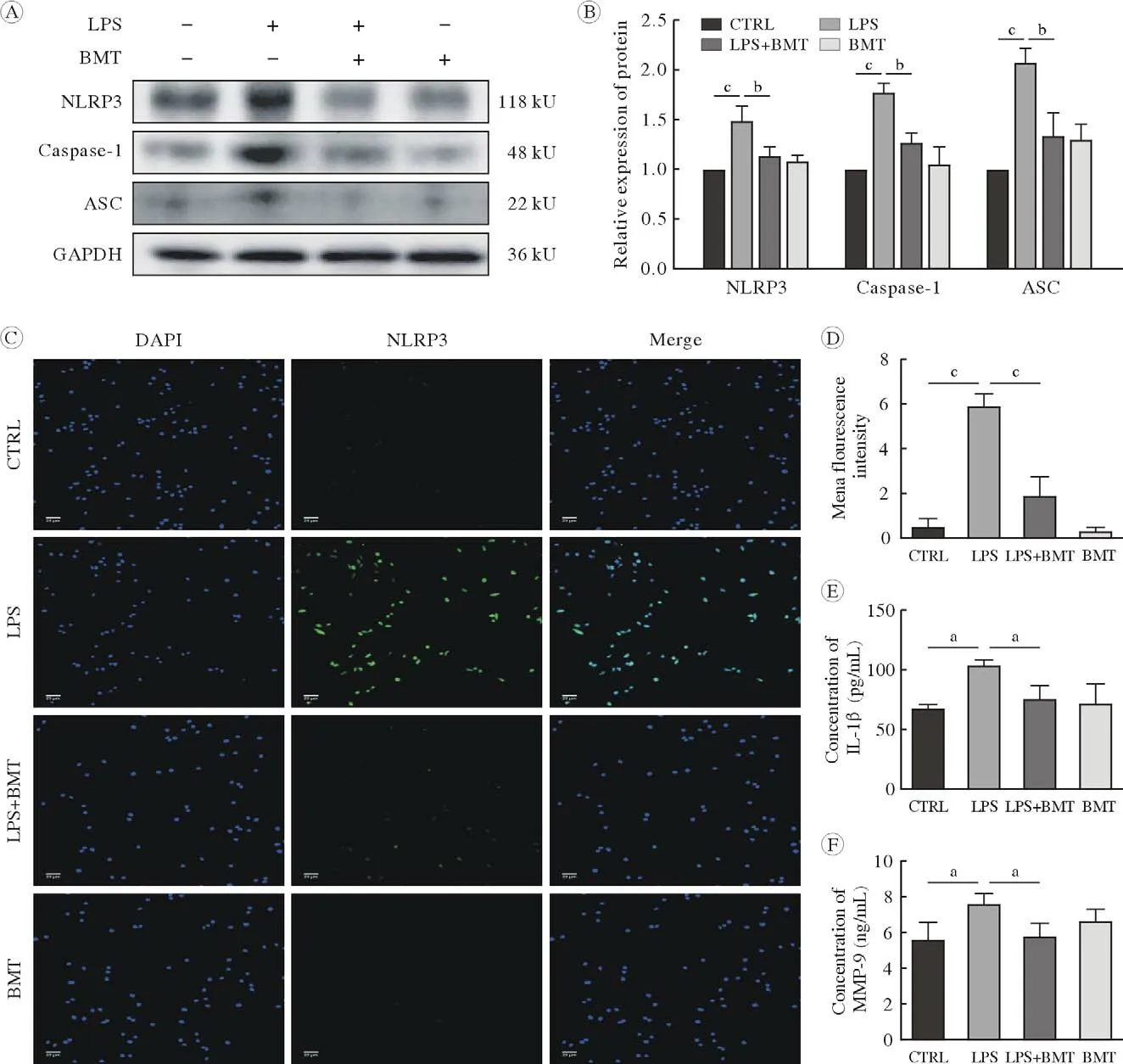
图7 小胶质细胞中NKCC1对NLRP3炎症小体表达以及IL-1β和MMP-9分泌的影响(aP<0.05, bP<0.01, cP<0.001)A,B:NKCC1特异性抑制剂布美他尼抑制了LPS诱导的小胶质细胞中NLRP3炎症小体的表达;C,D:NKCC1特异性抑制剂布美他尼降低了小胶质细胞中NLRP3炎症小体的荧光强度;E,F:NKCC1特异性抑制剂BMT降低了小胶质细胞中细胞因子IL-1β和MMP-9的分泌,标尺长度为20 µmFig.7 Effect of NKCC1 on NLRP3 inflammasome expression and secretion of IL-1β and MMP-9 in microglia (aP<0.05, bP<0.01, cP<0.001)A, B: NKCC1-specific inhibitor bumetanide inhibited the expression of NLRP3 inflammasome in LPS-induced microglia; C, D: the NKCC1 specific inhibitor bumetanide reduced the fluorescence intensity of NLRP3 inflammasome in microglia; E, F: the NKCC1-specific inhibitor bumetanide reduced the secretion of cytokines IL-1β and MMP-9 in microglia. Scale bars=20 µm
7 抑制NLRP3炎症小体可减轻血脑屏障模型损伤 免疫荧光结果显示(图8A,图8B),在共培养模型中,相对于对照组,LPS组中bEnd3血管内皮细胞的紧密连接蛋白ZO-1荧光强度明显降低(P<0.01),LPS + MCC950(NLRP3炎症小体的特异性抑制剂)组中血管内皮细胞的紧密连接蛋白ZO-1荧光强度明显增加(P<0.05)。在bEnd3与BV2细胞共培养模型中(图8C,图8D),使用1 µg/mL LPS处理24 h后,LPS组的TEER较对照组明显降低(P<0.001),渗透系数较对照组明显增加(P<0.001),LPS + MCC950组的TEER较LPS组明显增加(P<0.01)。渗透系数较LPS组明显降低(P<0.001)。提示小胶质细胞对于血脑屏障的损伤作用可能是通过NLRP3炎症小体介导的。
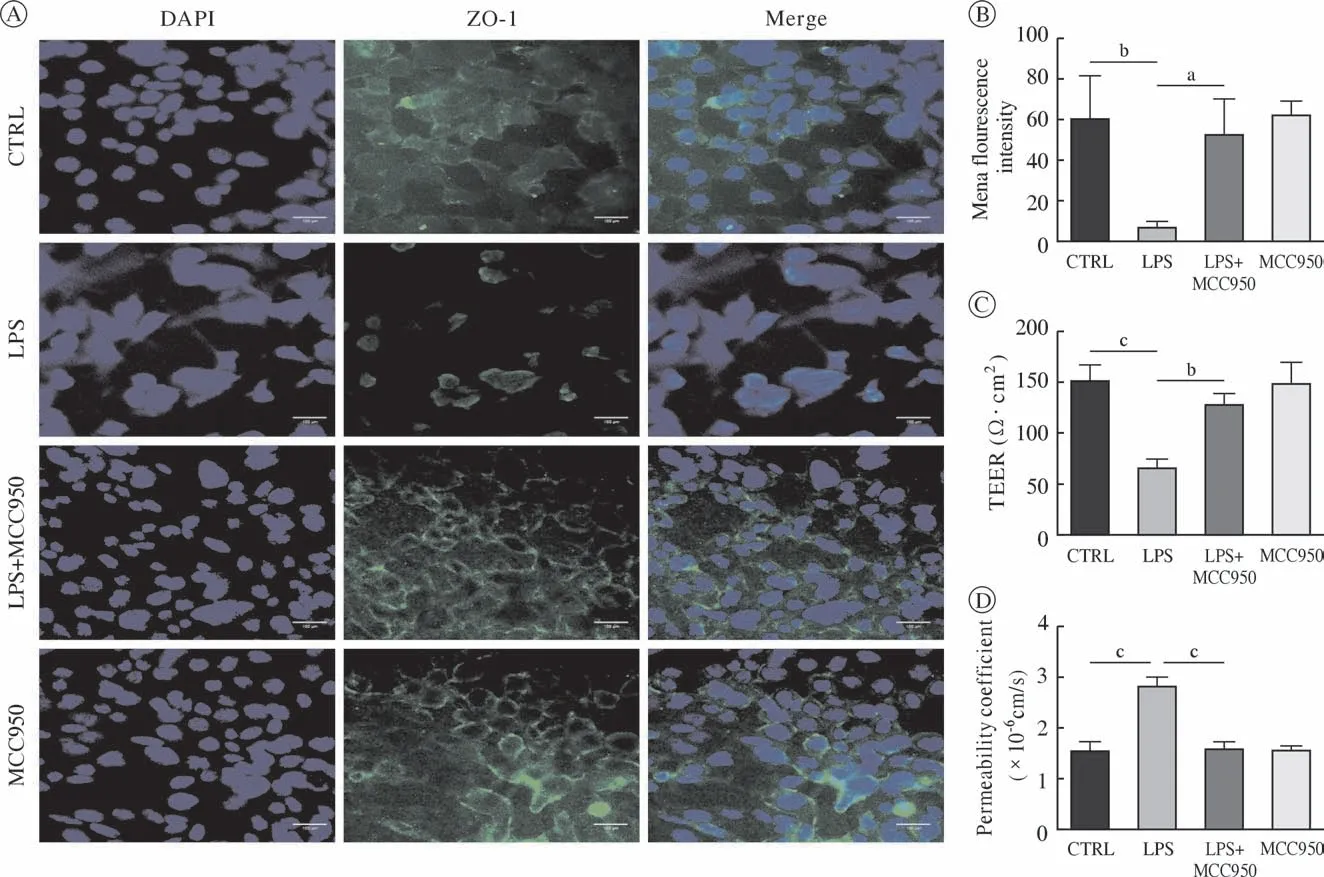
图8 共培养模型中,NLRP3特异性抑制剂MCC950对内皮细胞完整性的影响(aP<0.05, bP<0.01, cP<0.001)A:干预24 h后各组细胞紧密连接蛋白Z0-1免疫荧光,绿色为Z0-1染色阳性(标尺长度为100 µm);B:各组的平均荧光强度;C:MCC950抑制NLRP3后,各组TEER的变化;D:MCC950抑制NLRP3后,各组渗透系数的变化Fig.8 Effect of NLRP3 specific inhibitor MCC950 on endothelial cell integrity in the co-culture model ( aP<0.05, bP<0.01, cP<0.001)A: Z0-1 immunofluorescence staining of cells in each group after 24 h of intervention. The green is positive for Z0-1 staining (scale length is 100 µm); B: Average fluorescence intensity of each group; C: Changes of TEER in each group after NLRP3 inhibition by MCC950; D: Changes of permeability coefficient in each group after NLRP3 inhibition by MCC950
讨 论
TBI是导致40岁以下人群死亡和残疾的常见原因[13]。TBI的发病机制十分复杂,主要包括两个阶段:第一阶段是以快速损伤为特征的、以机械性损伤为特点的原发性损伤;第二阶段是慢性的继发性损伤,其核心特点是神经炎症。在第二阶段中,首先是外周免疫介质通过血脑屏障,然后发生小胶质细胞和外周中性粒细胞的激活、淋巴细胞和单核细胞衍生的巨噬细胞的浸润、促炎和抗炎细胞因子的释放以及免疫细胞的募集等[14-16]。
小胶质细胞是大脑中免疫系统的重要组成部分,被认为在脑外伤和脑缺血中发挥着监视作用[17]。在正常生理条件下,小胶质细胞不断监测着微环境中的有害刺激和感染过程,并在TBI后的神经炎症中发挥着关键作用。颅脑损伤发生后,小胶质细胞可受到损伤相关分子模式如透明质酸、补体和ATP等的刺激,导致促炎的M1型小胶质细胞增加,进而释放大量的炎症因子和细胞毒性介质,阻碍中枢神经系统修复并导致神经元功能障碍和细胞死亡[18-19]。
本研究中,我们在体外构建的血脑屏障模型中发现,炎症环境下小胶质细胞的存在可能加剧了内皮细胞的损伤,破坏了紧密连接蛋白的完整性。而这一现象可以被NKCC1的受体抑制剂BMT所改善。最近的一项研究发现,BMT通过抑制巨噬细胞的活化减轻了LPS诱导的急性肺损伤,并提出巨噬细胞中的NKCC1受体可能扮演着信号放大器的作用,其激活加剧了LPS诱导的炎症反应,从加剧肺损伤[20]。这与我们的研究发现有相似之处,我们对这一现象进行了进一步研究,发现NKCC1受体与小胶质细胞中NLRP3炎症小体的激活相关,NLRP3炎症小体是一种影响炎症反应状态的蛋白复合体,由NLRP3受体蛋白、凋亡相关斑点样蛋白(apoptosis-associated specklike protein,ASC)和效应分子半胱氨酸天氰冬氨酸蛋白酶(cysteinyl aspartate specific proteinase-1,Caspase-1)三部分构成[21-22]。激活的NLRP3炎症小体促进了Caspase-1的活化,在Caspase-1的作用下,前体型的pro-IL-1β水解为活性体IL-1β并迅速释放到细胞外间隙从而引发炎症反应[23],这一过程直接参与了血管内皮炎症的产生[24]。
在实验中还发现通过抑制NLRP3炎症小体的表达,可以降低血管内皮细胞的损伤。这提示小胶质细胞体内的NLRP3炎症小体的表达增加是导致体外BBB模型完整性下降的原因。既往有研究利用划痕实验在体外模拟TBI后的bEnd.3微血管内皮细胞损伤,并发现了NLRP3对于BBB的调节作用[25],然而研究人员仅关注了TBI对于血管内皮的直接损伤作用,而对于TBI后的BBB破坏而言,继发性损伤甚至是更为重要的,在这一过程中,神经炎症是核心特征之一,在本研究中,利用共培养的方式,我们能够更加直接地对小胶质细胞诱发的神经炎症及其对内皮细胞的损伤作用进行探索。NLRP3炎症小体是炎症激活的重要途径,其过度表达和激活可以促进炎症因子分泌并作用于血管内皮细胞之间的紧密连接蛋白,引起BBB 完整性的破坏[26-27]。NLRP3炎性体已被证明在多种细胞中表达,如小胶质细胞、星形胶质细胞、神经元和内皮细胞[28-29]。值得注意的是,在NLRP3表达和激活的过程中,小胶质细胞发挥着重要作用,研究人员通过免疫荧光双染共定位的方法,对损伤不同时间的小鼠脑组织进行染色,发现在损伤过程中,NLRP3炎症小体被激活的细胞位置发生了动态变化,最先被激活的是小胶质细胞,随后是神经元和内皮细胞,此外研究人员还发现神经元、内皮细胞和星形胶质细胞中表达的NLRP3炎症小体需要依赖小胶质细胞的诱导,这提示在NLRP3发挥作用的过程中,小胶质细胞发挥着重要的起始作用。
有研究发现,BMT可减轻体外培养的小胶质细胞的活化和IL-1β的分泌,在大鼠的脑外伤模型中也发现了类似现象[30],这提示BMT有抗炎功能。我们也发现BMT降低了小胶质细胞IL-1β的分泌,然而IL-1β并不会直接造成血脑屏障的损坏。MMP-9作为IL-1β的下游信号之一,是金属基质蛋白酶家族的重要组成部分,可以水解内皮细胞之间的紧密连接蛋白和基质,其合成和分泌依赖于IL-1β。当感受到IL-1β含量增加时,MMP-9的含量也会随之增加,导致紧密连接蛋白的降解。
在内皮细胞单培养的血脑屏障模型中,抑制NKCC1并没有观察到明显的血脑屏障保护作用,而当与小胶质细胞共培养时,屏障系统的损伤加剧并且观察到了BMT对血脑屏障的保护作用,一方面提示BMT对血脑屏障的保护作用是通过作用于小胶质细胞发挥的,另一方面也表明NLRP3的表达与调控需要某种特殊因素。在一项关于脑缺血再灌注的研究中,研究人员发现内皮细胞的炎症反应是由小胶质细胞中的NLRP3炎症小体诱导的,当内皮细胞与小胶质细胞共培养时,内皮细胞在经过氧糖剥夺和复氧复糖后,NLRP3表达明显增加,而在单培养时,NLRP3的表达增加并不明显[30-31]。这解释了在本研究中抑制NKCC1受体不会改善单培养的内皮细胞完整性。
NKCC1受体对NLRP3发挥调节作用的机制仍有待研究,对于NLRP3炎症小体来说,组装和激活过程是其发挥作用的必要途径[32],在组装过程中NF-κB信号通路发挥着重要作用[33],有研究报道, NKCC1受体与NF-KB通路的激活相关[30],这可能是抑制NKCC1受体引起NLRP3表达下降的原因,此外NKCC1 功能紊乱会导致细胞体积膨胀,引发K+依赖性构象变化,激活炎症小体组成元件,进一步促进IL-1β的表达[34],因此BMT有可能是通过降低NLRP3表达和抑制NLRP3激活两方面发挥对NLRP3的调节作用。
综上所述,本研究结果表明NKCC1可通过调控小胶质细胞NLRP3炎症小体的表达,调节血脑屏障的功能。

