PD-L1抑制剂治疗小细胞肺癌的有效性和安全性分析
张 砾,邵佳康,闫文姬,周宇欣,贾谷和,赵卫红,安广宇
1 首都医科大学,北京 100069;2 解放军总医院第一医学中心 肿瘤内科,北京 100853;3 解放军医学院,北京 100853;4 南开大学医学院,天津 300071;5 首都医科大学附属北京朝阳医院,北京100020
肺癌的全球发生率和死亡率均居高位,其中小细胞肺癌(small cell lung cancer,SCLC)虽仅占所有肺癌15%左右,但其作为一种神经内分泌肿瘤,相比非小细胞肺癌(non-small cell lung cancer,NSCLC)更具侵袭性和致命性[1-2]。SCLC 通常根据受累程度分为局限期(limited stage,LS)和广泛期(extensive stage,ES),其中70%的患者在初诊时即为ES[3]。有研究显示,LS SCLC中位总生存期(overall survival,OS)为15 ~ 20个月,而ES SCLC中位OS仅为8 ~ 13个月[4-5]。在免疫治疗时代之前,依托泊苷联合顺铂或卡铂(EP方案)作为ES SCLC的标准治疗方案已有30余年[6-7]。尽管一线治疗的初始反应率为 60%~80%,但由于化疗药物的耐药性,接受化疗的ES SCLC患者1年进展率高达94%[8]。美国食品药品监督管理局(Food and Drug Administration,FDA)批准的SCLC二线治疗药物为托泊替康,其有效率仅为15% ~ 20%,1年生存率为30%[9]。后线则缺乏标准治疗方案。近年来,NSCLC的治疗和预后已受益于免疫治疗(immunotherapy,IO)相关药物的获批,但SCLC治疗的研究进展要慢得多。2019年和2020年FDA分别批准了阿替利珠单抗(Atezolizumab)和度伐利尤单抗(Durvalumab)联合一线铂类和依托泊苷化疗治疗广泛期小细胞肺癌,这是几十年来一线首次获批的新疗法[5,10-11]。在IMpower133研究中,与标准化疗组相比,Atezolizumab联合化疗组观察到延长的PFS(5.2个月vs4.3个月,HR=0.77)和OS (12.3个月vs10.3个月,HR=0.76)[5]。CASPIAN研究则显示,与标准化疗组相比,Durvalumab联合化疗组一线治疗ES SCLC的中位OS延长了2.7个月(10.3个月vs13.0个月),死亡风险降低了27% (HR=0.73,P=0.004 7)[10-11]。2021年9月欧洲内科肿瘤学会(European Society for Medical Oncology,ESMO)的CASPIAN研究公布了其3年OS结果,Durvalumab + EP方案较单纯EP方案3年OS率提升了3倍(17.6%vs5.8%)[12]。免疫治疗的新进展使长久以来陷于困局的SCLC患者看到了一丝曙光,成为近期的研究热点。然而,免疫治疗针对SCLC患者的有效性和安全性还需要更多真实世界数据验证。因此,我们收集了于解放军总医院第一医学中心接受PD-L1抑制剂治疗的SCLC患者的临床资料,分析其有效性和安全性,探索与疗效相关的临床因素。
资料与方法
1 资料 收集2018年1月1日- 2021年6月30日于解放军总医院第一医学中心接受PD-L1抑制剂治疗的SCLC患者的临床资料。纳入标准:1)组织病理学明确诊断为SCLC;2)曾接受PD-L1抑制剂治疗且治疗2周期以上;3)有可评价的病灶。排除标准:1)无病理诊断,仅有细胞学诊断;2)5年内患有第二肿瘤;3)长期服用激素和免疫抑制剂;4)收集数据时未完成首次疗效评价。
2 给药方案 本研究纳入的小细胞肺癌患者均接受Atezolizumab(上海罗氏制药有限公司,规格:1 200 mg/20 mL,批号:S20200004,1 200 mg 静脉滴注,1次/3周)或Durvalumab(阿斯利康制药有限公司,规格:500 mg/10 mL,批号:S20190039,1 500 mg 静脉滴注,1次/3周)规范治疗。
3 疗效评价和不良反应评价 随访采用门诊复诊、再次住院、查阅病例、电话、邮件或微信等方式进行,随访时间截止至2021年11月30日。1)疗效评价:按照实体瘤的免疫治疗疗效评价标准(modified response evaluation criteria in solid tumors for immune based therapeutiecs,iRECIST)[13],包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾 病 稳 定(stable disease,SD)和疾病进展(progression disease,PD)。客观缓解率(objective response rate,ORR)=(CR + PR)/总例数 × 100%,疾病控制率(disease control rate,DCR)=(CR + PR + SD)/总例数 × 100%。PFS定义为治疗开始至随访患者病情进展或死亡的时间。2)不良事件:根据美国国立癌症研究院通用毒性标准(National Cancer Institute Common Terminology Criteria for Adverse Events,NCI-CTCAE) 4.03版进行判定。其中PFS为主要研究终点,不良反应为次要研究终点。
4 统计学分析 采用R语言 3.6.3和GraphPad Prism 8.0进行统计学和生存分析。计量资料以±s或Md(IQR)表示,计数资料使用例数(百分比)表示。患者临床特征与PD-L1抑制剂治疗疗效的关系,使用χ2检验或校正χ2检验。不同临床特征对预后的影响因素分析为单因素和多因素Cox回归分析。此外使用Kaplan-Meier生存曲线及log-rank检验,评估分析PFS生存资料的差异。检验水准为α=0.05,P<0.05为差异有统计学意义。
结 果
1 临床特征和疗效评价 本研究共纳入100例患者,其中男性87例(87.0%)。中位年龄61.0岁。东部肿瘤协作组行为状态(Eastern Cooperative Oncology Group performance status,ECOG PS)评分0分26例(26.0%),1分69例(69.0%),≥2分5例(5.0%)。LS患者31例(31.0%),余为ES。一线治疗77例(77.0%),二线10例(10.0%),三线及以上13例(13.0%)。免疫单药治疗4例(4.0%),联合抗血管治疗4例(4.0%),联合化疗76例(76.0%),同时联合化疗和抗血管治疗16例(16.0%)。疗效评估为CR 1例(1.0%),PR 69例(69.0%),SD 24例(24.0%),PD 6例(6.0%),ORR=70.0%,DCR=94.0%,中位PFS 5.2个月。除ECOG PS评分、肿瘤分期和治疗方案外(P<0.05),余均差异无统计学意义。见表1。
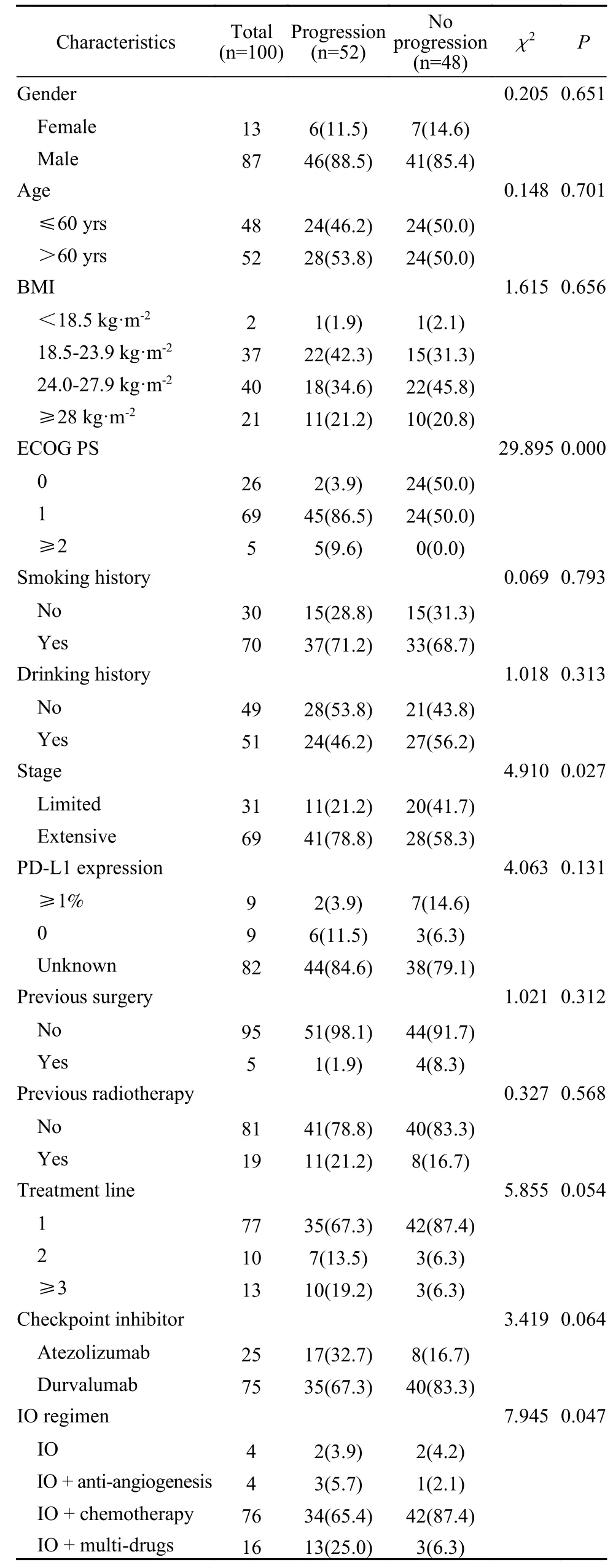
表1 患者临床特征与PD-L1抑制剂治疗疗效的关系(n, %)Tab. 1 Relationship between clinical characteristics of patients and therapeutic effect of PD-L1 inhibitors (n, %)
2 Cox和生存分析 100例患者中,52例达到PFS研究终点。单因素Cox分析显示:接受PDL1治疗时ECOG PS 0分较ECOG PS 1分PFS更长(9.9个月vs6.4个月,95%CI:0.020 ~ 0.338,P<0.001),二线治疗较一线治疗PFS更短(3.8个月vs7.9个月,95%CI:1.125 ~ 5.787,P=0.025)。多因素Cox分析:在相关分组中显示出与单因素Cox分析相同的趋势(P<0.05),此外还显示广泛期较局限期PFS更短(6.5个月vs9.0个月,95%CI:1.025 ~ 4.491,P=0.043)。免 疫 单 药(2.7个月vs7.4个月,95%CI:1.121 ~ 24.126,P=0.035)、免疫联合抗血管治疗(2.5个月vs7.4个月,95%CI:1.739 ~ 28.273,P=0.006)均较免疫联合化疗PFS更短。Kaplan-Meier曲线分析显示:ECOG PS 0分较ECOG PS 1分PFS更长(P<0.01),一线治疗较二线治疗PFS更长(P<0.05),免疫联合化疗较免疫单药PFS更长(P<0.05)。LS SCLC与ES SCLC比较,差异无统计学意义(P>0.05),但曲线有分离趋势。见表2,图1 ~ 图4。
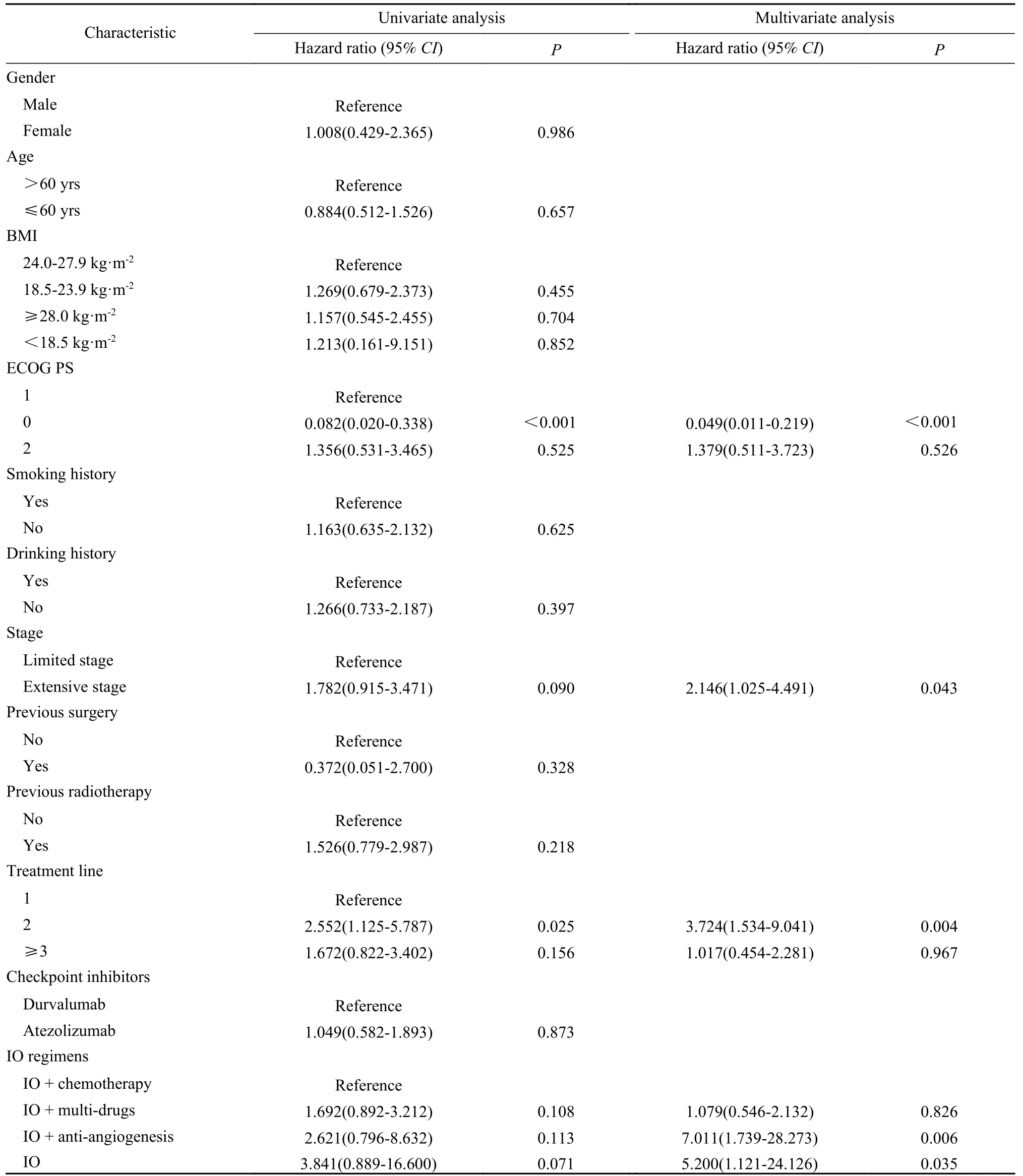
表2 单因素、多因素Cox回归分析临床特征与PFS的关系Tab. 2 Univariate and multivariate Cox regression analyses of the relationship between clinical features and PFS
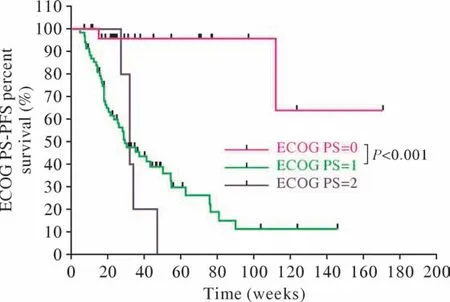
图1 ECOG不同组别的无进展生存曲线Fig.1 Progression-free survival curves for different ECOG groups
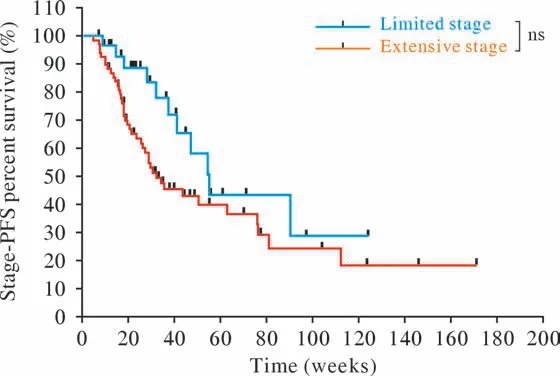
图4 不同分期的无进展生存曲线Fig.4 Progression-free survival curves for different stages
3 安全性 不良反应分为一般不良反应(general adverse events,gAEs)和免疫相关不良反应(immunurelated adverse events,irAEs),见表3。gAEs中发生率最高的为白细胞计数减低(35.0%),其次为恶心(31.0%)、呕吐(30.0%)、肝功能异常(22.0%)、贫血(18.0%)、血小板计数减低(15.0%)、脱发(14.0%)、纳差(13.0%)等。多为1 ~ 2级不良反应,3级及以上不良反应主要包括白细胞计数减低(13.0%)、血小板计数减低(5.0%)和脱发(3.0%)等。irAEs中发生率最高的为肺炎9例(9.0%),其次为甲状腺功能减低5例(5.0%)、皮疹3例(3.0%)、甲状腺功能亢进1例(1.0%)、结肠炎1例(1.0%)。其中,3级及以上不良反应包括肺炎2例(2.0%)、皮疹1例(1.0%)。目前尚未发生导致死亡的不良事件。
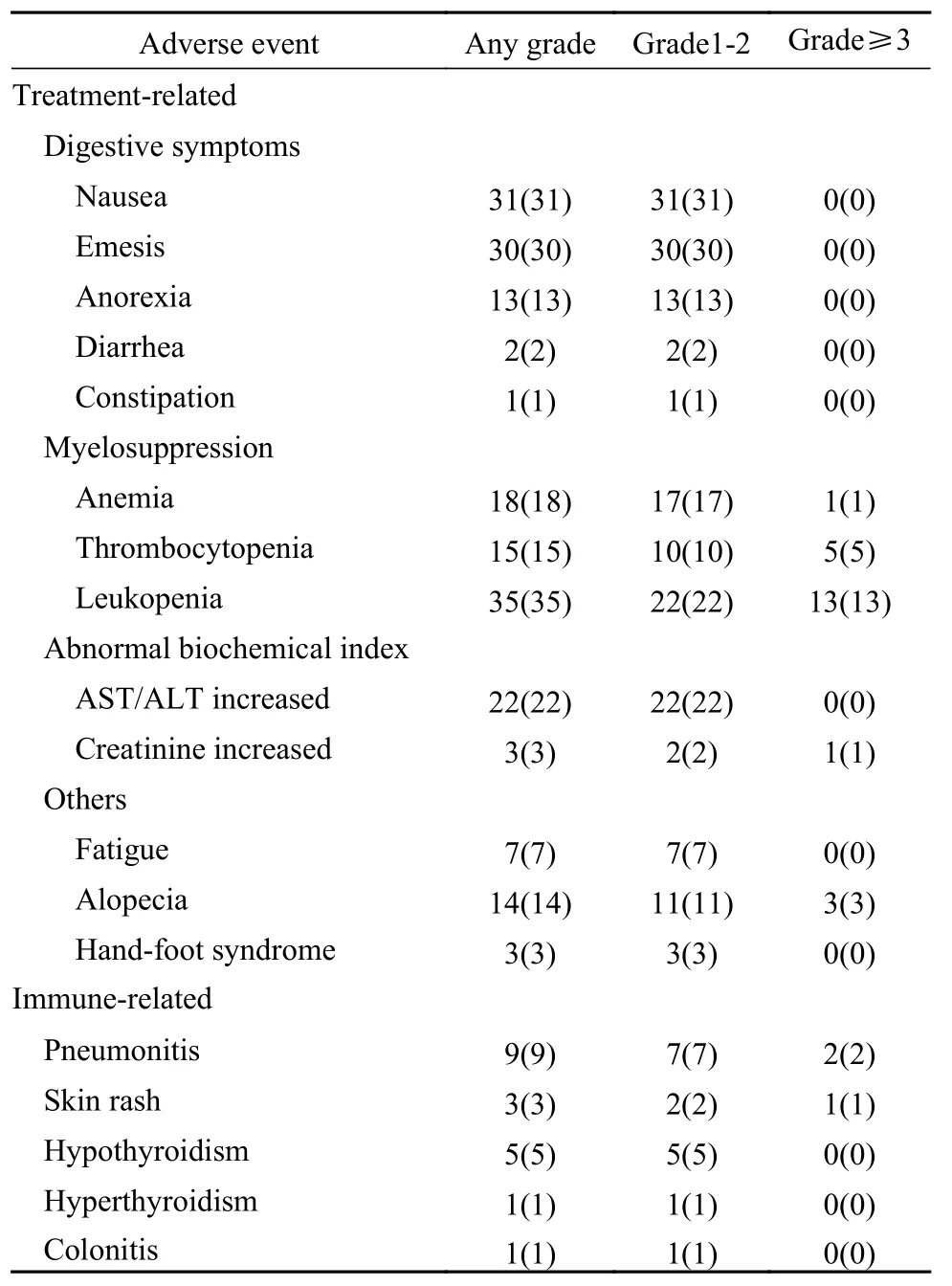
表3 100例小细胞肺癌患者PD-L1治疗相关不良事件(n, %)Tab. 3 List of treatment-related adverse events in 100 SCLC patients (n, %)
讨 论
SCLC是一种侵袭性和破坏性很高的恶性肿瘤,而免疫治疗的出现使SCLC的临床治疗突破了数十年来的瓶颈,目前多个临床试验结论支持PD-L1抑制剂联合化疗用于ES SCLC的一线治疗[5,10-11]。本研究基于复杂的真实世界背景,分析免疫治疗对SCLC患者的有效性和安全性,为临床治疗积累更多经验。
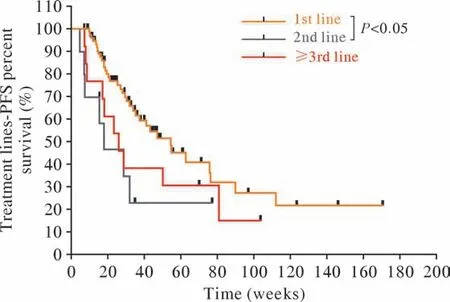
图2 不同治疗线数的无进展生存曲线Fig.2 Progression-free survival curves with different treatment lines
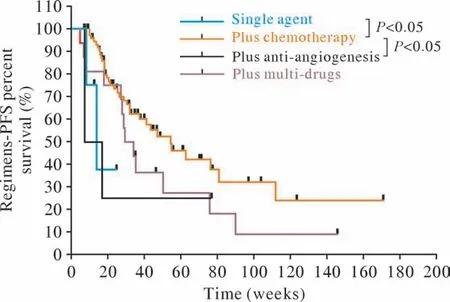
图3 不同治疗方式的无进展生存曲线Fig.3 Progression-free survival curves for different treatment regimens
本研究显示PD-L1抑制剂对SCLC的疗效与患者的年龄、性别、体质量指数、吸烟饮酒状态、是否接受过手术或放疗、PD-L1表达状态和PD-L1抑制剂具体类型均无关(P>0.05)。吸烟状况虽与SCLC发病密切相关,但与该人群接受PDL1单抗治疗获益无相关性[14]。有研究认为体质量指数与免疫治疗疗效呈正相关[15]。但本研究未得出类似结论。
本研究结果显示,ECOG PS 0分患者PFS优于ECOG PS 1分患者,这与临床经验相符,体力状况越好,合并症更少、对治疗的耐受性更好,故PFS更长。但在ECOG PS 2分患者中无统计学差异,考虑与样本量过小有关。此外,一线接受PD-L1单抗治疗较二线治疗可延长PFS,这与IMP0WER133和CASPIAN等前瞻性研究结论一致[5,10-11,16]。
本研究还显示,不同的联合治疗策略会影响临床获益。免疫单药治疗较免疫联合化疗PFS更短,这与Galluzzi等[17]的研究结论一致,进一步验证了免疫联合化疗一线治疗SCLC的可行性。其次,本文对抗血管治疗的增益情况进行了探讨。多数研究表明抗血管治疗会进一步提升获益,如化疗联合抗VEGF单抗贝伐珠单抗可延长PFS,抗血管生成融合蛋白阿柏西普可使铂类敏感SCLC患者PFS率有所改善[18]。联合内源性血管生成抑制剂恩度可使患者的生存略有获益[19]。安罗替尼、阿帕替尼等小分子酪氨酸激酶抑制剂的相关研究也显示出了生存获益[20-21]。安罗替尼还因此获批了SCLC三线及以上治疗适应证。而本文的研究结果显示,在免疫联合化疗方案基础上加用抗血管治疗并未取得更多的PFS增益。此外,研究还发现免疫联合抗血管治疗较免疫联合化疗PFS更短,说明抗血管治疗的增益也劣于化疗的增益。需要补充说明的是,由于SCLC一般是中心型肺癌,与大血管关系密切,临床上治疗SCLC时联合抗血管治疗需十分谨慎,所以通常倾向于肿瘤负荷大、进展迅速或无法耐受化疗的SCLC患者选择抗血管治疗,不排除因此产生的选择性偏倚影响结论。
本研究中ES SCLC患者69例(69.0%),与ES SCLC患者初诊占比约70%的流行病学特征相符[2]。多因素Cox回归分析提示LS SCLC患者与ES SCLC患者的PFS不同且差异有统计学意义,而生存曲线虽未显示出统计学差异但已有明显的分离趋势,考虑可能与随访周期较短有关。
本研究中3级及以上的gAEs和irAEs发生率均较低,未观测到不良反应相关性死亡事件。说明PD-L1抑制剂治疗的安全性较高、耐受性较好,与IMP0WER133和CASPIAN等前瞻性研究结论相仿[5,10-11]。
IMPOWER133和CASPIAN的研究结论均来自ES SCLC患者,相关结论是否适用于LS-SCLC患者尚无确切证据,本研究包含部分LS-SCLC患者,为该类患者的临床治疗提供了部分经验。此外,目前SCLC患者接受PD-L1抑制剂治疗的真实世界研究相对匮乏,本研究从更为复杂客观的真实世界出发,可反映临床实际情况。总之,本研究提示以PD-L1抑制剂为主的免疫治疗对SCLC是一种有前景的治疗方式,其有效性和安全性较高,耐受性较好;推荐尽早一线采用免疫联合化疗方案治疗SCLC;免疫联合抗血管治疗似乎并不能改善获益,这需要进一步开展前瞻性研究验证。
本研究存在以下局限性:1)作为单中心的回顾性研究,有回顾性研究本身的局限;2)样本量相对较小,需要在更大样本量的人群中进行验证;3)随访时间相对较短,需要延长随访时间进一步验证结论。然而,尽管有这些限制性因素,但本研究从真实世界角度出发,为SCLC的免疫治疗积累了宝贵经验。

