全胸腺切除与胸腺瘤切除治疗早期非重症肌无力胸腺瘤的围术期指标和预后比较
井 淼,蔡文涵,温佳新,高 杰,吴重重,薛志强
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 胸外科,北京 100853;3 解放军总医院第一医学中心 病理科,北京 100853;4 解放军总医院第一医学中心 放射诊断科,北京 100853
在胸腺上皮肿瘤的治疗中,外科手术居于首要地位,标准手术方式为正中胸骨劈开-全胸腺切除术[1-2]。但随着临床研究的不断深入,对于早期(临床Masaoka-koga分期为Ⅰ和Ⅱ期)非重症肌无力(myasthenia gravis,MG)患者,究竟何种手术策略才是最适宜的,出现了一些新的观点,争论的主要内容包括手术方式和切除范围[3-9]。胸腺瘤发病率低,生长缓慢,已有的研究证据尚有不足。本研究拟探讨早期非MG胸腺瘤治疗中,不同切除范围在临床疗效、预后等方面的差异,为临床研究和治疗提供参考。
资料与方法
1 资料概述 本研究为回顾性病例对照研究,选取2010年1月- 2019年12月在解放军总医院第一医学中心胸外科接受手术治疗的胸腺瘤患者临床资料。纳入标准:1)接受手术治疗的胸腺肿瘤患者;2)不并发MG;3)Masaoka-koga分期为Ⅰ期和Ⅱ期。排除标准:1)同期合并进行胸部其他手术;2)术后病理诊断为胸腺囊肿、胸腺癌、胸腺神经内分泌肿瘤等。
2 手术方式和切除范围 1)开放手术:采用全身麻醉,纵劈胸骨手术、经颈部切口手术采取平卧位,侧开胸手术多采取健侧卧位折刀位,视情况可稍向后倾,双上肢屈曲抱枕。打开胸腔后,使用胸廓牵开器暴露术野,电刀和超声刀结合,分离需切除组织,注意保护纵隔内组织器官,特别是相邻的大血管和神经。2)微创手术:本研究中微创手术(minimally invasive surgery,MIS)仅包含胸腔镜手术(video-assisted thoracoscopic surgery,VATS)和机器人手术(robot-assisted thoracoscopic surgery,RATS)。采用全身麻醉,双腔气管插管健侧单肺通气。体位一般选择健侧卧位折刀位,视情况可稍向后倾,双上肢屈曲抱枕。VATS根据病变位置和主刀习惯,于腋中线或腋后线第7或第8肋间取1 cm左右切口置入镜头,于腋前线或稍偏向腋中线位置的合适肋间,取4 cm左右切口为操作孔,根据需要可于腋后线或肩胛下线做辅助操作孔。当采用人工气胸方式建立手术空间时,操作孔改为12 mm切口置入Trocar,前述辅助操作孔改为第二操作孔置入Trocar。RATS一般采用一个镜头臂+两个操作臂的“三臂法”,根据病变位置和主刀习惯调整机械臂的位置,主要原则是面向肿瘤,三角分布打孔,尽量避免机械臂互相干扰,有需要时可于合适位置加做辅助操作孔。手术以双极电凝嵌、电凝钩、超声刀结合,将需切除组织完整切除,自辅助操作孔或操作臂孔取出标本。3)切除范围:①全胸腺切除,术中除完整切除肿瘤外,还要切除全部胸腺组织,部分病例进一步清扫心包前、两侧迷走神经间的所有前纵隔脂肪组织;②胸腺瘤切除,当术野和操作空间狭小,特别是在微创手术条件下,无法保证完整切除胸腺组织,或患者因基础状况较差等原因应尽量缩短手术时间以降低手术风险时,则行胸腺瘤切除,肿瘤裸露部分,沿包膜外脂肪组织进行分离切除,与胸腺组织相延续部分,沿包膜外与肿瘤相毗邻胸腺组织进行分离切除,完整切除肿瘤。
3 分组设计 按切除范围分为全胸腺切除组205例、胸腺瘤切除组116例。两组基线资料差异有统计学意义(P<0.05)。基于年龄、性别、手术方式、肿瘤大小、WHO分型[10]、临床分期和辅助治疗进行1∶1倾向评分匹配,匹配容差为0.05。匹配后,每组分别有101例患者纳入研究。
4 观察指标 1)手术时间,术中出血量,术后引流管留置时间、住院时间、并发症;2)结局指标包括10年无病生存(disease-free survival,DFS),截止至胸腺瘤复发或任何原因导致的死亡;10年无复发生存(freedom from recurrence,FFR),截止至首次出现复发[11]。随访时间截止至2021年10月。
5 统计学方法 使用SPSS23.00软件进行数据的统计分析。正态分布连续变量以± s表示,使用t检验或校正t检验;非正态分布连续变量以Md(IQR)表示,使用Mann-Whitney U非参数检验;分类变量以例数和百分比表示,使用χ2检验或校正χ2检验。并进行Kaplan-Meier生存分析。采用log-rank法进行两组生存率比较。P<0.05为差异有统计学意义。
结 果
1 两组一般资料比较 根据纳入排除标准,全胸腺切除组205例、胸腺瘤切除组116例,两组在年龄、性别、Masaoka-Koga分期、R0切除率和术后辅助治疗方面的差异均无统计学意义(P>0.05),但胸腺切除组肿瘤长径更小(5.5 cmvs6.5 cm,P<0.001)、纵劈胸骨术式比例更高(26.3%vs12.9%,P=0.017)、WHO B2/B3型胸腺瘤比例更高,而胸腺瘤切除组患者WHO A/AB/B1型胸腺瘤比例相对较高。进行倾向评分匹配后,两组各有101例患者纳入分析,匹配后两组基线资料和病理资料差异无统计学意义(P>0.05)。见表1。
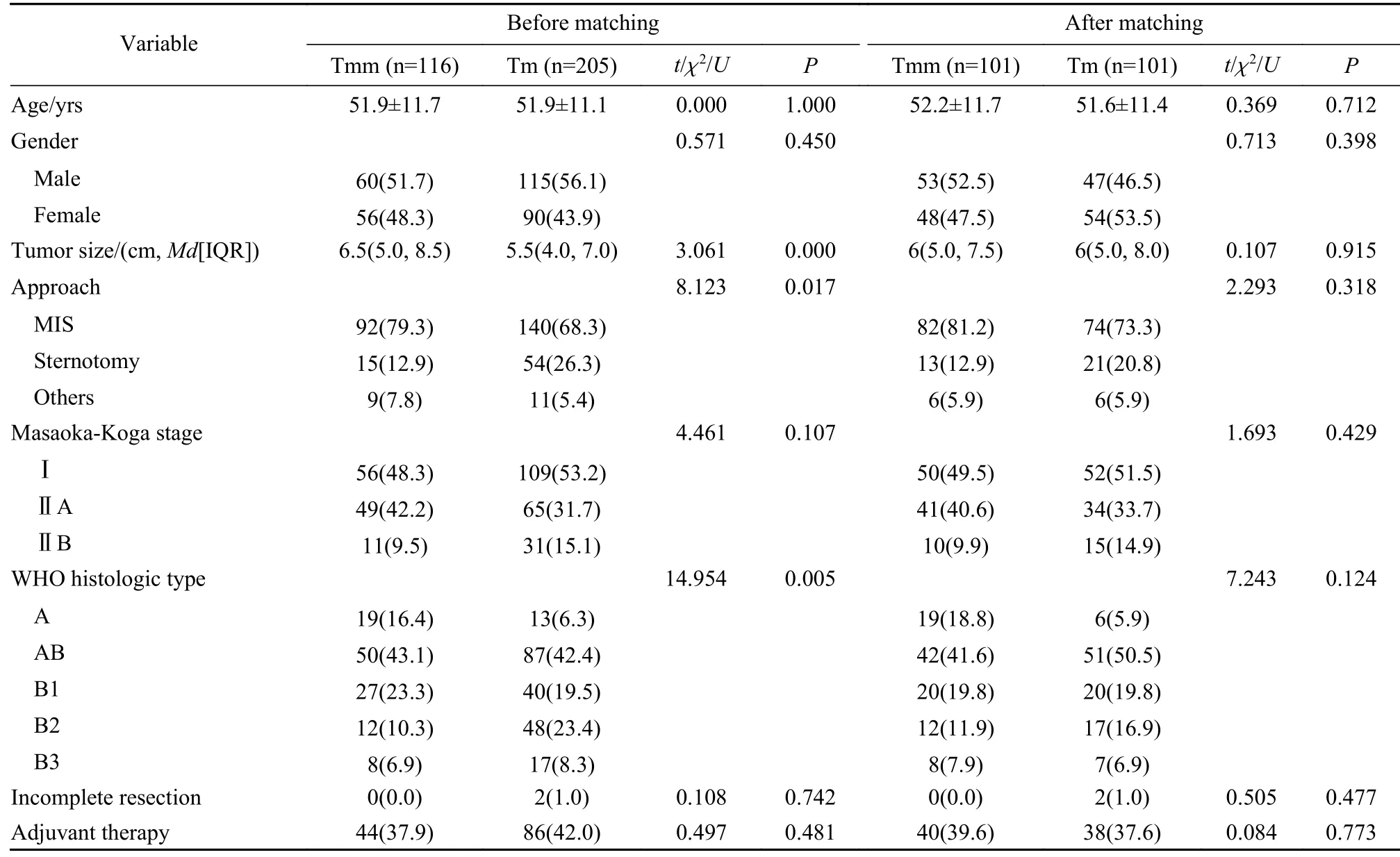
表1 胸腺瘤切除组与胸腺切除组临床资料比较(n, %)Tab. 1 Comparison of general and clinical characteristics between the thymomectomy group and the thymectomy group before and after matching (n, %)
2 两组围术期指标比较 两组术中出血量、胸腔引流时间、术后住院时间和术后并发症发生率差异均无统计学意义(P>0.05),但胸腺瘤切除组的手术时间明显较短(97 minvs120 min,P<0.001)。胸腺瘤切除组的术后并发症包括肌无力危象1例、下肢静脉血栓形成1例;胸腺切除组术后并发症包括乳糜胸1例 、肺炎1例、肌无力危象1例。术后病理证实胸腺瘤切除组均实现R0切除,胸腺切除组有2例R1切除。见表2。
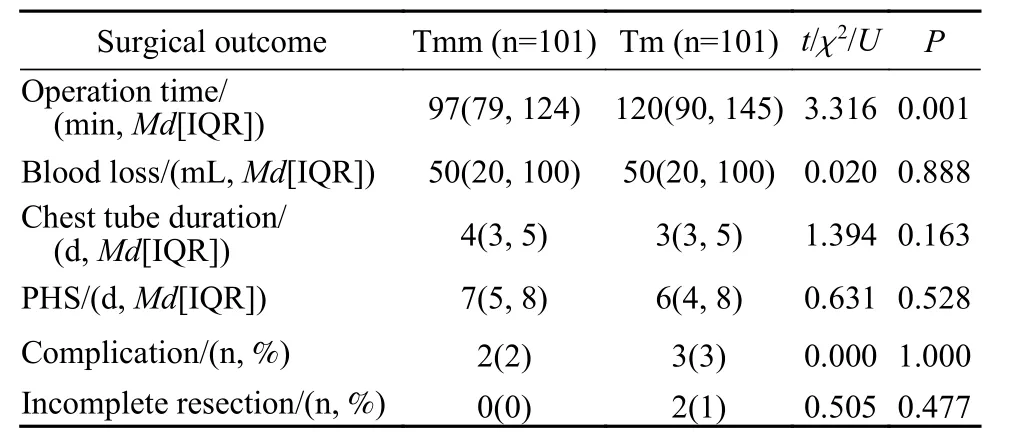
表2 胸腺瘤切除组与胸腺切除组围术期指标比较Tab. 2 Comparison of perioperative outcomes between the thymomectomy group and the thymectomy group
3 两组随访及生存情况比较 全组病例中位随访时间为61 (1 ~ 140)个月,随访周期内共8例死亡,其中与胸腺瘤相关的死亡,胸腺瘤切除组1例(0.86%)、胸腺切除组2例(0.97%)。全组共10例出现复发转移,胸腺瘤切除组4例,其中3例为局部复发,1例为远隔复发;胸腺切除组6例,其中4例为局部复发,2例为远隔复发。胸腺瘤切除组10年FFR为97.7%,胸腺切除组为96.3%,差异无统计学意义(P=0.451)(图1A);胸腺瘤切除组10年DFS为96.1%,胸腺切除组为91.8%,差异无统计学意义(P=0.833)(图1B)。两组间FFR、DFS差异均无统计学意义(P>0.05)。
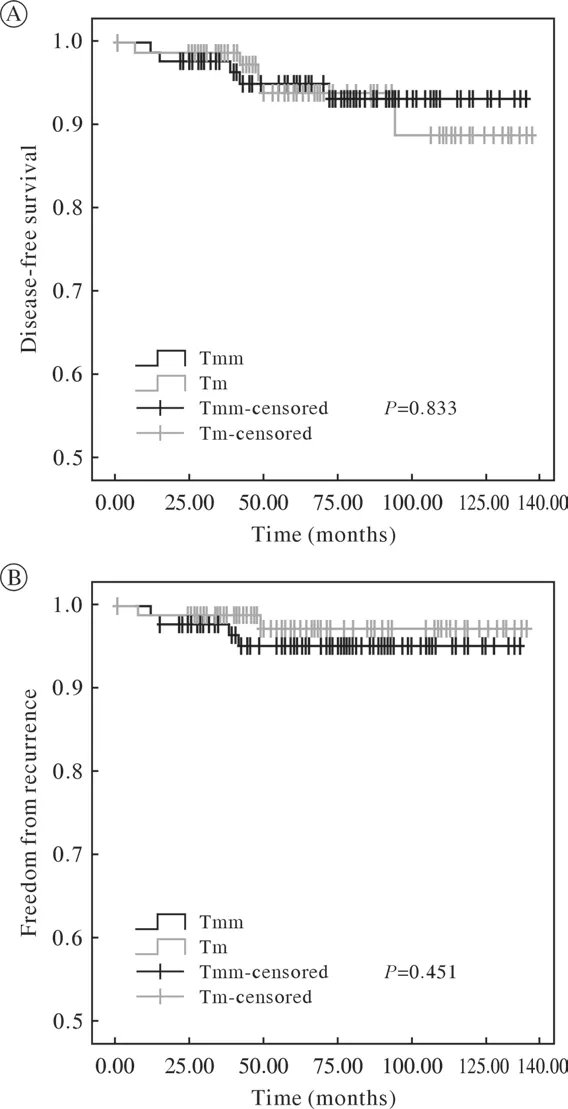
图1 胸腺瘤切除组与胸腺切除组FFR、DFS比较 (Tmm: thymomectomy; Tm: thymectomy)Fig.1 Comparison of disease-free survival (A) and freedom from survival (B) rates between the thymomectomy group and the thymectomy group (Tmm: thymomectomy; Tm, thymectomy)
讨 论
胸腺上皮肿瘤是最常见的前纵隔肿瘤,在中国的发病率为4.09/1 000 000[1]。手术切除是其主要治疗方式,但手术策略的选择目前存在一些争议。正中胸骨劈开-全胸腺切除是治疗胸腺瘤的标准方式[1-2]。之前也有案例采取的是肋间切口的胸腺瘤切除术,患者同样有良好的获益[7]。
近些年也报道了将RATS应用于胸腺瘤治疗的研究[6,9],且分析了纵劈胸骨手术与VATS治疗胸腺瘤在临床结果和预后方面的差异,围术期结果方面VATS有着显著优势[12-13]。相比于纵劈胸骨手术,MIS有优势也有劣势,局限性之一就是视野的暴露。尽管已经报道了多种MIS入路以力争获得更好的视野[14-15],但在全胸腺切除的严格标准下,依然受到一定的限制,这就对相对局限的胸腺瘤切除的可靠性评价提出了要求。日本胸腺研究会的回顾性研究认为,对于非MG的早期胸腺瘤患者,纵劈胸骨手术方式下的胸腺瘤切除可带来与标准手术切除相当的5年OS和DFS(胸腺瘤切除组为97.3%和93.8%,胸腺切除组为96.9%和94.7%)[7]。但该研究并未对MIS方式进行评价。Narm等[16]的回顾性研究纳入了所有手术方式的病例,胸腺瘤切除组的OS较胸腺切除组短,10年OS分别为88.3%和99.2%(P=0.01),10年FFR差异无统计学意义(分别为89.7%和85.0%,P=0.86)。但OS受到更多疾病无关因素的影响。
本研究的结论表明,对于非MG的早期胸腺瘤患者,胸腺瘤切除与胸腺切除可以获得相当的肿瘤学结果。在进行倾向评分匹配之前,胸腺瘤切除组有着更大的肿瘤长径,肿瘤越大,整个胸腺组织和纵隔脂肪与周围组织器官的关系也会更密切,会对手术的视野和操作提出更高的要求,这可能是影响切除范围选择的重要因素。同时胸腺瘤切除组的MIS比例明显更高,这可能与VATS、RATS等微创腔镜手术是在相对局限视野下完成有关。进行倾向评分匹配前后,两组5年/10年FFR、DFS差异均无统计学意义,胸腺瘤切除似乎能达到与胸腺切除相近的肿瘤学结果。
已有大量研究证实了相较于纵劈胸骨手术,MIS有着显著优势[17-18]。Tseng等[19]的研究结果表明相较于胸腺切除,胸腺瘤切除手术时间更短,术中出血量更少,术后引流时间更短,住院时间更短,并发症发生率更低。但该研究未行倾向评分匹配,两组在手术方式上差异较大。本研究表明,在倾向评分匹配前后,均衡了协变量差异,胸腺瘤切除的手术时间仍然更短,缩短手术时间能在一定程度上降低手术和麻醉给患者带来的风险。
从本研究结果来看,胸腺瘤切除或许是治疗早期非MG患者的可行方式。但还有一些关于这一治疗方式的其他争议。首先是可能存在术前、术中未被发现的多发胸腺瘤灶。但微观病灶不仅可能存在于正常胸腺组织内,同时也可能散发于纵隔脂肪内。因此,为了达到清除潜在多发病灶的目的强制行全胸腺切除,不仅无法保证目标的实现,还可能会导致过度治疗。基于对潜在遗留病灶的担心,还有另外两点争论:1)胸腺瘤切除可能会增加病灶不完全切除的风险,从而增加原位复发的概率。日本胸腺研究会的研究结果表明胸腺瘤切除组不完全切除率为2.2%,胸腺切除组为0.7%,两组的区域复发率分别为1.4%和1.1%,原位复发率分别为2.2%和0.4%(P=0.06)[7]。Rusidanmu等[20]的研究结果表明75例接受胸腺瘤切除的患者全部实现了完整切除,只有2例出现了复发。本研究中胸腺瘤切除组与胸腺切除组的FFR差异无统计学意义,所有胸腺瘤切除病例的切缘均为阴性,反而是胸腺切除组有2例R1切除,其中1例在较长的53个月随访周期中,并没有出现肿瘤影像学复发及其他疾病相关进展。2)术后MG的发生。有研究表明,全胸腺切除后的MG发生率也达到了3% ~ 5%,且胸腺瘤切除与胸腺切除术后MG发生率差异无统计学意义[20-21]。本研究中除了2例术后肌无力危象患者治疗后症状消失外,只有1例接受全胸腺切除治疗的患者出现远期的术后MG,且进行了纵隔脂肪组织的彻底清扫和术后辅助治疗。可见术后MG的发生,并不一定都来源于术中残留的胸腺组织。
本研究为单中心回顾性病例对照研究,且由于胸腺瘤发病率较低,本研究纳入病例时间跨度较长,各手术方式的质量控制可能存在差异。下一步可开展多中心前瞻性随机对照研究,以进行更加严格的质控。在预后研究中,由于使用指南推荐的10年生存指标[1],导致删失数据较多,仅此有待进行更长周期的随访研究。
综上所述,胸腺瘤切除相比于胸腺切除是一种创伤更小的手术策略,对于早期非MG胸腺瘤,在预后上也没有表现出明显的劣势。对于单纯胸腺瘤切除会增加原位复发、术后MG、遗漏多发病灶等风险的担忧,也没有足够的证据支持。扩大切除范围,可能并不是获得良好远期结果的必要手段。胸腺瘤切除是早期非MG胸腺瘤的可行切除范围。

