不同病理特征乳腺导管原位癌患者微浸润发生情况及相关因素分析
黄国聪 许子志
福建省莆田市第一医院乳腺甲状腺外科 351100
乳腺癌具有病因复杂、死亡率高等特点,且发病率居女性恶性肿瘤的首位[1]。乳腺导管原位癌(Ductal carcinoma in situ,DCIS)往往被认定是乳腺癌的前驱病变,约占乳腺癌患者的10%~20%,DCIS患者通常无明显临床表现,随着彩超和乳腺钼靶的广泛应用,DCIS检出率也随之提高[2]。DCIS虽然预后较好,但仍有部分DCIS可能进展为浸润性癌,增加治疗难度,预后较差。而乳腺导管原位癌微浸润(Ductal carcinoma in situ with microinvasion,DCIS-Mi)是DCIS发展成浸润性癌的关键期,多伴有1个或多个微浸润病灶,但其具体机制尚未明确[3]。因此,积极探寻DCIS患者发生微浸润的相关因素,并针对性制定干预方案,对改善预后至关重要。鉴于此,本文将重点分析不同病理特征DCIS患者微浸润发生情况以及相关因素,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年11月—2021年10月我院接收的156例DCIS患者,患者或家属均已签署知情同意书。纳入标准:DCIS符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[4]中诊断标准,且经手术病理确诊;均于本院接受手术治疗;均为初次确诊的女性患者;可正常沟通,依从性较好患者。排除标准:既往存在乳腺手术史患者;伴有肝、肾等重要脏器功能不全;于院外已行手术或放化疗患者;合并其他恶性肿瘤患者;双侧乳腺癌患者。
1.2 方法
1.2.1 DCIS患者微浸润发生诊断标准:全部患者均按照美国国立综合癌症网络指南进行对症治疗,手术方式主要为保乳手术以及乳房全切术,术后所有病理切片由2名具有5年以上临床经验的病理医师参照美国癌症联合委员会和世界卫生组织[5]相关标准进行复诊:浸润灶最大径≤1mm;存在多个浸润灶,每个浸润灶最大径均≤1mm,不可累加。符合上述条件的为发生微浸润,纳入发生组,反之纳入未发生组。如果2名医师复诊结果不一致,需进行商讨达成一致,以保证结果的准确性。
1.2.2 病理检测指标及免疫组化:采用免疫组化链霉菌抗生物素蛋白—过氧化物酶联结法检测病理组织中孕激素受体(PR)、雌激素受体(ER)、人表皮生长因子受体-2(HER-2)和Ki-67表达,上述单克隆抗体均采自北京中杉金桥生物技术有限公司。其中ER和PR阳性定义为≥1%肿瘤细胞核染色阳性;HER-2阳性定义为先依据标准免疫组化法进行检测,结果为“+++”为阳性,“+”和“-”为阴性,对于“++”的患者再依据荧光原位杂交法检测HER-2基因扩增状态,阳性为有扩增,阴性为未扩增;Ki-67高表达定义为阳性细胞数≥14%,反之为低表达。
1.2.3 基线资料统计方法:设计患者基线资料表,询问并记录研究所需资料,内容包括:(1)一般资料:年龄、部位(左侧、右侧)、基础疾病史(有、无;包括高血压、糖尿病、高脂血症)、恶性肿瘤家族史(有、无)、人工流产史(有、无)、绝经情况(是、否);(2)病理特征:肿瘤最大直径、粉刺样坏死(有、无;判定标准:依据肿瘤基底膜内的实性上皮细胞增生伴中心坏死为标准)、组织学分级(低分级、中高分级;按照癌细胞核级别为基础,参考癌细胞的极化及坏死情况,其中细胞核轻度异型不伴坏死为低分级,细胞核中度异型伴坏死为中分级,细胞核高度异型伴或不伴坏死为高分级)、ER(阳性、阴性)、PR(阳性、阴性)、HER-2(阳性、阴性)、Ki-67(高表达、低表达)。
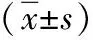
2 结果
2.1 DCIS患者微浸润发生情况 156例DCIS患者经术后病理检查,有30例患者发生微浸润,占比19.23%(30/156);126例患者未发生微浸润,占比80.77%(126/156)。
2.2 发生组与未发生组基线资料比较 发生组肿瘤最大直径、粉刺样坏死、组织学分级与未发生组比较,差异有统计学意义(P<0.05);组间年龄、部位、基础疾病史、恶性肿瘤家族史、人工流产史、绝经情况、ER、PR、HER-2、Ki-67比较,差异无统计学意义(P>0.05)。见表1。
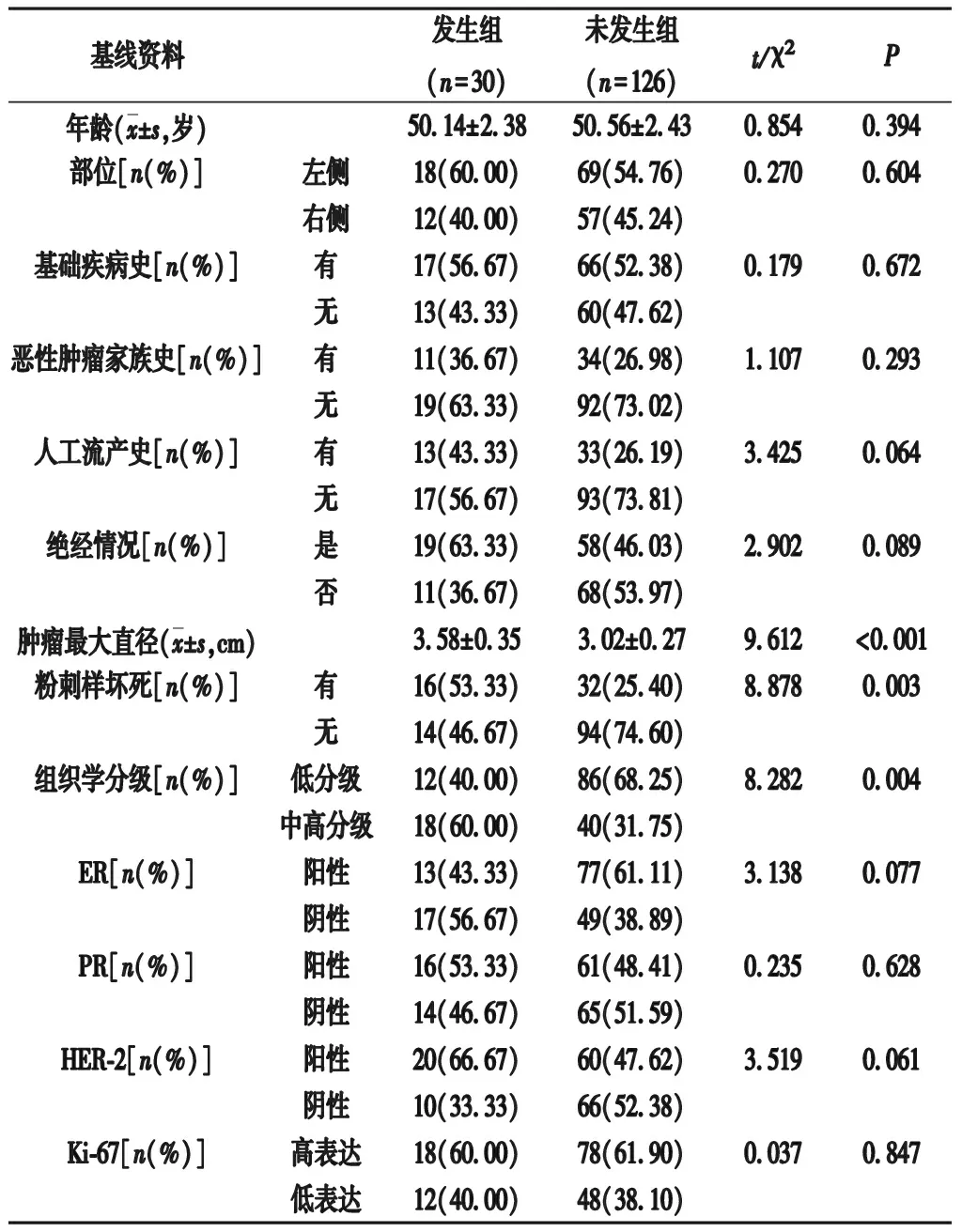
表1 两组基线资料比较
2.3 不同病理特征DCIS患者微浸润发生的影响因素的Logistic回归分析 将表1中初步基线资料比较差异有统计学意义的变量(肿瘤最大直径、粉刺样坏死、组织学分级)作为自变量并赋值说明,见表2;将DCIS患者微浸润发生情况作为因变量(1=发生,0=未发生)。经Logistic回归分析,结果显示,肿瘤最大直径长、有粉刺样坏死、组织学分级为中高分级均是DCIS患者微浸润发生的影响因素(OR>1,P<0.05)。见表3。
3 讨论
DCIS主要特征为乳腺导管上皮细胞恶性生长,未突破基底膜,仅局限于小叶上皮系统,临床治疗DCIS常采用手术切除病灶,通常预后较好[6]。但如不及时采取有效治疗,随着病情发展,易进展为浸润性导管癌,对患者生命安全造成威胁。DCIS-Mi是DCIS进展为浸润性癌的过渡阶段,与DCIS相比有着更高的转移、侵袭和复发能力,可能代表一个独立的实体肿瘤,且与DCIS患者比较总体生存率较低。相关研究表明,DCIS-Mi占DCIS的10%~20%[7]。本文结果显示,156例DCIS患者经术后病理检查,有30例患者发生微浸润,发生率为19.23%,符合上述研究结果,说明DCIS患者微浸润发生率偏高。因此,积极探寻DCIS患者发生微浸润的影响因素尤为重要。
本文经初步比较术后微浸润发生、未发生的DCIS患者相关基线资料及不同病理特征后,经Logistic回归分析,结果显示,肿瘤最大直径长、有粉刺样坏死、组织学分级为中高分级均是DCIS患者微浸润发生的影响因素。逐个分析原因可能为:(1)肿瘤最大直径长:肿瘤最大直径越长说明原位癌病变程度越大,提高了组织内部的张力,由于肿瘤细胞自身的特性以及具有阿米巴样运动的能力,随着机械性的扩张,易引起DCIS基底膜的不连续性,导致癌细胞突破基底膜,进而发生微浸润[8]。相关研究表明,DCIS-Mi患者肿瘤直径大于DCIS患者肿瘤直径,与本文结果一致[9]。对此建议,医生应注意肿瘤最大直径的大小,仔细反复阅读病理切片,针对肿瘤最大直径长的患者应充分取材,以避免遗漏浸润病灶。(2)有粉刺样坏死:较无粉刺样坏死的DCIS患者而言,有粉刺样坏死的DCIS患者原位癌管壁更容易发生软化、变形,促使癌细胞更易突破基底膜的束缚,浸润周围组织[10]。对此建议,医生应综合考虑患者个体化的差异,对有粉刺样坏死的患者制定更为全面、积极的治疗方案。(3)组织学分级为中高分级:组织学分级为中高分级的肿瘤生物学行为不良,易促使癌细胞突破基底膜,较组织学分级低的患者更容易发生微浸润。李爽等[11]研究结果说明,与DCIS患者比较,导管原位癌发生微浸润的患者组织学分级更高,与本文结果一致。对此建议,医生应及时检测患者组织学分级,针对不同分级的患者商讨出个性化的手术方案,以改善患者预后。此外,有相关研究表明,ER表达阴性和HER-2表达阳性说明癌细胞有更强突破基底膜、浸润周围组织的能力[12]。而本文结果显示,两组在ER和HER-2表达上无明显差异,可能与本研究样本量较少、纳入和排除标准不同有关,得出的数据可能存在一定偏倚,未来仍需进一步研究,纳入更多的样本量,联合其他检测方法,为后续临床提供可靠的数据支持。
综上所述,DCIS患者发生微浸润可能与肿瘤最大直径、粉刺样坏死、组织学分级等病理特征因素有关,临床应针对上述不同病理特征制定针对性干预方案,以降低DCIS患者微浸润发生率,改善患者预后。

