猪IFN-δ5的表达纯化及其抗PEDV感染的作用分析
宋诗莹,郭玮璐,夏学峰,张 雪,毕振威,张雪寒,范宝超,董海龙,李 彬
(1.西藏农牧学院动物科学学院,林芝 860000;2.江苏省农业科学院兽医研究所,南京 210014)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种以腹泻、呕吐、脱水为主要临床症状的病毒性疾病,对全世界养猪业的健康发展造成了严重威胁[1-2]。PEDV为单股正链RNA病毒,基因组全长约28 kb,属冠状病毒科冠状病毒属,其可感染所有年龄段仔猪,对新生仔猪危害最大[3]。2010年,中国南方暴发严重PED疫情,造成了巨大的经济损失[4],经病原学研究证实造成该疫情的元凶为PEDV变异株,与经典毒株相比,PEDV变异株致病性更强,可造成新生仔猪100%死亡[5-6]。目前虽已有商品化疫苗,但其效果并不理想,因此,研究有效的预防和抵抗PEDV变异株感染方法具有重要意义。
干扰素(interferons,IFNs)是抵御病毒感染的第一道防线,在抗病毒感染中发挥着重要作用。在抗病毒免疫应答中,IFNs的主要功能是诱导抗病毒蛋白的表达,并进一步激活抗病毒反应。通常,根据细胞表面受体结构的不同可将IFNs分为3个亚型:Ⅰ、Ⅱ和Ⅲ型。Ⅰ型IFNs包括IFN-α、IFN-β、IFN-ε、IFN-ω、IFN-κ、IFN-δ、IFN-τ和IFN-ζ,在抗病毒免疫反应中起直接作用[7];Ⅱ型IFN,即IFN-γ,由T淋巴细胞和自然杀伤细胞识别感染细胞而产生[8];Ⅲ型IFNs包括IFN-λ1、IFN-λ2和IFN-λ3,通过类似于Ⅰ型IFNs的独特受体复合物调节抗病毒免疫应答[9-10]。
针对PEDV的感染,目前研究主要集中于IFN-α和IFN-λ上,且相关研究发现,猪IFN-λ比IFN-α更能有效减少PEDV在肠上皮细胞中的感染,这可能与IFN-λ主要作用于黏膜上皮,在胃肠道黏膜感染中起关键作用有关[11-13]。而作为Ⅰ型IFNs的成员之一,IFN-δs于1993年由Lefevre等[14]首次发现,直到近年来Cochet等[15]通过基因组数据库筛选报道了数个IFN-δs不同亚型的相关序列,表明IFN-δs存在于众多偶蹄动物中,并在基因组中形成一个明显的簇。猪IFN-δs(pIFN-δs)共有11个功能基因,对猪不同组织中的IFN类型进行测定发现,pIFN-δs在猪肠道中大量表达[16],但对其抗猪肠道病毒感染尤其抗PEDV感染的效果尚不清楚。试验前期研究中对PEDV感染后仔猪肠道进行了转录组分析,发现相较于其他IFN亚型,pIFN-δ5呈显著上调趋势。鉴于此,试验采用原核表达系统表达纯化了pIFN-δ5,并对其抗PEDV感染的效果进行了探究,以期为新抗PEDV药物的研发提供参考数据。
1 材料与方法
1.1 材料
原核表达质粒pET-32a(+)、Vero细胞、IPEC-J2细胞、牛胚胎肾细胞-MDBK、PEDV AH2012/12株、水泡性口炎病毒(Vesicular stomatitis virus,VSV)及PEDV-N蛋白鼠单克隆抗体均由江苏省农业科学院保存;大肠杆菌DH5α和BL21(DE3)感受态细胞均购自TaKaRa公司;脂质体转染试剂盒Lipofectimine 3000、限制性内切酶EcoR Ⅴ和Hind Ⅲ均购自Thermo Fisher公司;FastPure Cell/Tissue Total RNA Isolation Kit V2、Phanta Max Master Mix、HiScriptⅡ 1st Strand cDNA Synthesis Kit和ChamQ SYBR qPCR Master Mix均购自Vazyme公司;His标签鼠单克隆抗体、HRP标记山羊抗鼠IgG(H+L)、BCA蛋白定量试剂盒及DAPI染料均购自碧云天生物技术公司;β-actin兔多克隆抗体、FITC标记山羊抗鼠IgG(H+L)均购自Proteintech公司;His纯化层析柱PurKine His-Tag Ni-NTA Packed Column购自武汉艾美捷科技有限公司;PD SpinTrap G-25脱盐柱购自Cytiva公司。其他常规试剂均为分析纯。
1.2 pIFN-δ5的扩增及其重组表达质粒的构建与鉴定
采用重组连接的方法获得包含pIFN-δ5的重组表达质粒。根据GenBank中pIFN-δ5基因序列(登录号:NM_001164854.1)设计重组引物:IFN-δ5-F:5′-GCGATATCCAATTCTCTGGGATCCA-TAGGTR-3′;IFN-δ5-R:5′-CGAAGCTTCAAGTG-TGCCTTTTTTCTCTCTT-3′,预计扩增长度为529 bp。
取10 g新鲜无菌猪肝脏组织(采自江苏淮安某生猪养殖场)进行研磨,使用FastPure Cell/Tissue Total RNA Isolation Kit V2提取总RNA,采用HiScriptⅡ 1st Strand cDNA Synthesis Kit将总RNA反转录成cDNA,以其为模板扩增猪pIFN-δ5片段。PCR扩增体系50 μL:2×Phanta Max Master Mix 25 μL,上、下游引物各2 μL,ddH2O 21 μL。PCR反应程序:95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸60 s,共32个循环;72 ℃延伸5 min。
原核表达质粒pET-32a(+)经限制性内切酶EcoR Ⅴ和Hind Ⅲ双酶切,胶回收获得线性化载体;按照重组酶说明书将pIFN-δ5片段与线性化pET-32a(+)载体连接,转化大肠杆菌DH5α感受态细胞,菌液经PCR鉴定后挑取阳性克隆,使用EcoR Ⅴ和Hind Ⅲ双酶切,并送南京擎科生物科技有限公司进行测序,重组质粒命名为pET-pIFNδ5。
1.3 pIFN-δ5的表达、纯化及鉴定
将重组质粒pET-pIFNδ5转化大肠杆菌BL21(DE3)感受态细胞,挑取阳性克隆菌于37 ℃培养,当D600 nm值达到0.5~0.6,加入终浓度为0.8 mmol/L的IPTG,37 ℃恒温继续诱导培养4 h,离心收集菌体,低温条件下超声破碎,高速离心分别收集上清与沉淀,12.5% SDS-PAGE检测目的蛋白的表达。取pET-pIFNδ5菌液扩大培养至4 L,离心收集菌体后,使用200 mL Buffer A(20 mmol/L Tris-HCl、500 mmol/L NaCl、1 mmol/L PMSF、5%甘油,pH 7.5)重悬,高压破碎3次,13 000 r/min离心30 min,取上清;按照His纯化层析柱PurKine His-Tag Ni-NTA Packed Column操作说明对上清进行纯化,使用Buffer A平衡,使用Buffer B(20 mmol/L Tris-HCl、500 mmol/L NaCl、1 mmol/L PMSF、250 mmol/L咪唑、5%甘油,pH 7.5)洗脱;使用PD SpinTrap G-25脱盐柱将洗脱样品脱盐至PBS中,获得纯化蛋白。纯化后的蛋白采用高效液相色谱(HPLC)检测纯度,条件为:SEC-HPLC柱;流动相为PBS;流速为0.5 mL/min;进样体积为10 μL;运行30 min。
纯化的pIFN-δ5蛋白经SDS-PAGE后转印至PVDF膜,以小鼠抗6×His标签抗体(1∶2 000稀释)为一抗、山羊抗鼠IgG-HRP(1∶10 000稀释)为二抗进行Western blotting鉴定。使用BCA蛋白定量试剂盒检测蛋白浓度,0.22 μm 微孔滤膜过滤除菌后分装,-80 ℃保存备用。
1.4 pIFN-δ5的比活性测定
参考文献[17-18],使用VSV/MDBK系统测定pIFN-δ5比活性。将MDBK细胞铺96孔培养板,37 ℃、5% CO2细胞培养箱培养至单层,设置不加pIFN-δ5和VSV空白对照、不加pIFN-δ5加VSV阳性对照、加pIFN-δ5不加VSV阴性对照;细胞使用D-Hank’s液清洗2次,用含2% FBS的DMEM将纯化的pIFN-δ5按照2×101、2×102、2×103、2×104、2×105、2×106稀释度进行倍比稀释,每孔加入倍比稀释的pIFN-δ5 100 μL,每个稀释度设5个重复,37 ℃、5% CO2细胞培养箱培养12 h;细胞用D-Hank’s液洗2次,每孔加入含100 TCID50的VSV溶液100 μL。以细胞病变效应作为判定结果,于37 ℃、5% CO2细胞培养箱中继续培养至空白对照组无细胞病变,阴性对照组无细胞病变,阳性对照组75%以上细胞出现病变时,计算pIFN-δ5比活性效价。
1.5 pIFN-δ5的细胞毒性测定
采用CCK8方法检测pIFN-δ5对细胞增殖的影响[19]。取IPEC-J2细胞铺96孔板,待长满单层,加入含不同浓度(10、50、100 ng/mL)pIFN-δ5的细胞维持液(含有2% FBS的DMEM),并设立单独维持液对照(0 ng/mL),37 ℃分别孵育4、8、12、16、24和36 h;吸弃维持液,加入100 μL含有10% CCK8试剂的新鲜培养基,继续孵育2 h,使用酶标仪测量450 nm处的吸光度。试验重复3次,使用测得样品与对照D450 nm值的比值进行结果判定。
1.6 pIFN-δ5的抗病毒检测
参考Zhang等[20]方法检测pIFN-δ5的抗病毒活性。取IPEC-J2细胞铺24孔板,待细胞汇合度至80%,加入含有不同浓度(0、5、10、50 ng/mL)的pIFN-δ5细胞维持液,继续培养12 h,进行预处理;吸弃维持液并使用无菌PBS洗涤3次,采用含100 TCID50PEDV变异株AH2012/12和5 μg/mL胰酶无血清培养基孵育细胞,37 ℃作用1 h,洗涤3次;加入含相同预处理浓度的pIFN-δ5、5 μg/mL胰酶无血清维持液,继续培养24 h,并按照相同处理方式设置无pIFN-δ5处理未接毒的对照组(NC);接毒后24 h收取细胞上清样品,进行PEDV基因拷贝数的检测[19,21-22];使用无水乙醇和蛋白裂解液分别固定和裂解细胞样品,进行PEDV N蛋白的间接免疫荧光、Western blotting测定及其蛋白灰度分析[19],综合评价原核表达重组蛋白pIFN-δ5对PEDV的抗病毒效果。
1.7 统计分析
应用GraphPad Prism 6.0软件对测定后数据进行单因素方差分析(One-Way ANOVA)及后续Tukey检验,结果以平均值±标准差表示。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 重组质粒pET-pIFNδ5的构建与鉴定
PCR扩增产物经1.0%琼脂糖凝胶电泳检测,在529 bp左右出现目的条带,与预期相符(图1A)。通过重组连接方法筛选获得重组质粒pET-pIFNδ5,经EcoR Ⅴ和Hind Ⅲ双酶切获得片段大小分别约为5 900和529 bp(图1B),与pET-32a(+)空载体质粒及目的条带大小一致。对重组质粒测序所获序列进行比对发现,与GenBank中pIFN-δ5序列(登录号:NM_001164854.1)一致,未发现突变。
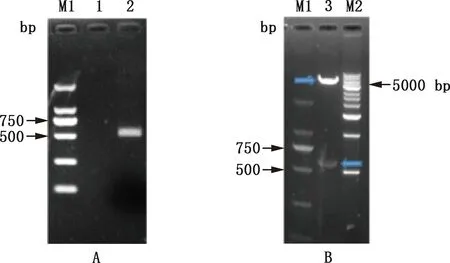
M1,DL2000 DNA Marker;1,阴性对照;2,pIFN-δ5基因PCR扩增;3,pET-pIFNδ5双酶切鉴定;M2,1 kb plus DNA MarkerM1,DL2000 DNA Marker;1,Negative control;2,PCR amplification of pIFN-δ5 gene;3,Double enzyme digestion identification of recombinant plasmid pET-pIFNδ5;M2,1 kb plus DNA Marker图1 pIFN-δ5基因的PCR扩增(A)及重组质粒pET-pIFNδ5的双酶切鉴定(B)Fig.1 PCR amplification of pIFN-δ5 gene (A) and double enzyme digestion identification of recombinant plasmid pET-pIFNδ5 (B)
2.2 pIFN-δ5蛋白的可溶性表达分析
将pET-pIFNδ5质粒转化大肠杆菌BL21(DE3)感受态细胞,挑取阳性菌落培养并诱导表达后,超声裂解获得菌体上清和包涵体,对其进行SDS-PAGE鉴定发现,pET-pIFNδ5诱导表达后上清中出现与预期大小(约35 ku)一致的蛋白条带(图2A);进一步对菌体上清进行Western blotting检测发现,在约35 ku处出现特异性条带(图2B)。表明pET-pIFNδ5成功表达,且目的蛋白表达于上清。
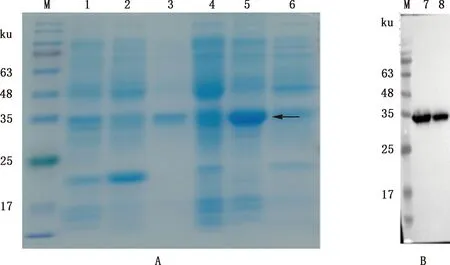
①A,SDS-PAGE分析;B,Western blotting检测。②M,蛋白质分子质量标准;1,空载体诱导上清;2,空载体诱导沉淀;3,pET-pIFNδ5未诱导上清;4,pET-pIFNδ5未诱导沉淀;5,pET-pIFNδ5诱导上清;6,pET-pIFNδ5诱导沉淀;7、8,pET-pIFNδ5诱导上清样品①A,SDS-PAGE analysis;B,Western blotting detection.②M,Protein Marker;1,Supernatant of induced empty vector;2,Precipitate of induced empty vector;3,Supernatant non-induced of pET-pIFNδ5;4,Precipitate of non-induced pET-pIFNδ5;5,Supernatant of induced pET-pIFNδ5;6,Precipitate of induced pET-pIFNδ5;7 and 8,The induced supernatant samples of pET-pIFNδ5图2 重组质粒pET-pIFNδ5的诱导表达Fig.2 Induced expression of recombinant plasmid pET-pIFNδ5
2.3 pIFN-δ5蛋白的表达及纯化
由图3可知,洗脱样品中含有与预期大小一致的纯化目的蛋白,经浓度测定为1.0 mg/mL。经HPLC分析发现,目的蛋白纯度高达97.86%(图4)。
2.4 pIFN-δ5纯化蛋白的比活性测定
由表1可知,纯化的pIFN-δ5蛋白能有效抑制VSV对MDBK细胞的致病变,并表现出明显的抗VSV活性,病毒阳性对照组细胞病变效应超过75%,空白和阴性对照组无细胞病变效应;以抑制50%细胞病变的最高稀释倍数作为干扰素比活性,经计算,pIFN-δ5的干扰素比活性为5×104U/mg;依据纯化的pIFN-δ5质量浓度1.0 mg/mL,故pIFN-δ5的比活性为5×104U/mg。
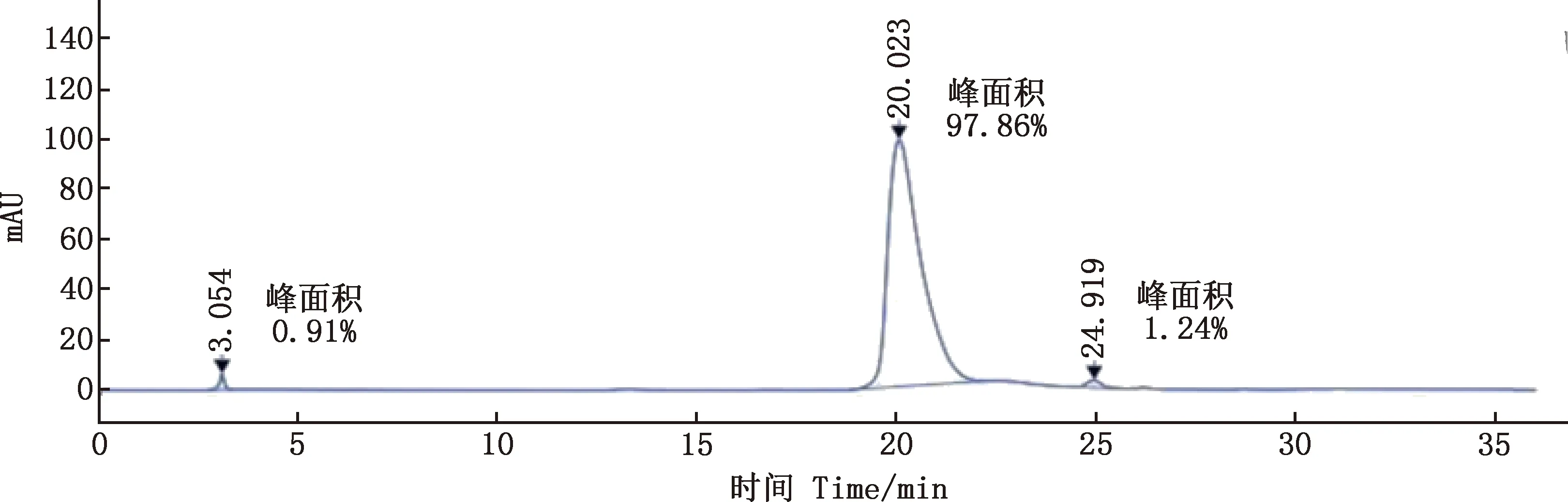
图4 HPLC法检测pIFN-δ5蛋白纯度Fig.4 Determination of purity of pIFN-δ5 protein by HPLC method
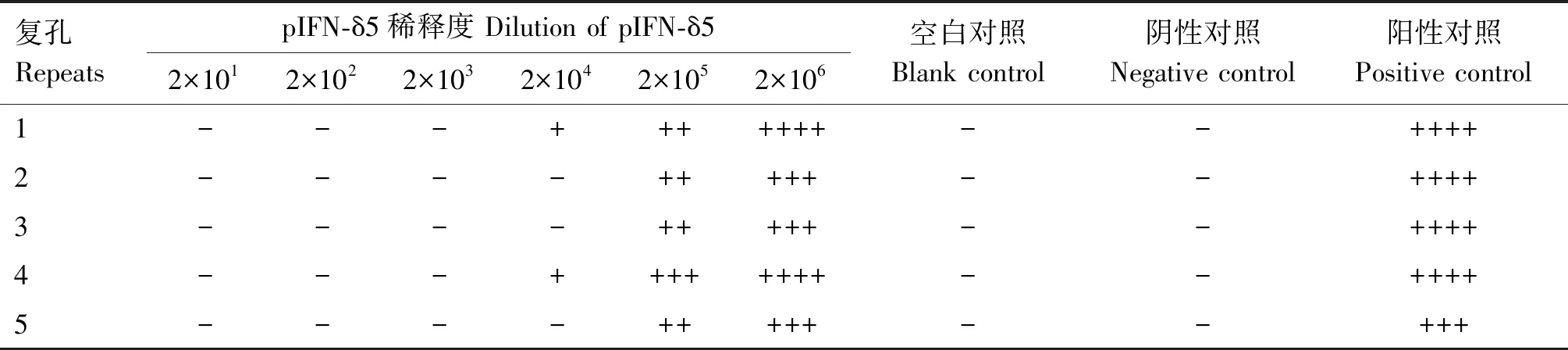
表1 不同浓度pIFN-δ5对VSV的抑制效果
2.5 pIFN-δ5纯化蛋白的细胞毒性测定
采用CCK8方法检测pIFN-δ5蛋白对IPEC-J2细胞增殖能力的影响,结果见表2。由表2可知,与对照组IPEC-J2细胞相比,100 ng/mL pIFN-δ5作用36 h对IPEC-J2细胞的增殖能力有显著抑制作用(P<0.05),表明较高浓度pIFN-δ5具有一定的细胞毒性作用。

表2 pIFN-δ5纯化蛋白对IPEC-J2细胞的毒性测定
2.6 pIFN-δ5抗PEDV感染的效果测定
采用不同浓度pIFN-δ5处理并测定其抗PEDV感染能力,结果显示,与0 ng/mL pIFN-δ5组相比,10和50 ng/mL pIFN-δ5组细胞上清中PEDV基因拷贝数显著或极显著降低(P<0.05;P<0.01)(图5A)。Western blotting及蛋白条带灰度比值结果显示,与0 ng/mL pIFN-δ5组相比,PEDV N蛋白表达量显著下调,其中10和50 ng/mL pIFN-δ5组分别存在显著差异和极显著降低(P<0.05;P<0.01)(图5B、5C)。间接免疫荧光结果显示,随着pIFN-δ5处理浓度的增加,PEDV阳性感染细胞数显著或极显著减少(P<0.05;P<0.01)(图6A、6B)。表明pIFN-δ5具有显著的抗PEDV感染的能力,且呈现剂量依赖性。
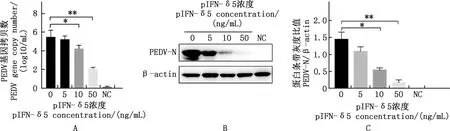
①A,PEDV基因拷贝数分析;B,Western blotting检测;C,蛋白条带灰度分析.②*,差异显著(P<0.05);**,差异极显著(P<0.01)。下同①A,PEDV gene copy number analysis;B,Western blotting detection;C,Protein band gray scale analysis.②*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01).The same as below图5 病毒基因拷贝数及N蛋白表达量测定pIFN-δ5抗PEDV感染效果Fig.5 Theviral gene copy number and N protein expression assays of pIFN-δ5 against PEDV infection

A,间接免疫荧光分析;B,PEDV N蛋白表达阳性细胞数测定A,Immunofluorescence analysis;B,PEDV N protein expression positive cell number assay图6 免疫荧光测定pIFN-δ5抗PEDV感染效果Fig.6 The immunofluorescence assay detection of pIFN-δ5 against PEDV infection
3 讨 论
IFN作为最重要的一种先天性免疫分子,在抗病毒感染中发挥着重要作用。本研究采用原核表达系统表达并纯化了pIFN-δ5蛋白,并对其抗PEDV感染效果进行了初步的测定,发现pIFN-δ5在10 ng/mL低浓度作用下便具有显著的抑制PEDV感染能力,表现出较高的抗病毒活性。PEDV的靶器官为肠道,而Ⅲ型IFN-λ在肠道等黏膜感染中发挥着重要的作用。与Ⅰ型IFNs不同,Ⅲ型IFN-λ主要由上皮细胞、NK细胞和树突状细胞(DC)产生,且主要作用于黏膜上皮[10,23-24],这些特征使IFN-λ成为抗局部黏膜感染的潜在候选药物[25]。而IFN-δs属于Ⅰ型IFNs,具有11个亚型[26],不同亚型间抗病毒活性差异很大,如IFN-δ8具有抗伪狂犬病病毒和口蹄疫病毒感染作用[20,27]。鉴于pIFN-δ5在PEDV感染的仔猪肠道组织中呈上调趋势,本研究选取该亚型IFN-δ进行了原核表达纯化及其抗PEDV感染作用分析。
IFN通过诱导下游的IFN刺激基因(ISG)的表达而发挥其抗病毒作用。研究发现,3种猪IFNs(IFN-α、IFN-λ1和IFN-λ3)均可引起IPEC-J2细胞中抗病毒基因ISG15、OASL、MxA和IFITM1的表达[28]。但是,不同的IFNs诱导ISGs的程度不同,如IFN-α更强烈地上调了IFITM1表达,而pIFN-λs诱导了更高水平的ISG15和MxA[13]。本研究使用纯化的pIFN-δ5孵育IPEC-J2细胞,对多种ISGs基因的表达进行了测定,初步发现Mx1、ISG15和OAS2等多个ISGs呈现显著上调趋势(数据未发表),表明pIFN-δ5具有诱导多种ISGs的能力,但pIFN-δ5诱导ISGs发挥抗病毒作用是否与其他型IFNs存在不同,还需要进一步深入研究。
本试验发现,在pIFN-δ5蛋白表达条件的优化中,加入诱导剂IPTG诱导4 h后,pIFN-δ5蛋白大部分表达于上清中;而继续延长表达时间,虽然蛋白表达量会上升,但表达形式会变成包涵体。所以本研究采用诱导表达4 h后收集菌体,进行蛋白的纯化。IFN的比活性是反映其抗病毒效果的重要指标。先前的多项研究对猪的IFN-α和IFN-λ进行了原核、杆状病毒和酵母等不同形式的表达及纯化,测定的IFN比活性介于103~106U/mg之间[29-31]。本研究中pIFN-δ5的比活性为5×104U/mg,处于中间水平,且其蛋白纯度较高(97.86%),难以通过提高纯度提升比活。但是该亚型IFN的肠道高表达特性及对PEDV的高抑制能力均表明,pIFN-δ5可能在抗猪腹泻相关病毒病中具有较好的应用前景。
4 结 论
本研究构建了pIFN-δ5的原核表达质粒,经诱导条件优化发现pIFN-δ5可表达于上清;经大量表达纯化获得纯度>95%的纯化蛋白,其比活性为5×104U/mg,且pIFN-δ5具有显著的抑制PEDV感染能力。
——一道江苏高考题的奥秘解读和拓展

