牦牛源BVDV非结构蛋白NS5A的原核表达及抗原表位分析
王慧慧,冯茜莉,蒲飞洋,李易聪,汪梦竹,周小凯,赵泽阳,马忠仁,李 倬,马晓霞
(1.西北民族大学生物医学研究中心,兰州 730030;2.西北民族大学生命科学与工程学院,兰州 730010)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是引起牛病毒性腹泻病(bovine viral diarrhea,BVD)及黏膜病(mucosal disease,MD)的主要病原,也称牛病毒性腹泻-黏膜病毒(Bovine viral diarrhea-mucosal diseas virus,BVD-MDV),畜群感染该病毒后临床症状复杂多样,可表现为腹泻、血小板减少、急性或慢性黏膜疾病、免疫抑制、出血综合征和持续性感染,并出现繁殖障碍,即母畜流产、产死胎和畸形胎等,也可由免疫抑制导致呼吸系统、消化系统性疾病[1-2],给全世界范围内的养殖业造成严重的经济损失。BVDV属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),猪瘟病毒(Classical swine fever virus,CSFV)及边界病毒(Border disease virus,BDV)也属于瘟病毒属,它们之间有较高的相似性,且能突破宿主特异性,存在交叉抗原并且多克隆抗体对BVDV和CSFV具有血清学交叉反应[3-4]。BVDV是有囊膜的单股正链RNA病毒,仅有一种血清型,不同毒株间存在遗传多样性,即存在大量基因亚型[5-8]。根据病毒基因组5′-非翻译区(5′-untranslated region,5′-UTR)序列的差异性,可将病毒分为BVDV-1和BVDV-2两个基因型,并且根据病毒液接种细胞后能否产生细胞病变,可把BVDV毒株分为非致细胞病变型(non-cytopathogenic,NCP)和致细胞病变型(cytopathogenic,CP)两种生物型[9-10]。
BVDV基因组全长大约12.5 kb,整个基因组由5′-UTR、开放阅读框 (open reading frame,ORF)和3′-UTR组成。ORF编码区编码一条长约4 000个氨基酸的多聚蛋白前体多肽链,并进一步由细胞和病毒基因编码的蛋白酶加工成成熟的病毒蛋白,包括4个结构蛋白和8个非结构蛋白[11]。这些蛋白在基因组上的位置从N端到C端依次为:Npro-capsid-Erns-E1-E2-P7-NS2-NS3-NS4A-NS4B-NS5A-NS5B。其中Capsid、Erns、E1和E2为BVDV的结构蛋白,构成BVDV的衣壳和囊膜,其余8种为非结构蛋白[12]。这些非结构蛋白在病毒的复制、转录及病毒与宿主的相互作用中起重要作用。其中非结构蛋白NS5A由497个氨基酸残基构成,其编码基因长约1 488 bp,是一种磷酸化酶,可以与多种宿主细胞蛋白作用,同时也是病毒复制子的重要组成部分[13]。此外,NS5A还可以结合病毒5′-UTR,并与3′-UTR互作诱发氧化应激,从而调节病毒基因组的复制[14]。由于对NS5A蛋白的表达功能研究较少,因此本研究利用原核表达系统体外表达NS5A基因,获得非结构蛋白NS5A,为后续病毒与宿主细胞蛋白互作筛选及病毒的免疫学检测奠定基础。利用原核表达系统表达周期短、水平高的特点构建BVDV NS5A原核表达载体,进行原核表达,并对表达蛋白进行鉴定,为进一步研究BVDV非结构蛋白NS5A的生物学功能奠定基础。通过DNAStar预测NS5A蛋白抗原表位,为疫苗和药物研发及BVDV防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 细胞及毒株 牛肾细胞(Madin-Darby bovine kidney cell,MDBK)和BVDV毒株GSTZ由生物工程与技术国家民委重点实验室保存。
1.1.2 主要试剂 Trizol试剂和质粒小提试剂盒均购自Invitrogen公司;琼脂糖、DNA回收试剂盒、50×TAE、PVDF膜均购自Solarbio公司;4×Lodding Buffer、DNA Marker、限制性核酸内切酶Hind Ⅲ和BamH Ⅰ、IPTG、氨苄青霉素、T4 DNA连接酶、pET-28a(+)载体、TaqDNA聚合酶、RNA反转录试剂盒均购自宝生物工程(大连)有限公司;新生牛血清(NBS)、DMEM培养基、胰酶均购自兰州民海生物工程有限公司;鼠抗His多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG购自北京康为世纪生物科技有限公司;其他试剂均由生物工程与技术国家民委重点实验室提供。
1.1.3 主要仪器 核酸电泳仪(BIO-RAD)购自北京市六一仪器厂;超声细胞破碎仪(SC2ENT2-650-E)购自宁波新芝生物科技股份有限公司;化学发光分析仪(WD-9423C)购自北京六一生物科技有限公司;台式摇床(KB3-D)购自杭州瑞城仪器有限公司;CO2培养箱(3111)购自赛默飞世尔科技公司;酶标仪(1530)、梯度PCR仪(K960)购自力新仪器(上海)有限公司;水浴锅(HH-1)购自北京科伟永兴仪器有限公司;超低温冰柜(DW-86L386)购自海尔集团。
1.2 方法
1.2.1 病毒RNA的提取 将从牦牛血清中分离到的BVDV GSTZ毒株接种到MDBK细胞中进行增殖,每隔24 h观察1次,发现细胞病变,即细胞脱落变圆、聚集成堆、细胞瓶上出现空泡变性时收取细胞,同时设不接毒的细胞为阴性对照,于-80 ℃反复冻融3次,根据Trizol法提取RNA的说明书提取病毒RNA,于-80 ℃保存备用。
1.2.2 引物的设计与合成 根据GenBank中公布的BVDV-1型毒株V006的NS5A基因核苷酸序列(GenBank登录号:KX170647),利用Primer Premier 5.0软件设计1对特异性检测引物(BVDV NS5A-F:5′-CCCAAGCTTATGTCTGGGAA-3′,BVDV NS5A-R:5′-TATACAATGAAGCTAGGATCCGCG-3′)扩增NS5A基因,预期扩增片段大小为1 488 bp,下划线部分分别为Hind Ⅲ和BamHⅠ的酶切位点。引物由金唯智生物有限公司合成。
1.2.3 PCR扩增BVDVNS5A基因 利用反转录试剂盒将提取的病毒总RNA反转录成cDNA,以cDNA为模板扩增NS5A基因,反应体系参照反转录试剂盒说明书。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,共32个循环;72 ℃延伸10 min。1.0%琼脂糖凝胶电泳鉴定PCR产物,用胶回收试剂盒回收目的片段,于-20 ℃保存备用。部分产物送西安擎科生物技术有限公司测序,用于遗传进化分析。
1.2.4NS5A基因遗传进化分析 从GenBank中找出17株BVDVNS5A基因序列,分别为:C24V株(GenBank登录号:AF091605)、VEDEVAC株(GenBank登录号:AF268278)、C413株(GenBank登录号:AF002227)、KS86-1cp株(GenBank登录号:AB078952)、KS86-1ncp株(GenBank登录号:AB078950)、Osloss株(GenBank登录号:M96687)、p24515株(GenBank登录号:AY149216)、SD-1株(GenBank登录号:M96751)、New York 93株(GenBank登录号:AF502399)、ZM-95株(GenBank登录号:AF526381)、Singer_Arg株(GenBank登录号:DQ088995)、KE9株(GenBank登录号:EF101530)、p11Q株(GenBank登录号:AY149215)、XJ-04株(GenBank登录号:FJ527854)、JZ05-1株(GenBank登录号:GQ888686)、Hokudai-Lab/09株(GenBank登录号:AB567658)和CP7株(GenBank登录号:U63479)。应用DNAStar中Clustal W Method和Mega 5.0软件对上述病毒株NS5A基因的核苷酸序列进行比对,绘制遗传进化树并分析[15-16]。
1.2.5 原核表达载体的构建 将NS5A基因和载体pET-28a(+)分别用BamHⅠ和HindⅢ双酶切,酶切产物用1.0%琼脂糖凝胶电泳鉴定,回收酶切产物后进行连接,连接体系10 μL:NS5A酶切产物7 μL,pET-28a(+)酶切产物1 μL,T4 DNA连接酶1 μL,Buffer 1 μL。16 ℃过夜连接。将连接产物转化大肠杆菌DH5α感受态细胞,挑取单克隆菌落进行质粒提取,经BamH Ⅰ和Hind Ⅲ酶切鉴定正确后,将重组质粒送金唯智生物技术有限公司测序,经测序正确的质粒命名为pET28a-NS5A。然后将鉴定正确的重组质粒pET28a-NS5A转化大肠杆菌BL21(DE3)感受态细胞,涂板后挑取单个菌落,于37 ℃培养扩增后进行质粒提取并用BamH Ⅰ和Hind Ⅲ双酶切鉴定,将阳性克隆送金唯智生物科技有限公司测序。
1.2.6 NS5A原核表达及检测 挑取已鉴定的阳性菌落加入到含有50 μg/mL氨苄青霉素的10 mL LB液体培养基中,37 ℃、200 r/min震荡过夜培养,取新鲜菌液按1∶100加至含有氨苄青霉素的LB培养基中,200 r/min震荡培养,在600 nm 吸光度达到0.6~0.8时,加入1 mol/L IPTG,分别诱导3、6、9和12 h,同时设未诱导空载体和未诱导表达载体为对照组,收集2 mL菌液,将收集的菌体4 ℃、12 000 r/min 离心 5 min,弃上清,向沉淀中加入100 μL PBS缓冲液混匀,加入25 μL 4×Loadding Buffer,100 ℃金属浴煮10 min,冷却后取10 μL蛋白样品进行10%聚丙烯酰胺凝胶电泳(SDS-PAGE),并进行考马斯亮蓝染色。另外重组蛋白经10% SDS-PAGE分析后,用湿转转印仪将蛋白从凝胶转移到PVDF膜上,用10 mL 50 g/L脱脂奶粉室温封闭1 h,TBST洗膜3次,每次20 min。然后用一抗鼠抗His多克隆抗体(1∶2 000)4 ℃孵育过夜,TBST洗膜3次,每次20 min。二抗HRP标记的山羊抗小鼠的IgG(1∶5 000)室温孵育1 h。HRP显色分析。
1.2.7 BVDV NS5A蛋白抗原表位的预测 利用DNAStar软件提供的protean模块中的Kyte-Doolittle、Emini、Karplus-Schulz、以及Garnier-Robson和Chou-Fasman方法对NS5A蛋白亲水性、表面可塑性、蛋白柔性以及蛋白的二级结构进行预测;然后利用Jameson-Wolf法预测NS5A蛋白抗原性,并综合蛋白质的亲水性、表面可塑性、蛋白柔性以及二级结构分析NS5A蛋白抗原表位[17-18]。
2 结 果
2.1 GSTZ毒株感染细胞结果
将BVDV GSTZ毒株悬液接种到MDBK细胞中进行增殖,每隔24 h观察1次,48 h时发现细胞出现病变,细胞脱落变圆、聚集成堆,72 h时细胞出现空泡变性,阴性对照则无明显变化(图1),此时收取细胞。
2.2 BVDV NS5A基因PCR扩增结果
BVDVNS5A基因PCR扩增获得了1条1 488 bp的特异性目的条带(图2),与预期一致。
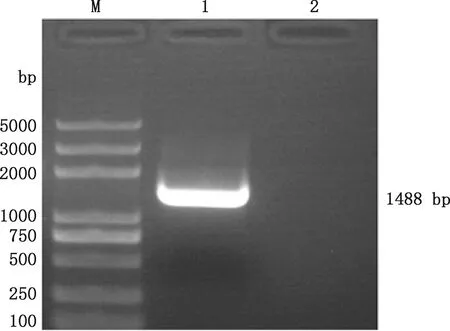
M,DL5000 DNA Marker;1,NS5A基因;2,阴性对照M,DL5000 DNA Marker;1,NS5A gene;2,Negative control图2 NS5A基因PCR产物琼脂糖凝胶电泳分析Fig.2 Agarose gel electrophoresis analysis of PCR products of NS5A gene
2.3 NS5A基因遗传进化分析
遗传进化树结果显示,GSTZ毒株NS5A序列与BVDV-1型毒株Singer Arg株和NS3株的进化关系较近(图3);与BVDV-2型的病变型New York 93株、Hokudai-Lab/09、XJ-04、JZ05-1以及非病变型P4515株、C413株被划分于不同的进化分支上。由此可以推断出GSTZ毒株基因型属于BVDV-1型。
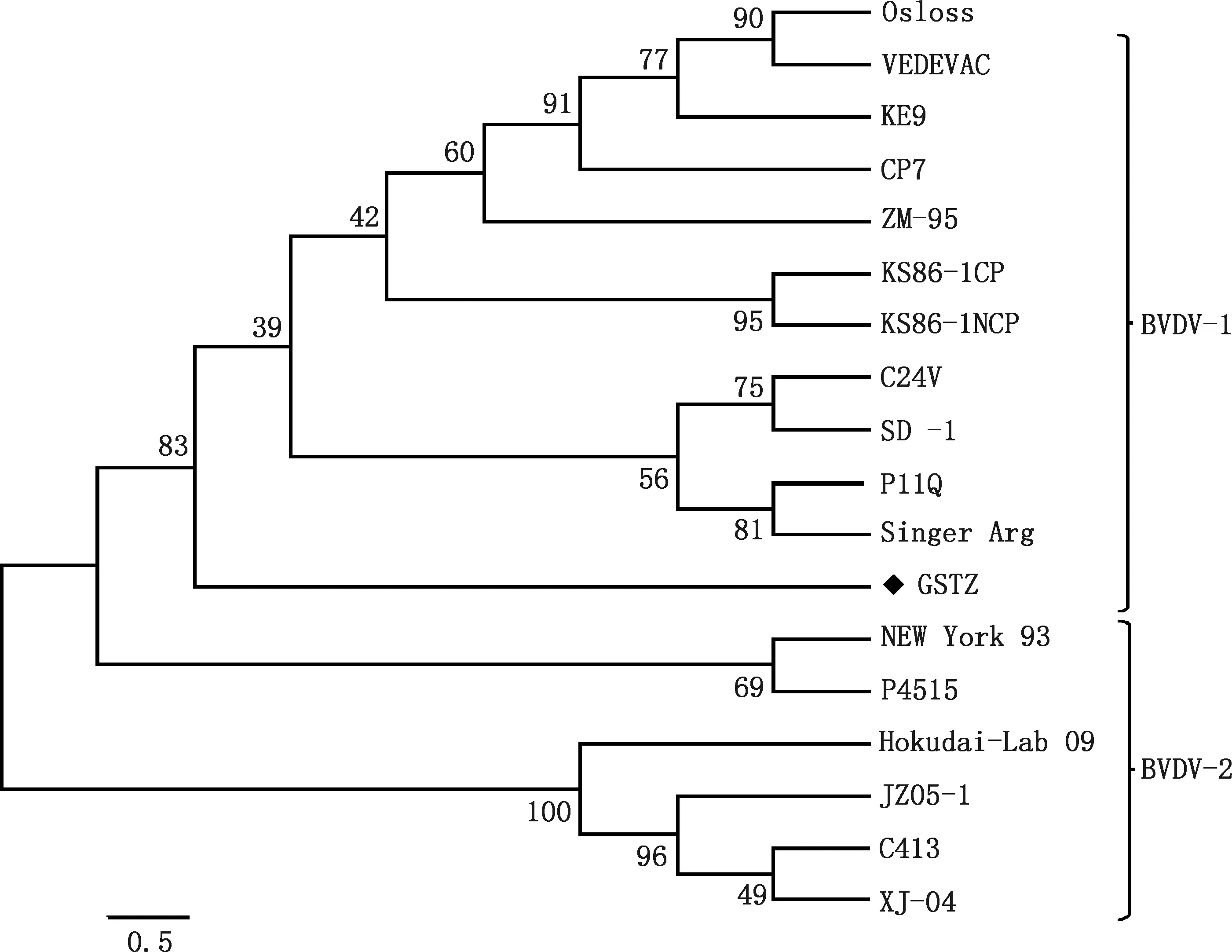
图3 BVDV NS5A基因的系统发育进化树Fig.3 Phylogenetic tree of BVDV NS5A gene
2.4 原核表达载体的构建
随机挑取6个单克隆菌落进行质粒提取,经BamHⅠ和HindⅢ酶切鉴定,分别在1 488 bp和5 369 bp处出现单一条带(图4),表明目标序列与pET-28a(+)表达载体连接成功。测序结果表明,NS5A基因片段正确插入原核表达载体pET-28a(+)中,所构建的原核重组质粒pET28a-NS5A可用于后续相关试验。
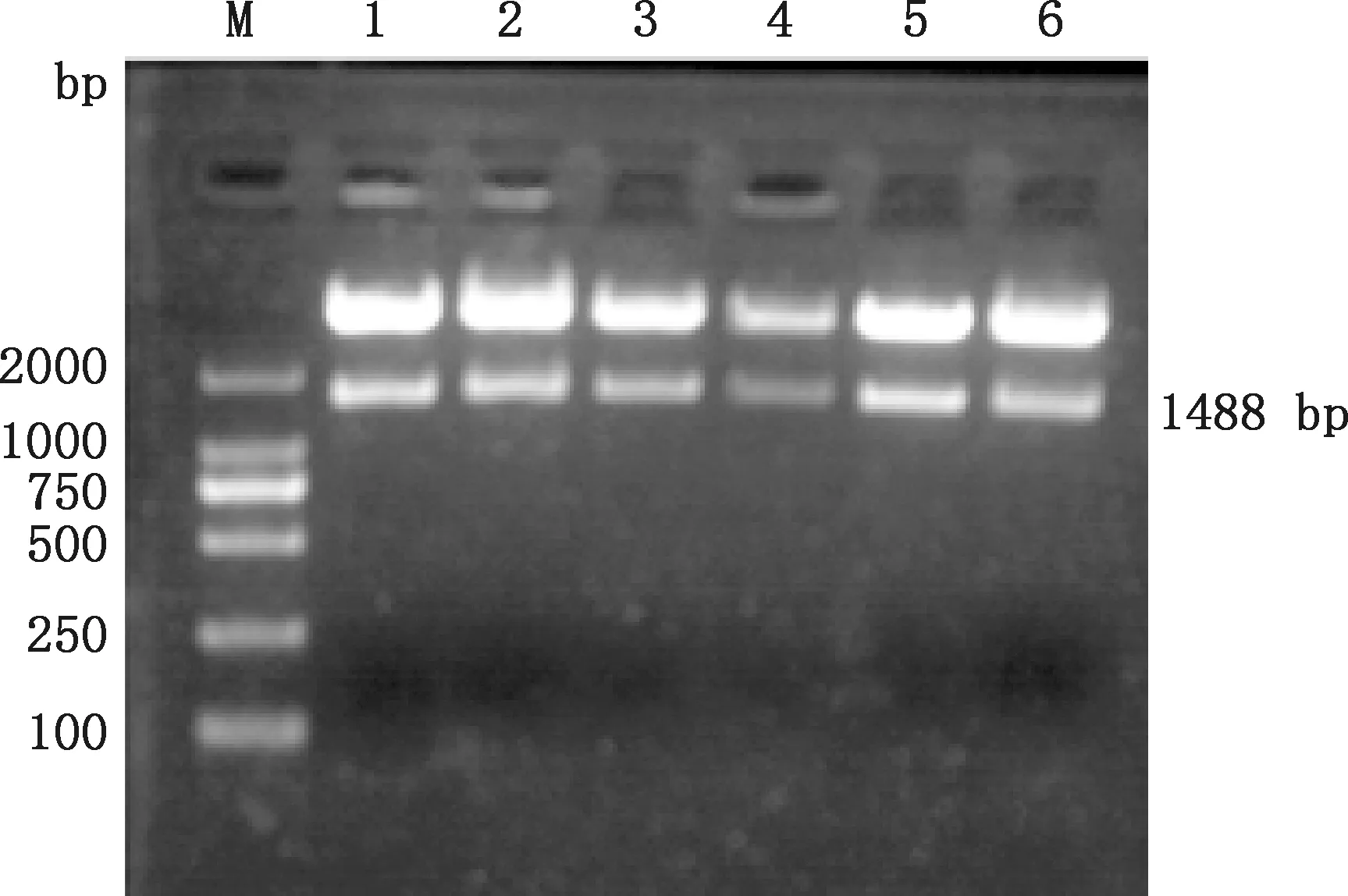
M,DL2000 DNA Marker;1~6,pET28a-NS5A双酶切M,DL2000 DNA Marker;1-6,Double digestion of pET28a-NS5A图4 质粒pET28a-NS5A酶切鉴定Fig.4 Identification of plasmid PET28A-NS5A by enzyme digestion
2.5 pET28a-NS5A诱导表达及Western blotting检测NS5A蛋白的表达
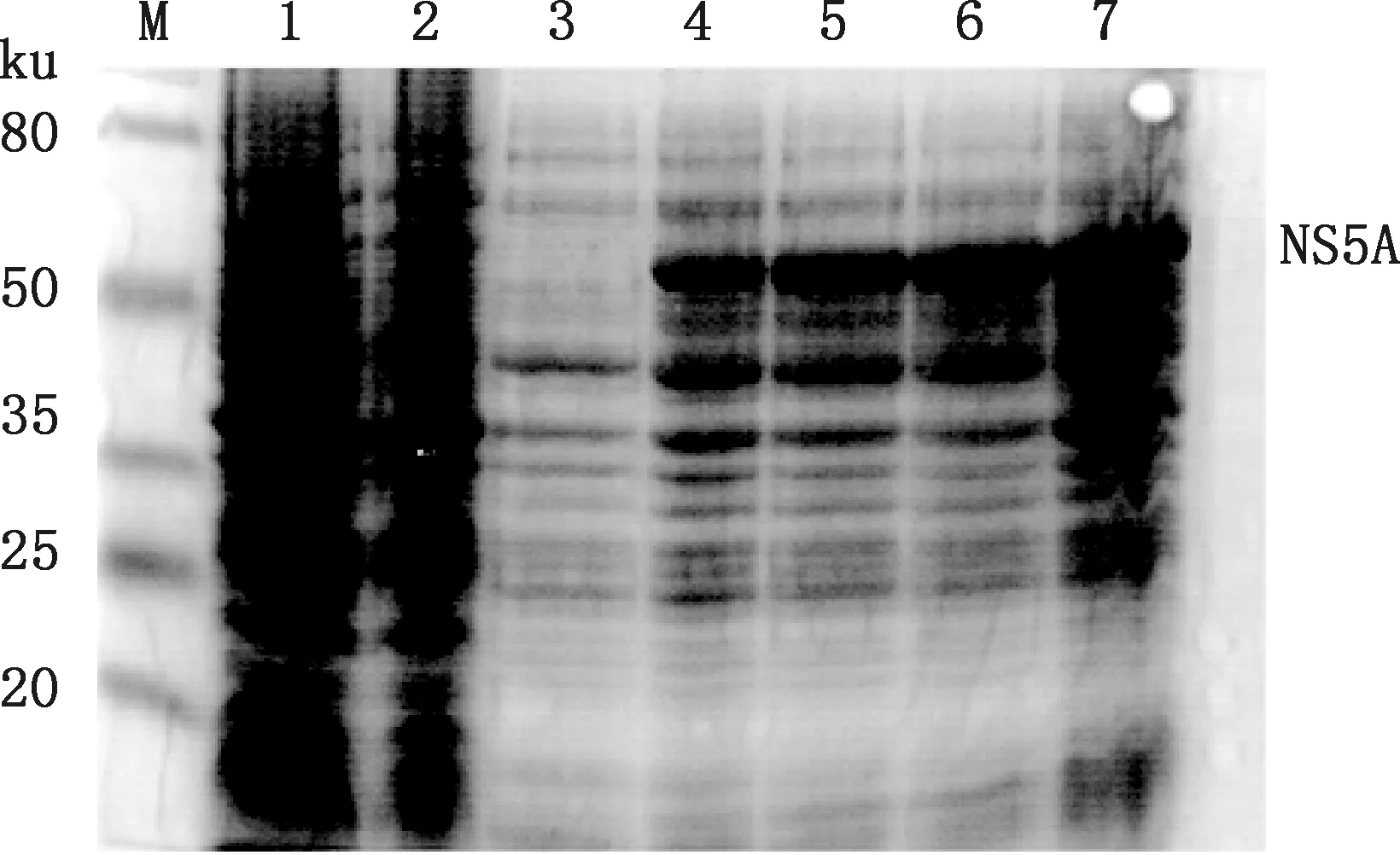
由SDS-PAGE电泳结果可知,与未诱导的pET28a-NS5A重组菌相比,IPTG诱导的pET28a-NS5A重组菌在55 ku处出现目的条带(图5)。为进一步探究NS5A是否在大肠杆菌中有效表达,经Western blotting检测重组蛋白被抗His抗体特异性识别(图6),大小与预期相同,而空载体组并没有出现明显条带。表明NS5A在大肠杆菌中得到了表达。
M,蛋白质分子质量标准;1,未诱导的pET-28a(+);2,未诱导的pET28a-NS5A;3,IPTG诱导9 h后的pET-28a(+);4~7,IPTG分别诱导3、6、9、12 h后的pET28a-NS5AM,Protein Marker;1,pET-28a(+) uninduced;2,pET28a-NS5A uninduced;3,pET-28a(+) induced by IPTG for 9 h;4-7,pET28a-NS5A induced by IPTG for 3,6,9 and 12 h,respectively图5 pET28a-NS5A重组质粒的诱导表达Fig.5 Prokaryotic expression of recombinant pET28a-NS5A plasmid
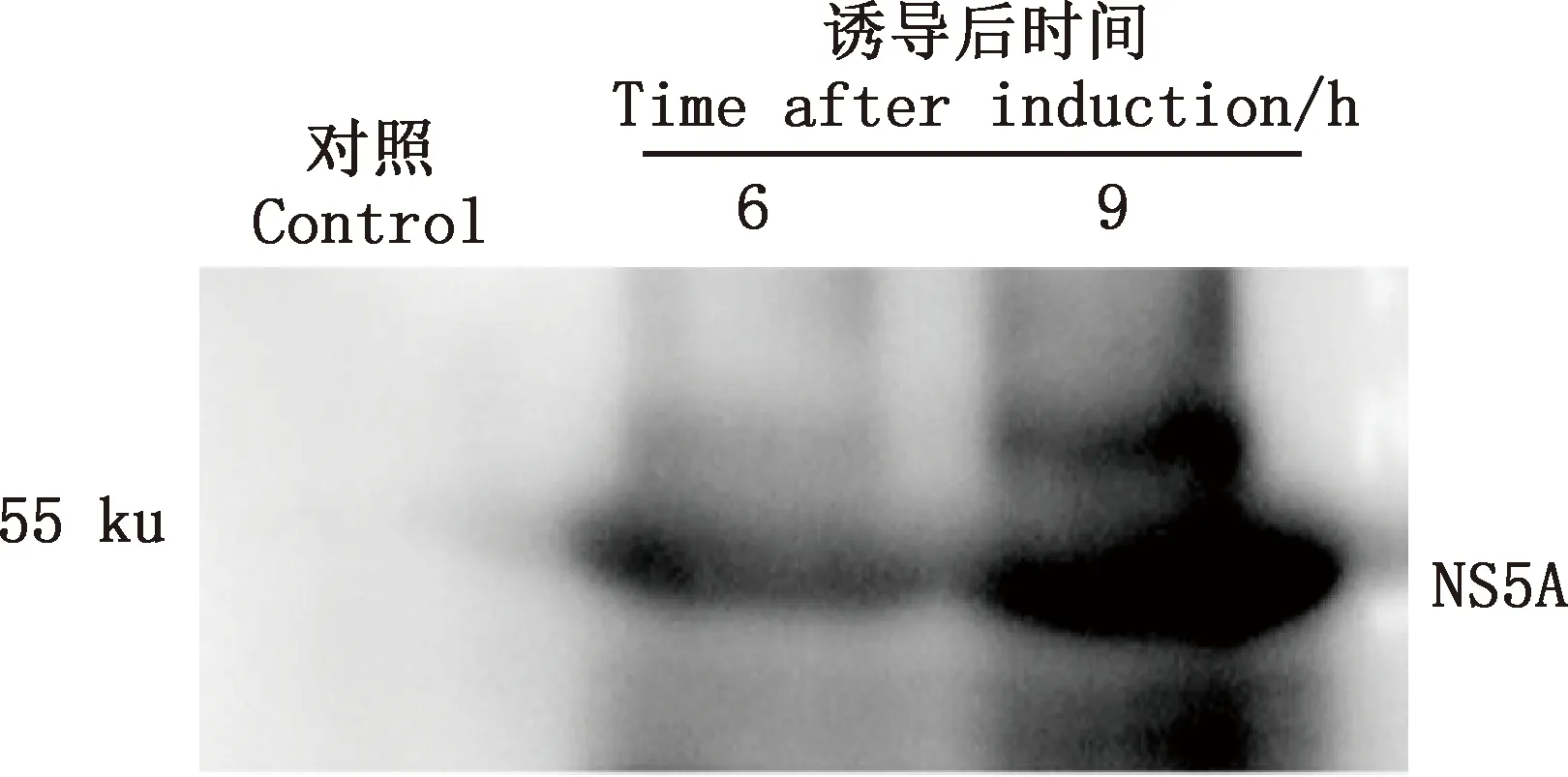
图6 Western blotting 检测NS5A蛋白Fig.6 Detection of NS5A protein by Western blotting
2.6 NS5A蛋白抗原表位预测
2.6.1 NS5A蛋白亲水性及表面可塑性的预测 蛋白亲水性预测结果表明,NS5A蛋白具有较高的亲水性,主要集中在12—21、32—69、75—113、120—135、143—147、152—163、165—180、215—230、265—274、296—340、348—378、389—447、455—463和469—495位氨基酸处(图7)。表面可塑性分析结果显示,NS5A蛋白表面可塑性较高的区域主要为14—18、37—42、76—81、86—109、154—160、169—178、218—228、297—309、348—358、365—373、414—442、430—437、454—460位氨基酸处(图8)。
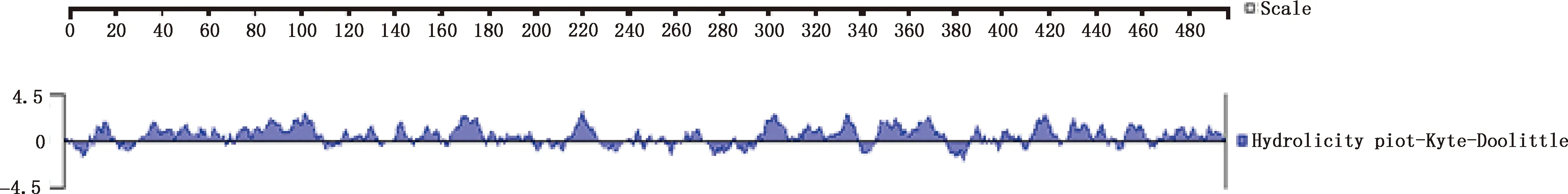
图7 Kyte-Doolittle 预测 NS5A蛋白的亲水性Fig.7 Hydrolicity of NS5A protein predicted by Kyte-Doolittle
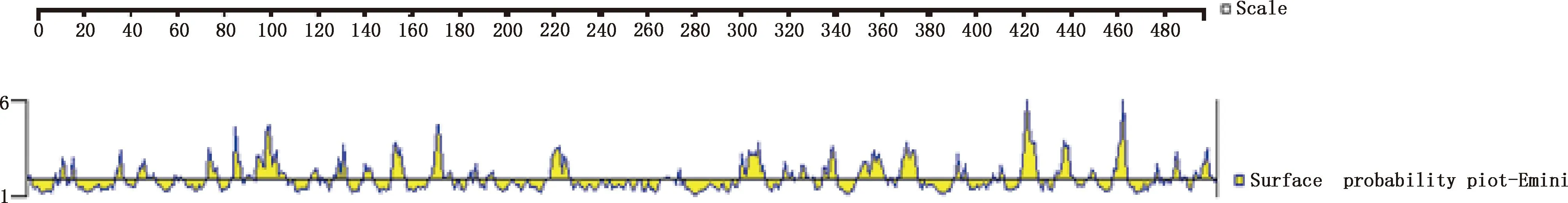
图8 Emini预测NS5A蛋白的表面可塑性Fig.8 Surface accessibility of NS5A protein predicted by Emini
2.6.2 NS5A蛋白柔性区域预测 Karplus-Schulz法预测NS5A蛋白柔性区域,结果显示NS5A蛋白上含有的柔性区域较多,主要位于14—21、37—43、67—82、86—93、97—110、152—158、169—179、218—231、240—255、296—310、313—328、344—359、364—373、413—422和472—483位氨基酸处(图9)。

图9 Karplus-Schulz 预测NS5A蛋白柔性区域Fig.9 Flexible regions of NS5A protein predicted by Karplus-Schulz
2.6.3 NS5A蛋白二级结构的预测 使用Garnier-Robson和Chou-Fasman 2种方法对BVDV NS5A蛋白的二级结构进行分析,发现不同的预测方法对蛋白二级结构的分析存在差异,并且α-螺旋、β-折叠、转角和无规则卷曲特定结构的数目及所处的位置也存在明显差异(图10)。2种方法共有的α-螺旋区域主要集中在105—108、114—118、144—148、173—184、188—194、328—334、372—383、386—413、425—436、448—456和468—478位氨基酸处;共有的β-折叠区域主要集中在5—11、42—43、96—99、112—115、118—129、152—155、157—161、199—209、211—216、229—241、286—296、323—327、339—344、419—424和492—496位氨基酸处;共有的转角区域主要在32—35、37—40、46—50、58—60、88—90、131—135、195—198、301—303、335—337、364—366和440—411位氨基酸处;而Garnier-Robson预测的无规则卷曲位于28—30、69—73、165—171、248—150、304—306、317—322、345—351、366—368和443—447位氨基酸处。

A,α-螺旋;B,β-折叠;T,转角;C,无规则卷曲A,Alpha helix;B,Beta sheet;T,Turn;C,Random coil图10 Garnier-Robson和Chou-Fasman预测NS5A蛋白的二级结构Fig.10 Secondary structure of NS5A protein predicted by Garnier-Robson and Chou-Fasman
2.6.4 NS5A蛋白抗原性预测 NS5A蛋白所在的抗原性区域主要位于15—23、33—114、129—138、141—146、153—160、167—190、193—202、216—228、241—263、270—277、294—341、346—362、364—380、414—424和465—493位氨基酸处(图11)。
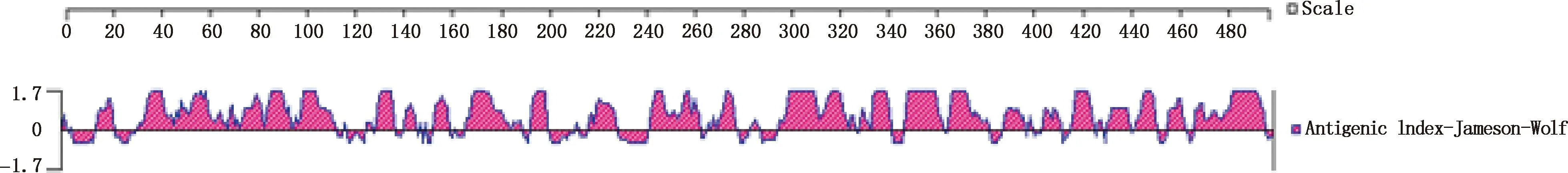
图11 Jameson-Wolf 预测 NS5A蛋白的抗原性Fig.11 Antigenicity of NS5A protein predicted by Jameson-Wolf
综合以上预测和分析,并结合NS5A蛋白的二级结构特点,得出NS5A蛋白存在B细胞优势抗原表位,主要位于15—18、76—81、154—158、169—178、218—228、297—309、348—358、365—373和414—422位氨基酸残基处(表1)。

表1 氨基酸位点
3 讨 论
NS5A蛋白的具体功能虽然尚不明确,但是NS5A复杂多样的功能使其成为抗病毒药物研发的靶标。NS5A蛋白通过和NS3、NS4A、NS4B及NS5B蛋白形成病毒的复制酶复合体,参与病毒基因的复制[19]。其他研究还发现,NS5A蛋白和NS4B蛋白可以和细胞内的囊泡膜结合蛋白A结合[20]。NS5A蛋白在BVDV的生活周期中所扮演的具体角色还没有定论,除了参与病毒基因复制之外,NS5A蛋白对BVDV的蛋白翻译也具有调节作用[21-22]。目前,BVDV疫情在全世界范围内以不同的程度暴发,给养殖业带来严重的威胁,在BVDV基因组5′-UTR内存在着一段特殊的序列,称为核糖体内部进入位点(internal ribosome entry site,IRES),这段序列可以通过和核糖体结合而促进BVDV的蛋白翻译[23]。BVDV NS5A蛋白可以和5′-UTR的IRES结合,从而中断核糖体与IERS的结合,抑制BVDV的蛋白翻译而影响起始病毒的基因复制,使病毒从蛋白的合成阶段进入到病毒基因的复制阶段,这种作用在病毒感染早期具有重要意义。
NS5A蛋白相较于BVDV其他蛋白来说较保守,Fu等[24]的研究表明,BVDV NS5A与翻译延伸因子1α(translation elongation factor 1-α,TEF1-α)的互作关系较为保守,这也可在一定程度上影响BVDV复制。本研究用RT-PCR的方法获得BVDV非结构蛋白NS5A基因,然后将其克隆到原核表达载体pET-28a(+)中,通过酶切和序列测定证实重组质粒构建正确,并利用大肠杆菌诱导表达,通过电泳检测和Western blotting证明非结构蛋白NS5A在大肠杆菌内得到表达。NS5A原核表达载体的成功构建为后期NS5A蛋白功能和致病性机制的研究创造了条件,可以通过NS5A蛋白功能特点及与其他蛋白的互作关系研制抑制病毒复制的相关药物,如黄雯静[25]通过生物信息学软件预测了甲基转移酶3 (methyltransferase-like 3,METTL3)与BVDV NS5A蛋白可能的相互作用关系,为抑制病毒复制奠定基础。本研究也根据DNAStar软件预测分析了NS5A蛋白的二级结构,了解该蛋白的α-螺旋、β-折叠、转角及无规则卷曲等区域的结构分布信息,并从蛋白的亲水性、表面可塑性、柔性和抗原性等方面对NS5A蛋白的抗原表位分布和构成情况进行了全面分析,为深入研究该蛋白的免疫学特性及研发BVDV新型疫苗和药物靶标奠定基础。
4 结 论
本研究成功表达并鉴定了牦牛源BVDV的非结构蛋白NS5A,系统发育进化树表明BVDV GSTZ株基因型属于BVDV-1型,NS5A蛋白的B细胞抗原表位主要位于15—18、76—81、154—158、169—178、218—228、297—309、348—358、365—373和414—422位氨基酸处。
——一道江苏高考题的奥秘解读和拓展

