Peutz-Jeghers 综合征合并多发妇科肿瘤一例
李晶,孔繁斗,汪俊颖
Peutz-Jeghers 综合征(Peutz-Jeghers syndrome,PJS)也称黑斑息肉综合征,是一种常染色体显性遗传病,发病率约为1/200 000~1/8 300[1],其特征性表现为胃肠道错构瘤性息肉、皮肤黏膜色素沉着及多发肿瘤倾向。PJS 多由抑癌基因丝/苏氨酸激酶11(serine/threonine kinase,STK11)胚系突变引起。PJS患者肿瘤发病风险增加,且出现年龄相对较早,到70 岁时,PJS 的患者累积癌症风险为85%[2]。与PJS相关的妇科肿瘤包括卵巢环状小管性索瘤(sex cord tumor with annular tubules,SCTAT)、宫颈微偏腺癌(minimal deviation adenocarcinoma,MDA)、卵巢黏液性肿瘤(ovarian mucinous tumor)和子宫内膜样腺癌等。本例PJS 患者合并卵巢黏液性肿瘤、SCTAT 及MDA,3 种类型肿瘤存在于同一患者在临床上很少见。现对本例患者的临床特征、诊断治疗及随访情况进行报告,并复习相关文献资料。
1 病例报告
患者 女,33 岁,因双侧卵巢肿瘤术后1 年余、再发卵巢囊肿27 d,于2020 年9 月7 日收入大连医科大学附属第一医院(我院)妇产科。患者3 岁时发现口唇、手指及脚趾部黑斑,13 岁就诊于中国人民解放军空军总医院,行胃肠镜检查发现胃部息肉,予切除,病理检查示错构瘤性息肉,肠镜未见异常,临床诊断为PJS。皮肤黏膜黑斑于青春期后逐渐消退。患者每3~4 年定期复查胃镜,未查肠镜。25 岁因小肠息肉发生肠套叠,行小肠部分切除术、阑尾切除术。28 岁于中国人民解放军空军总医院再次行胃、肠息肉切除术,同时行基因检测,存在胚系突变(外周血)STK11 错义突变:c.580G>C,p.Aps194Asn,明确诊断为PJS。患者近3 年定期行宫颈癌筛查,均未见异常。患者既往月经规律,初潮14 岁,经期7 d,周期30 d,量偏多,无痛经,末次月经为2020 年6 月初,此后未再行经。患者24 岁结婚,育有1 女。女儿现3 岁,自出生后6个月口唇、手指及脚趾部出现黑斑,目前未予诊治,无其他明确家族史。
2019 年7 月患者体检时发现双侧卵巢囊肿,呈多囊性,左侧卵巢囊肿直径约5 cm,右侧卵巢囊肿直径约12 cm,同时发现子宫内膜增厚,无腹胀、腹痛、阴道出血等不适,就诊于外院,并于2019 年8 月16 日行腹腔镜下右侧附件切除术、左侧卵巢囊肿剥除术、诊刮术,术中囊肿破裂,术后病理提示双侧卵巢黏液性囊腺瘤,部分上皮增生,可见显微镜下卵巢SCTAT,少许增生状态子宫内膜。术后恢复好,未定期复查。2020 年6 月因自觉腹部增大再次就诊于外院,无腹胀等不适,超声检查发现盆腔肿物,直径约20 cm,在外院于2020 年6 月19 日行腹腔镜下左侧卵巢囊肿剥除术和盆腔粘连松解术,术中囊肿破裂,术后病理提示卵巢黏液性囊腺瘤,部分上皮增生,可见显微镜下卵巢SCTAT,术后恢复好。2020 年8 月10 日于外院行术后复查,超声提示盆腔左侧混合性包块,直径约6 cm,无腹痛、腹胀,无阴道出血和流液等不适。2020 年9 月4 日就诊于我院,门诊以卵巢肿瘤收入我院妇产科。
患者入院查体示:口唇、手指、脚趾散在少许黑斑,下腹部见纵行切口瘢痕。妇科检查示:外阴阴道正常,宫颈表面光滑,子宫前位,正常大小,子宫左后方触及囊肿下极,具体大小触诊不清楚,右侧附件区未及异常。肿瘤标志物检查示:糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)为32.63 U/mL(正常参考值为0~27U/mL),CA125、附睾蛋白4(human epididymis protein 4,HE4)、癌胚抗原(carcinoembryonic antigen,CEA)和甲胎蛋白(alpha fetoprotein,AFP)未见异常。卵泡刺激素(follicle-stimulating hormone,FSH)36.08 U/L(卵泡期3.5~12.5 U/L,黄体期1.7~7.7 U/L,绝经期25.8~134.8 U/L),雌二醇(estradiol,E2)52 pg/mL(卵泡早期15.16~127.8 pg/mL,卵泡中期19.86~148.13 pg/mL,排卵高峰期29.42~442.62 pg/mL,黄体期30.34~274.24 pg/mL,绝经后≤25.1 pg/mL;1 pg/mL=3.66 pmol/L),抗苗勒管激素(anti-Müllerian hormone,AMH)<0.01 ng/mL(0.576~8.13 ng/mL;1 ng/mL=7.14 pmol/L)。宫颈液基薄层细胞学检查(thin-prep cytology test,TCT)未见上皮内病变或恶性病变(negative for intraepithelial lesion or malignancy,NILM)。妇科超声示:子宫大小为43 mm×48 mm×32 mm,轮廓清,形态规则,内膜清晰,厚4 mm,回声欠均匀,盆腔左侧见液暗区72 mm×46 mm×34 mm,内见杂乱分隔,隔上见血流,周边另见不规则液性暗区,见隔膜漂浮;右侧未见明显异常;盆腔积液无;宫颈内见多个液性暗区,最大23 mm×11 mm。提示:盆腔左侧液性占位(卵巢肿瘤并包裹性积液?),宫颈纳囊。全腹CT(平扫+增强)示(见图1):子宫左侧见界清囊状影,最大者直径约为4.1 cm,增强扫描囊壁强化,其内分隔强化;宫颈见不规则囊状未强化影,直径约为2.0 cm。提示:左侧附件区占位,考虑积液可能,囊腺瘤待除外;子宫区低密度灶。

图1 盆腔CT 图
该患者有生育要求,既往2 次手术保留左侧卵巢,但患者卵巢肿瘤短期内反复多次复发,不除外恶性可能,2020 年6 月术后至今未行经,性激素水平提示卵巢储备功能极度降低,且PJS 患者宫颈及子宫肿瘤风险增加,决定切除子宫及左侧附件。与患者及家属充分沟通后,于2020 年9 月11 日以盆腔肿物(左侧卵巢黏液性肿瘤?恶性不除外)为手术指征行全子宫左侧附件切除术、部分大网膜切除术、腹膜活检术及肠粘连松解术。术中无腹水,留取腹腔冲洗液,子宫正常大小,左侧卵巢多囊性极不规则透明肿物,大小7 cm×4 cm×3.5 cm,与直肠前壁致密粘连,与阔韧带后叶膜状粘连,左侧输卵管外观正常,右侧附件缺如,盆腔腹膜散在充血毛糙,大网膜与小肠、乙状结肠、腹壁粘连,回盲部与乙状结肠粘连,小肠间散在相互粘连。分离盆腔粘连,左侧卵巢肿物破裂,流出清亮黏液。切除盆腔明显毛糙腹膜及卵巢粘连带。探查小肠无明显增粗,浆肌层无异常,空肠内密集、回肠内散在大米粒样质软肿物,息肉范围广,未予特殊处理。术后标本:子宫剖开见左侧宫角部粉红色息肉样赘生,直径约0.4 cm,余部内膜不厚,宫颈表面少许黏液,局部腺体增生,肉眼未见明显病变;左侧卵巢多囊性肿物,未见明显正常卵巢组织,囊内黏液清亮(见图2)。术后腹腔冲洗液未见肿瘤细胞。光镜下见:宫颈间质内见形态多样的腺体,腺体位于间质深层,细胞异型性不明显,未见明显核分裂像;卵巢见大量囊腔,囊内衬覆单层黏液柱状上皮及单层扁平上皮,局灶形成小乳头状,细胞异型性不明显(见图3)。术后病理回报:宫颈微偏腺癌,浸润子宫颈全层。左侧卵巢黏液性囊腺癌(高分化,胃型)。子宫内膜息肉,增殖状态子宫内膜。左侧输卵管未见明显病变。送检大网膜、盆腔腹膜未见癌成分。免疫组织化学检查示:(卵巢肿瘤)CEA(部分+),细胞角蛋白20(CK20)(-),CK7(+),雌激素受体(ER,-),Ki-67(+15%),黏蛋白1(MUC1,+),MUC2(-),MUC6(+),P16(-),配对盒基因8(PAX-8,-),孕激素受体(PR,-),网状纤维染色(-);(宫颈肿瘤)CEA(-),ER(-),Ki-67(+25%),MUC1(+),MUC2(-),MUC6(+),PAX-2(-),抗平滑肌抗体(SMA,腺泡周围+),AB-PAS 呈粉红色。患者术后行辅助化疗6 个疗程,化疗方案为卡培他滨联合奥沙利铂(XELOX),最后1 次化疗时间为2021 年4 月2 日,术后随访15 个月无复发征象。
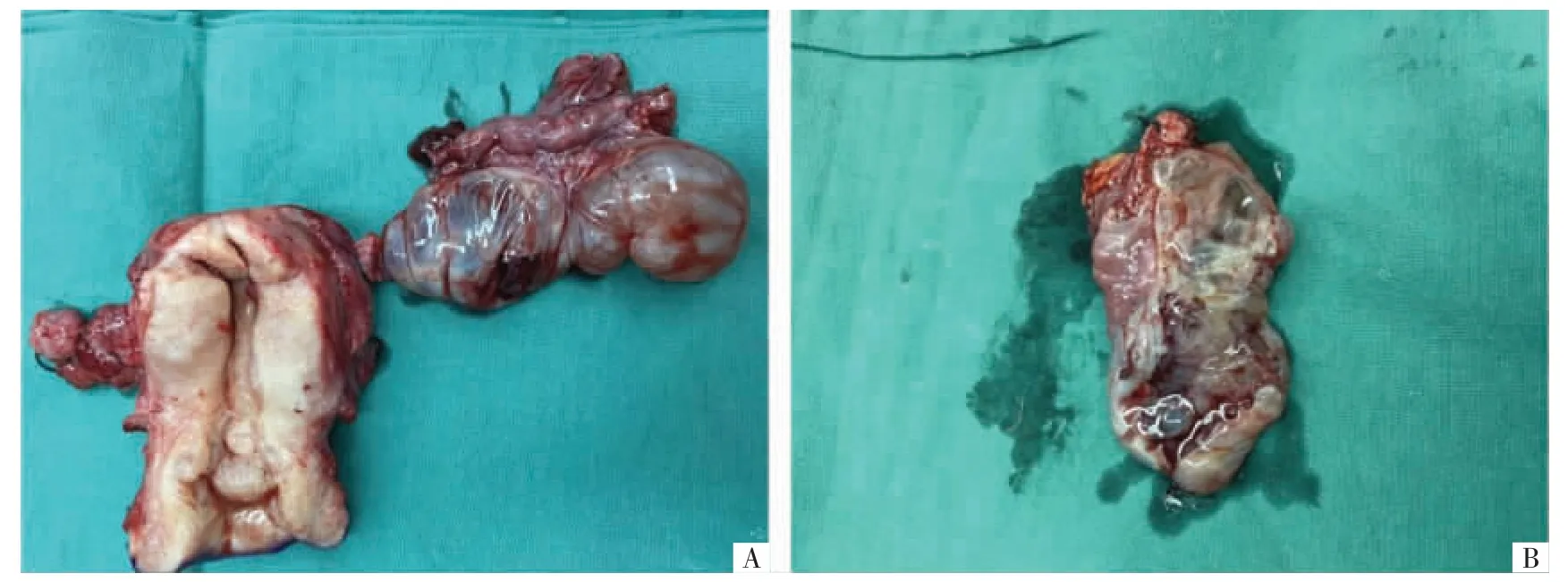
图2 宫颈及附件术后标本
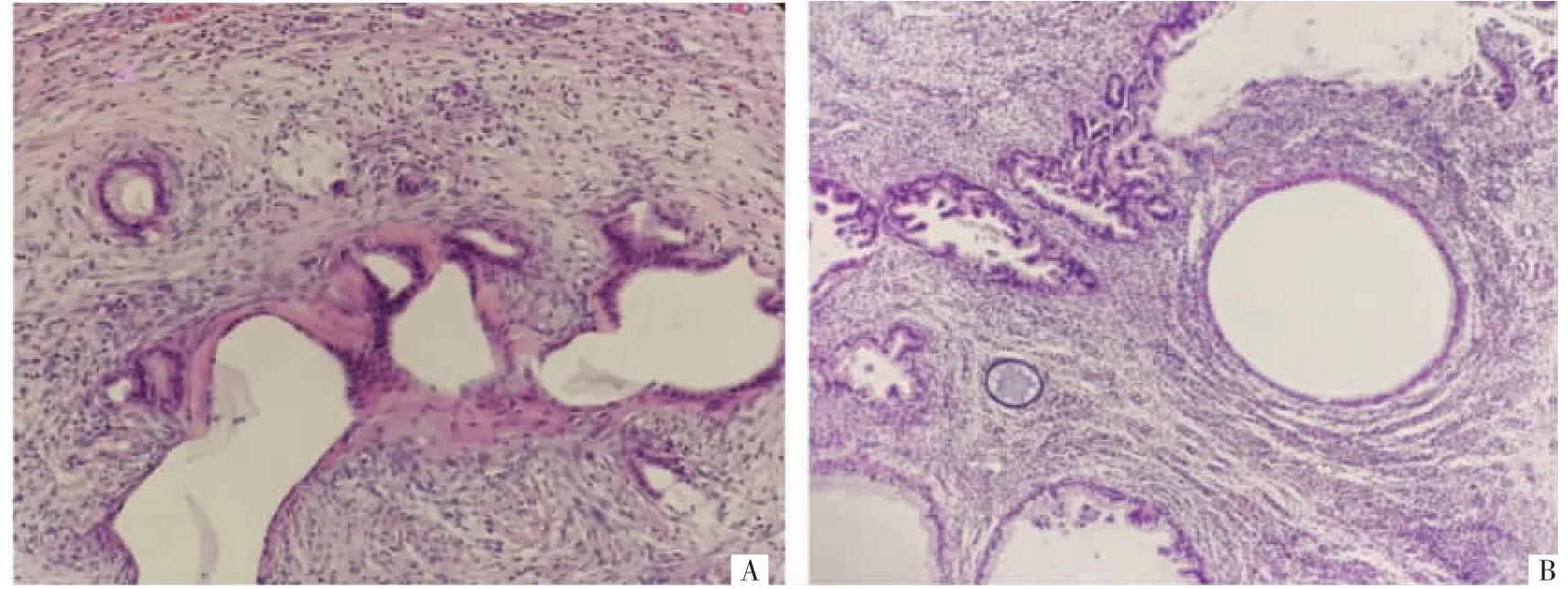
图3 病灶镜下病理图
2 讨论
PJS 与众多卵巢肿瘤的发生有关,如SCTAT、颗粒细胞瘤、Sertoli-Leydig 细胞瘤、囊腺瘤和囊腺癌等,其中以性索间质来源或黏液性肿瘤较为多见。PJS 患者发生黏液性与浆液性肿瘤的比例为8∶1[3],高于一般人群;黏液性卵巢肿瘤以良性或交界性居多,恶性相对少见[4]。主要症状为腹部包块或腹胀,肿瘤多呈多房性,一般较大。治疗的主要方法是手术切除,建议术中送冰冻病理,明确手术范围[4]。本例患者因盆腔包块首次就诊,经卵巢肿瘤剥除术后诊断为良性黏液性囊腺瘤,但2 次剥除术后均短期内复发,最终进展为卵巢黏液性囊腺癌,该患者首次复发后是否应再次行卵巢肿瘤剥除术值得思考。SCTAT 是一种罕见、独特的卵巢性索间质肿瘤,约36%的SCTAT 患者伴有PJS[5]。其病理特征为性索细胞形成简单或复杂的环状小管,核心为嗜酸性透明物质。在PJS 患者中,SCTAT 通常是显微的、多灶性的、双侧的,局灶钙化,且表现为良性[5],恶性极为少见。本例患者SCTAT 偶然发现,临床特点与既往报道相符。
MDA 又称恶性腺瘤,为宫颈胃型腺癌的一个亚型。MDA 患病率极低,约占宫颈腺癌的1%~3%,发病与人乳头瘤病毒(human papilloma virus,HPV)感染无关。目前已证实,PJS 女性患者发生MDA 的比例为15%~30%,约10%的MDA 并发PJS[3]。PJS 相关的MDA 平均发病年龄约为33 岁,早于散发性的55岁[3]。其特点是分化程度高,但具有高度恶性潜能。MDA 症状表现较为多样,且不典型,黏液样阴道分泌物多见,而不规则出血相对少见。妇科检查可呈大体正常的宫颈外观,或多囊性宫颈肥大,病灶常隐藏于宫颈管内,形成所谓的“桶状”宫颈[6-7]。因其有极好的分化,且病灶通常位于宫颈中上段、宫颈内腺体深部,常规细胞学筛查及单次活检漏诊率较高,多次活检或宫颈锥切对诊断非常重要[6]。PJS 女性患者倾向于在生殖器官中出现多处黏液性病变[4,8]。女性生殖道同期发生2 个及以上部位的黏液性病变,称之为生殖道同步黏液化生与肿瘤(synchronous mucinous metlasia and neoplasia of the female genital tract,SMMN-FGT),可能为宫颈、内膜、卵巢、输卵管的黏液化生,亦可能是黏液性肿瘤,包括MDA。所以,MDA 患者常有卵巢肿瘤的症状及体征,容易以盆腔包块就诊,但有时鉴别SMMN-FGT 与卵巢转移性病变十分困难[9]。本例患者以盆腔包块首次就诊,宫颈癌筛查未见异常,行子宫切除术后意外发现MDA,故在临床诊治中,对PJS 合并盆腔包块的患者,尤其包块疑为黏液性肿瘤,要警惕MDA 可能。此外,MDA 诊断尚需结合血清肿瘤标志物及盆腔磁共振成像(magnetic resonance imaging,MRI)情况,MRI 可表现为病变特异性“宇宙征”[10]。对可疑患者,及时行病理检查明确诊断,必要时多次深部活检或行宫颈锥切。SMMN-FGT 可能为幽门腺化生的结果,MUC6与HIK1083 是幽门腺的代表性标志物,有研究表明在SMMN-FGT 患者的所有黏液性病变中HIK1083和(或)MUC6 均为阳性[11]。Kato 等[12]记录了1 例PJS患者在宫颈、输卵管及卵巢出现多灶性黏液性病变,所有病变均表现为幽门腺分化,提示幽门腺化生与PJS 有关。本例患者宫颈及卵巢肿瘤均为胃型,免疫组织化学MUC6 阳性,支持SMMN-FGT 可能为幽门腺化生的结果,且与PJS 有关。目前,MDA 治疗方案类似于宫颈腺癌,早期的标准治疗方式为手术治疗。MDA 侵袭性强,具有腹腔内播散倾向,且有存在SMMNFGT 的可能,术中应仔细全面探查盆腹腔,可考虑同时切除大网膜,且保留卵巢应视为禁忌[6-7],对放化疗敏感性差,易耐药,预后差[13]。PJS 相关的及存在STK11 突变的MDA 预后要差于散发性MDA[14]。本例患者手术范围相对局限,术后予卡培他滨联合奥沙利铂化疗6 个疗程,现术后随访15 个月,暂无复发征象,需后续进一步随访观察。
PJS 多由STK11 胚系突变引起,STK11 是一种蛋白丝/苏氨酸激酶,曾称肝激酶B1(LKB1),属抑癌基因,约80%~94%的PJS 患者可检测到胚系STK11突变[1]。STK11 突变与多种肿瘤的发生有关,对卵巢肿瘤及MDA 的发展起重要作用[4]。本例患者存在STK11 突变:c.580G>C,p.Aps194Asn,该变异既往曾有报道,考虑为高频变异位点[15]。PJS 患者行STK11基因检测对早期诊断和治疗具有重要意义,可为受影响的家系提供预测诊断、进一步管理和遗传咨询。对于存在STK11 基因突变患者需进行更为细致的妇科检查,制定出更加合理的治疗方案。患有STK11致病/疑似致病突变个体的子女遗传变异的风险为50%,目前通过产前检测或植入前基因诊断可在妊娠早期甚至妊娠前做出诊断[16]。本例患者未进行产前基因检测,女儿自出生后6 个月出现口唇、手指及脚趾部黑斑,暂未行基因检测进一步明确诊断。
综上,PJS 是一种比较少见的临床综合征,其相关的妇科肿瘤更为罕见。随着对这些疾病更加深入地研究,相信会对其有更为深刻的理解,从而更好地指导临床的预防、筛查和治疗。

