鸭肠炎病毒UL41基因缺失株的构建及其体外增殖能力分析
杨伏春,刘 芮,李晓涵,高 立,刘长军,祁小乐,崔红玉,王笑梅,高玉龙,李 凯
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室 禽免疫抑制病创新团队,哈尔滨 150069)
鸭肠炎病毒(duck enteritis virus,DEV)感染引起鸭、鹅和其他雁形目禽类发生一种称为鸭瘟的急性、热性、败血性、烈性传染病,又被称为鸭瘟病毒。鸭瘟的特征是血管损伤,消化道出血、炎症和坏死,淋巴器官受损以及实质器官的退行性变化。鸭瘟发病率和死亡率都很高,是养鸭业的一大危害。DEV具有广泛的组织嗜性,自然条件下很多途径均可以引发感染,包括消化道、眼、鼻、皮肤外伤及泄殖腔等。鸭瘟在世界各地均有分布,迁徙的水禽在其传播中起重要的作用。我国于1957年在广东首先发现该病,随后在湖北、上海、浙江、广西、江苏、湖南和福建等地陆续发现本病流行。DEV感染后容易潜伏在三叉神经、淋巴组织和外周血液淋巴细胞中,潜伏的病毒活化后易于造成鸭病毒性肠炎在家禽和迁徙的水禽中暴发。
DEV系疱疹病毒科的甲型疱疹病毒亚科成员之一,基因组为双链DNA。DEV具有典型的甲型疱疹病毒基因特征,病毒基因由相互共价结合的长独特区(UL)和短独特区(US)及两侧的重复序列组成;位于基因组US 区末端的重复序列称为末端重复序列(TRS),位于基因组内部的重复序列称为内部重复序列(IRS)。DEV基因组为UL-IRS-US-TRS结构方式,与水痘带状疱疹病毒和传染性喉气管炎病毒基因组构成方式相同,约编码78个病毒蛋白。与其他疱疹病毒相比,DEV基因组研究起步较晚,但近些年研究发展较为迅速,已经有很多病毒基因被预测、克隆表达并进行了基本特性分析,目前,正逐步进行基因功能研究,为探索DEV的致病机制提供了科学依据。
疱疹病毒41基因编码宿主关闭蛋白(vhs),因其可以通过抑制mRNA的活性来关闭宿主细胞大分子的合成而得名。Ⅰ型单纯疱疹病毒(HSV-1)是迄今为止被研究最广泛的疱疹病毒之一。HSV-1的vhs蛋白属于晚期蛋白,又是一种核酸内切酶,具有RNase活性。已有报道表明,HSV-1 UL41可以特异性降解许多宿主蛋白的mRNAs,这些mRNA的3′端UTR包含有AU富集元件,已发现的其mRNA可被UL41降解的宿主基因包括IFIT3、Viperin和cGAS等。目前,对DEV41基因编码的vhs功能还知之甚少,特别是其在病毒免疫逃逸及潜伏感染中发挥的作用尚不清楚,需要做更深入的研究。本研究采用DEV多片段黏粒拯救系统和Red/ET重组技术构建了DEV41基因缺失病毒,为研究DEV vhs的功能奠定了基础。
1 材料与方法
1.1 质粒和菌株
克隆有DEV强毒SD19株基因组片段的5个重组黏粒D1、D2、D3、D4、D5由中国农业科学院哈尔滨兽医研究所禽免疫抑制病实验室构建并保存。pRed/ET质粒购自Gene Bridges公司。大肠杆菌EPI300株购自Epicentre公司,DH10B大肠杆菌菌株由本实验室保存。
1.2 主要试剂
Counter-Selection BAC Modification Kit购自Gene Bridges公司,常规DNA聚合酶购自TaKaRa公司,质粒中提试剂盒购自QIAGEN公司,磷酸钙转染试剂盒购自Invitrogen公司,细胞培养基及胎牛血清购自Gibco公司,DEV UL41蛋白兔多克隆抗体由本团队制备,羊抗兔IgG-TRITC、氯霉素、四环素、卡那霉素、链霉素购自Sigma公司。无特定病原体(SPF)鸭胚购自国家禽类实验动物资源库。鸭胚成纤维细胞(DEF)用10~11日龄SPF鸭胚制备。
1.3 引物的设计与合成
根据DEV CV株基因组序列(GenBank No. JQ673560)及rpsL-neo基因序列(GENE BRIDGES),利用Oligo 7.0软件设计重组黏粒D1改造引物UL41 hmL和UL41 hmR。根据DEV CV株序列设计41基因上下游旁侧序列扩增引物:UL41P1F、UL41P1R、UL41P2F和UL41P2R,以及2基因鉴定引物UL2L和UL2R。引物序列如表1所示,引物均由吉林省库美生物公司合成。

表1 UL41基因缺失黏粒构建及鉴定引物
1.4 UL41基因缺失黏粒的构建
以克隆有41基因的重组黏粒D1为骨架,利用Red/ET重组技术,缺失41基因编码序列,构建41基因缺失黏粒D1 dUL41,构建图谱如图1所示。将克隆有DEV41基因的重组黏粒D1转化入DH10B,经氯霉素抗性LB平板筛选后挑取阳性菌株DH10B-D1;将pRed/ET质粒转化入DH10B-D1,经四环素抗性LB平板筛选后挑取阳性菌株DH10B-D1-Red/ET。以UL41 hmL、UL41 hmR为引物,rpsL-neo基因片段(GENE BRIDGES)为模板,PCR扩增获得带有41基因旁侧序列的基因片段UL41-rpsL-neo;将UL41-rpsL-neo片段转化进入菌株DH10B-D1-Red/ET,经卡那霉素抗性LB平板筛选阳性重组菌D1-UL41-rpsL-neo。以UL41P1F、UL41P1R为引物,DEV SD19株基因组DNA为模板,PCR扩增获得41基因上游300 bp旁侧序列UL41F;以UL41P2F、UL41P2R为引物,SD19株基因组DNA为模板,扩增获得41基因下游300 bp旁侧序列UL41R;以UL41P1F、UL41P2R为引物,PCR产物UL41F、UL41R为模板,经融合PCR扩增获得41基因缺失替换片段UL41-KO。将PCR片段UL41-KO转化入重组菌D1-UL41-rpsL-neo,经链霉素抗性LB平板筛选获得41基因被UL41-KO片段替换的重组黏粒D1dUL41。

图1 UL41基因缺失黏粒D1dUL41构建示意图Fig.1 The schematic diagrams of the UL41 deletion fosmid D1dUL41
1.5 DEV UL41基因缺失病毒的拯救及鉴定
利用质粒提取试剂盒提取含有DEV基因组片段的D1、D2、D3、D4、D5亲本黏粒以及41基因缺失重组黏粒D1dUL41。通过磷酸钙法将5个亲本黏粒共转染DEF,4~5 d后,观察转染的细胞是否出现DEV特异性蚀斑病变,电镜检测出现细胞病变的细胞中是否含有疱疹病毒样病毒粒子;用重组黏粒D1dUL41替换亲本黏粒D1转染DEF,拯救41基因缺失病毒。利用试剂盒提取重组病毒基因组DNA,同时设亲本病毒基因组DNA对照,利用引物UL2L、UL2R和UL41P1F、UL41P2R对提取的病毒基因组进行PCR鉴定,并测序检测基因缺失位置及旁侧序列是否正确。
1.6 DEV UL41基因缺失病毒蛋白表达检测
将拯救的41缺失病毒rDEV-SD19/dUL41与亲本病毒rDEV-SD19分别接种DEF,培养4~5 d 后经显微镜观察,比较病毒在感染细胞中产生的蚀斑病变。分别以UL41蛋白多克隆抗体和US3蛋白多克隆抗体作为一抗,以羊抗兔IgG-TRITC(1∶200) 作为二抗,采用间接免疫荧光方法(IFA)鉴定UL41和US3蛋白表达情况,同时设置未接毒DEF作为阴性对照。
1.7 DEV UL41基因缺失病毒生长曲线的测定
将41缺失病毒rDEV-SD19/dUL41与亲本病毒rDEV-SD19以感染复数(MOI)为0.01接种次代DEF,感染后每隔24 h收集上清和细胞,持续至感染后96 h。将各个时间点所收集的病毒液接种96 孔板中的DEF,测定各时间点病毒液的半数感染量(TCID),绘制生长曲线,分析41基因缺失病毒和亲本病毒在DEF中的生长特性。
2 结 果
2.1 UL41基因缺失黏粒的构建及鉴定
以41上游旁侧序列引物UL41P1F、41下游旁侧序列UL41P2R为引物,分别对亲本黏粒D1和构建的41基因缺失黏粒进行PCR检测。结果显示,亲本黏粒扩增获得2 094 bp的基因片段,测序发现其包含41编码区上游旁侧序列(300 bp)、41基因编码序列(1 494 bp)以及41基因下游旁侧序列(300 bp);41基因缺失黏粒扩增获得600 bp的基因片段,测序发现其仅包含41编码区上游旁侧序列(300 bp)和下游旁侧序列(300 bp),41基因编码区序列被成功缺失(图2)。以上结果表明,41基因缺失黏粒D1 dUL41构建成功。
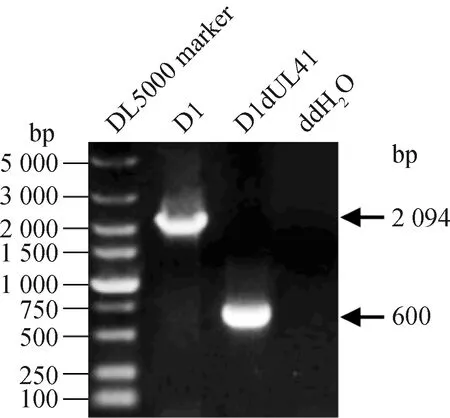
图2 基因缺失黏粒D1dUL41的PCR鉴定结果Fig.2 Identification of gene deletion fosmid D1dUL41 by PCR
2.2 DEV UL41基因缺失病毒的拯救及鉴定
通过将克隆有DEV基因组片段的亲本黏粒D1、D2、D3、D4、D5(图1)共转染DEF,拯救DEV亲本病毒rDEV-SD19;用41基因缺失黏粒替换亲本黏粒D1转染DEF,拯救41基因缺失病毒rDEV-SD19/dUL41。将拯救的亲本病毒与41基因缺失病毒接种DEF后,观察细胞病变情况。结果显示,上述病毒在DEF上均产生典型的DEV蚀斑病变(图3A)。电镜检测发现,41基因缺失病毒和亲本病毒感染的DEF中存在典型疱疹病毒样病毒粒子,大多以核衣壳形式存在于细胞核中(图3B)。提取41基因缺失病毒rDEV-SD19/dUL41以及亲本病毒基因组DNA,利用2基因鉴定引物UL2L、UL2R进行PCR鉴定,结果显示,rDEV-SD19/dUL41和rDEV-SD19均可扩增获得1 002 bp大小的基因片段(图4),片段大小与DEV强毒株2基因相符,表明上述病毒拯救成功;进一步用41旁侧序列引物UL41P1F、UL41P2R对上述毒株进行PCR鉴定,亲本病毒rDEV-SD19扩增获得2 094 bp的片段,41缺失病毒扩增获得600 bp的片段(图4),与重组黏粒D1dUL41的PCR鉴定结果一致,片段大小和测序结果与预期相符。以上结果表明,41基因缺失病毒rDEV-SD19/dUL41拯救成功。

图3 UL41基因缺失病毒(rDEV-SD19/dUL41)和亲本病毒(rDEV-SD19)感染DEF产生的细胞病变(A)和病毒粒子(B)Fig.3 The CPE (A) and electron microscopy (B) detection of the UL41 gene deletion virus rDEV-SD19/dUL41 and the parental virus rDEV-SD19 in DEFs
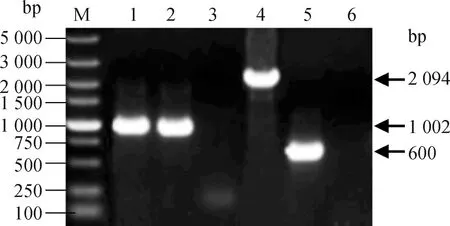
M. DL5000 DNA分子质量标准;1~3. UL2引物(UL2L、UL2R)PCR鉴定;4~6. UL41旁侧引物(UL41P1F、UL41P2R)PCR鉴定;1、4. rDEV-SD19;2、5. rDEV-SD19/dUL41;3、6. ddH2OM. DL5000 DNA marker; 1-3. PCR detection with UL2 primers UL2L and UL2R; 4-6. PCR detection with UL41 flanking primers UL41P1F and UL41P2R; 1, 4. rDEV-SD19; 2, 5. rDEV-SD19/dUL41; 3, 6. ddH2O图4 UL41基因缺失病毒的PCR鉴定Fig.4 Identification of the UL41 gene deletion virus by PCR
2.3 UL41基因缺失病毒蛋白表达鉴定
将UL41基因缺失病毒rDEV-SD19/dUL41与亲本病毒rDEV-SD19分别接种DEF后3 d,利用IFA检测UL41蛋白表达情况。结果显示,用UL41蛋白抗体进行检测,亲本病毒rDEV-SD19感染的细胞可见红色荧光信号,41基因缺失病毒rDEV-SD19/dUL41以及没有接毒的对照细胞未见荧光;用US3蛋白抗体作为对照进行检测,亲本病毒rDEV-SD19和41基因缺失病毒rDEV-SD19/dUL41接毒的细胞均可见荧光(图5)。以上结果进一步表明rDEV-SD19/dUL41构建成功。

图5 间接免疫荧光试验检测UL41基因缺失病毒(rDEV-SD19/dUL41)和亲本病毒(rDEV-SD19)感染DEF中UL41蛋白表达情况Fig.5 IFA detection of UL41 expression in DEFs infected with UL41 gene deletion virus rDEV-SD19/dUL41 or the parental virus (rDEV-SD19)
2.4 UL41基因缺失病毒复制动力学分析
将41基因缺失病毒rDEV-SD19/dUL41与亲本病毒rDEV-SD19以MOI=0.01分别接种DEF,每24 h收集细胞和上清,测定病毒的复制曲线。结果如图6所示,感染后24、48、72、96 h,亲本病毒平均滴度分别为10、10、10、10TCID·mL;41缺失病毒在上述时间点的平均滴度分别为10、10、10、10TCID·mL;各时间点41缺失病毒rDEV-SD19/dUL41的平均滴度均显著低于亲本病毒(<0.05)。以上结果表明,41基因的缺失影响了DEV在DEF上的复制水平,41基因编码的vhs蛋白在DEV复制中发挥重要作用。

*.P<0.05, **.P<0.01图6 UL41基因缺失病毒复制动力学分析Fig.6 Analyses of the replication kinetics of the UL41 gene deletion virus rDEV-SD19/dUL41
3 讨 论
近年来,鸭瘟在我国呈散在性流行,是危害我国养鸭业的重要疫病之一。DEV致病机制及其编码蛋白的功能分析为鸭瘟诊断方法与新型疫苗的研究奠定了基础。疱疹病毒41基因编码的vhs蛋白能够关闭大多数宿主蛋白质合成。相比其他疱疹病毒,DEV41基因的功能及其在DEV复制和致病性中的作用仍然不是很清楚。本研究利用DEV多片段黏粒拯救系统和Red/ET重组技术,构建获得了DEV41基因缺失病毒,并对其体外生物学特性进行了研究。
传统的构建重组疱疹病毒的方法主要是同源重组法和细菌人工染色体(BAC)法。同源重组法依赖于细胞重组和修复机制,其可通过将选择标记导入病毒基因组中实现富集和纯化突变病毒。然而,这一过程费时费力,对获得的重组突变病毒在体外细胞上进行连续传代纯化往往会造成重组病毒发生突变,而且重组病毒携带的选择标记基因可潜在影响突变病毒的生物学特征。BAC法是将完整的疱疹病毒基因组插入到BAC中并在细菌中对其进行改造;病毒基因组重组BAC系统的构建仍旧依赖于同源重组方法,构建过程同样复杂费时,而且重组病毒会携带BAC自身载体序列。本实验室前期研究中建立了基于Fosmid黏粒的DEV拯救系统。相对于BAC系统,Fosmid黏粒具有稳定性好、无偏向性、构建周期短等诸多优点。由于DEV基因组分为不同节段克隆入黏粒中,便于对不同的基因组片段分别进行操作,尤其适于疱疹病毒基因组中双拷贝基因缺失病毒的构建。在DEV黏粒拯救系统基础上,本研究采用Red/ET重组技术对DEV重组黏粒进行了改造,构建了41基因缺失黏粒,而后将41基因缺失黏粒D1dUL41与其他4个克隆有DEV基因组片段的亲本黏粒共转染DEF,拯救获得41基因缺失病毒rDEV-SD19/dUL41。由于在转染过程中将亲本黏粒D1替换为41缺失黏粒D1dUL41,因此不会引入41未缺失的亲本黏粒D1,拯救获得的病毒为纯净的41基因缺失毒株,不含有亲本病毒,因此不需要进行蚀斑纯化,获得的41基因缺失病毒序列缺失准确且病毒纯净,病毒拯救过程相对同源重组法和BAC法更加简便、快捷。
41基因在多种α疱疹病毒中被称为病毒宿主关闭基因。将伪狂犬病毒41缺失后获得的41缺失病毒在体外细胞上表现出更小的蚀斑和更低的滴度,并且在小鼠模型中显示出减弱的致死率。本研究构建了DEV41缺失病毒,研究发现41缺失DEV的体外复制能力明显低于亲本病毒,提示41基因编码的vhs蛋白在DEV复制中起着重要作用。有研究表明,HSV-1可通过UL41蛋白的RNase活性诱导预先存在的宿主mRNA的快速降解,而且HSV-1 UL41蛋白能够特异性降解多种天然免疫相关宿主蛋白mRNAs, 从而介导HSV-1逃逸宿主抗病毒天然免疫反应。本实验室对DEV编码的逃逸宿主天然免疫的病毒蛋白进行了筛选,发现UL41可以抑制Ⅰ型干扰素的表达,这可能是其缺失后影响DEV复制特性的机制之一,然而UL41影响DEV复制的具体分子机制还需进一步研究。本研究41基因缺失病毒的构建为研究UL41在DEV复制和致病中的功能奠定了基础。
4 结 论
成功构建DEV41基因缺失毒株rDEV-SD19/dUL41,41基因缺失毒株在DEF中的复制能力明显低于亲本病毒,提示UL41蛋白在DEV复制中发挥重要作用。41基因缺失DEV的构建为进一步研究41基因在DEV感染和致病中的作用机制奠定了基础。

