RNA传感器IFIH1对HPV阳性的宫颈癌细胞增殖、迁移和侵袭的影响
喻 琳,罗 莹,吴 迪,洪世垣
400016 重庆,重庆医科大学生命科学研究院
宫颈癌在全世界女性肿瘤发病率和死亡率中都位居第四[1]。GLOBOCAN数据显示,2018年全球新增宫颈癌确诊病例570 000例,并有311 000名女性死于宫颈癌[1]。持续感染高危型人乳头瘤病毒(human papillomavirus,HPV)是导致宫颈癌发生的最大危险因素[2-3],但HPV导致宫颈癌发生的机制尚不完全清楚。目前预防性疫苗可通过阻断高危型HPV的初始感染来预防HPV相关癌症的发展,但疫苗本身没有治疗效果。因此探索宫颈癌的发病机制对其诊断、治疗和开发新的治疗药物具有重要意义。
越来越多的研究表明,HPV可通过不同机制逃逸免疫监视,从而导致宫颈癌发生[4-5]。先天免疫反应是抵御病毒感染的第一道防线,其激活依赖于识别病原体相关分子模式(pathogen-related molecular patterns,PAMPs)的细胞模式识别受体(pattern recognition receptors,PRRs)[6]。病毒核酸传感器干扰素诱导的解旋酶C结构域蛋白1(interferon-induced helicase C domain protein 1,IFIH1)是一个重要的细胞模式识别受体,在许多病毒的感染和复制、以及自身免疫性疾病和癌症的发生发展中都发挥着重要作用[7-9]。IFIH1是RNA传感器,它可以识别并结合病毒RNA,从而抑制RNA病毒的感染和复制。最近研究表明,RNA传感器也可以抑制DNA病毒复制,如豆苗病毒、单纯疱疹病毒、乙型肝炎病毒等[10-13]。此外,研究表明,IFIH1在癌症治疗中起着至关重要的作用,如乳腺癌、前列腺癌、结直肠癌等[14-16]。目前,IFIH1在DNA病毒HPV感染导致的宫颈癌中的作用尚不清楚。因此,本研究拟在人宫颈癌细胞HeLa中探讨IFIH1对HeLa细胞增殖、迁移和侵袭的影响及其作用机制,并在正常上皮细胞HaCaT中探讨HPV对IFIH1表达的影响。
1 材料与方法
1.1 材料与试剂
HPV阴性宫颈癌细胞C33A、HPV阳性宫颈癌细胞HeLa和正常上皮细胞HaCaT均购于武汉Procell公司;DMEM高糖和MEM培养基购于美国Gibco公司;胎牛血清(FBS)购于以色列Bioind公司;TRIzol试剂购于美国Invitrigen公司;PEI转染试剂购于美国Ployscience公司;G418试剂购于美国Sigma公司;无内毒素小提中量质粒提取试剂盒购于北京天根公司;高敏型ECL化学发光检测试剂盒、反转录及实时荧光定量PCR相关试剂均购于南京Vazyme公司;蛋白质提取试剂高效RIPA裂解液、SDS-PAGE凝胶制备试剂盒和DAPI均购于北京Solarbio公司;BCA蛋白浓度测定试剂盒、Western blot检测相关试剂盒及免疫染色封闭液购于上海碧云天公司;Transwell小室和基质胶购于美国Corning公司;HPR标记的山羊抗鼠IgG,HRP标记的山羊抗兔IgG和兔抗人IFIH1抗体均购于美国CST公司;鼠抗人GAPDH抗体和兔抗人STAT3抗体购于美国Proteintech公司;兔抗人p-STAT3抗体购于美国Abclone公司;兔抗人FLAG抗体购于美国Sigma公司;荧光二抗购于美国Invitrigen公司;T4连接酶、美国BamHⅠ酶和EcoRⅠ酶均购于美国Biolabs公司。shRNA相关序列及实时荧光定量PCR相关引物购于上海生物工程股份有限公司;带FLAG标签的IFIH1过表达质粒以及阴性对照质粒购于上海吉凯基因化学技术有限公司。HPV18基因组,psi-LVRU6GP、pMD2.G、pSPAX2、PSV2-neo质粒由本实验室保存。
1.2 细胞培养
C33A细胞、HeLa细胞和HEK293T细胞用含100 mL/L FBS的高糖DMEM培养基培养,HaCaT细胞用含100 mL/L FBS的MEM培养基培养,并静置于含37 ℃和50 mL/L CO2的培养箱中。使用含0.25%的EDTA胰蛋白酶对细胞消化传代。细胞处于对数生长期时进行实验。
1.3 构建IFIH1敲低的质粒
使用慢病毒载体psi-LVRU6GP连接shRNA靶向序列,构建能敲低IFIH1的质粒(shIFIH1)。对照质粒(shNC)为载体连接一段无意序列。将合成的shRNA靶向序列正义和反义寡核苷酸链退火,序列见表1。按照试剂说明书操作,将psi-LVRU6GP载体使用BamHⅠ和EcoRⅠ进行双酶切。利用T4连接酶连接退火后的寡核苷酸链和酶切后的载体。将连接产物转化入大肠杆菌stable3,并按照质粒提取试剂盒说明书提取质粒。

表1 shRNA靶向序列
1.4 细胞转染
IFIH1转染C33A细胞:取对数生长期的C33A细胞(1×106/皿)于6 cm培养皿中,20 h后细胞融合度达到70%~80%时,以PEI∶质粒=3∶1的比例将带Flag标签的IFIH1过表达质粒与对应的阴性对照质粒分别转染C33A细胞。实验分为2组:①阴性对照组(NC);②IFIH1过表达组(O/E IFIH1)。转染6~8 h后,将培养基更换为含100 mL/L FBS的高糖DMEM培养基,在培养箱中培养48 h后收集细胞进行后续实验。HPV18基因组转染HaCaT细胞:取对数生长期的HaCaT细胞(3×106/皿)于6 cm培养皿中,20 h后细胞融合度达到60%~70%时,以PEI∶HPV18∶psv2-neo质粒=6∶1∶1的比例将HPV18基因组转染进HaCaT细胞,转染6~8 h后换液,48 h后用G418溶液(800 μg/mL)筛选转染成功的细胞。每2天换1次液并加药筛选细胞,待添加G418溶液培养皿中无细胞死亡,且细胞处于对数生长期时用于后续实验。
1.5 慢病毒包装与感染
取对数生长期的HEK293T细胞(1×106/皿)于6 cm培养皿中,20 h后细胞融合度达到60%~70%时,按照试剂说明书操作,利用PEI转染试剂将1 μg pMD2.G质粒,3 μg pSPAX2质粒,4 μg shIFIH1#1质粒、shIFIH1#2质粒或对照质粒共转染HEK293T细胞。转染6~8 h后换液,48 h后收集上清,并用0.22 μm滤器过滤,所得的上清即为病毒原液,于-80 ℃保存。取对数生长期的HeLa细胞(1×106/皿)于6 cm培养皿中,20 h后细胞融合度达到60%~70%时,以培养基∶病毒原液=1∶1的比例感染HeLa细胞,培养48 h后换液,并用puro溶液(1 μg/mL)筛选感染成功的细胞。待添加puro溶液培养皿中无细胞死亡,且细胞处于对数生长期时用于后续实验。实验分为2组:①阴性对照组(shNC);②实验组(shIFIH1#1,#2)。
1.6 实时定量PCR(qRT-PCR)
利用TRIzol试剂法提取细胞中的总RNA,取1 μg RNA,利用反转录试剂盒得到相应的cDNA。利用qRT-PCR检测HPV18 E6/E7、IFIH1、GAPDH的mRNA表达水平,引物序列见表2。qRT-PCR的反应条件:95℃ 1 min(预变性),95 ℃ 10 s(变性),60 ℃退火,延伸,共40个循环。

表2 引物序列
1.7 Western blot
收集细胞沉淀,使用高效RIPA裂解液提取细胞总蛋白,并利用BCA法测定蛋白总浓度。取20 μg蛋白上样,在80 V 30 min,120 V 60 min的条件下经8% SDS-PAGE分离后,350 mA恒流将分离后的蛋白湿转至PVDF膜上。使用5%的脱脂奶粉室温摇床封闭1 h,分别加入兔抗人IFIH1抗体(1∶1 000)、兔抗人p-STAT3抗体(1∶1 000)、兔抗人STAT3抗体(1∶1 000)、兔抗人FLAG抗体(1∶1 000)、鼠抗人GAPDH抗体(1∶100 000),4 ℃摇床孵育12~16 h;TBST洗膜5 min×5次后,加入HRP标记的山羊抗鼠IgG(1∶10 000)和HRP标记的山羊抗兔IgG(1∶10 000),室温摇床1 h;TBST洗膜5 min×5次,利用高敏型ECL化学发光检测试剂盒发光显色。
1.8 实时无标记动态细胞分析技术(RTCA)
将细胞接种于RTCA的增殖板中(HeLa细胞每孔接种4 000个细胞,C33A细胞每孔接种20 000个细胞),设置3个复孔。将增殖板置于37 ℃,50 mL/L的CO2培养箱中,利用RTCA Software Lite实时检测细胞的增殖情况。
1.9 CCK8法
将细胞接种于96孔板中(HeLa细胞每孔细胞数目为2 000个,C33A细胞每孔接种10 000个细胞),并设置5个复孔。分别在0、24、48、72、96 h时每孔加10 μL CCK8试剂,混匀后将培养板放在培养箱内孵育,1 h后在酶标仪450 nm处测定光密度值,并绘制生长曲线。
1.10 划痕愈合实验
将Hela细胞和C33A细胞按5×105/孔接种于6孔板中培养,待细胞长满6孔板时,用10 μL无菌枪头在每孔细胞中间垂直划线,用PBS洗2次,随后加入3 mL无血清的DMEM培养基,并在显微镜下观察划痕和拍照,记作0 h。将拍照后的6孔板继续放在培养箱中培养,分别在24 h和48 h取出,并在相同位置拍照。利用Image J 软件计算划痕面积。细胞迁移率按以下公式计算:
细胞迁移率=[0 h划痕面积-24 h(48 h)划痕面积]/0 h划痕面积×100%
1.11 Transwell迁移和侵袭实验
迁移实验是将细胞用无血清的DMEM培养基重悬,混匀后取100 μL细胞悬液(HeLa细胞4×104/孔,C33A细胞1×106/孔)到小室中,下室中添加含20% FBS的培养基,在培养箱中培养24 h或48 h,取出;用棉签擦去未穿孔的细胞,4%的多聚甲醛室温固定30 min,PBS洗3次,结晶紫染色20 min,流水冲洗染料,晾干,显微镜观察并拍照。侵袭实验需提前取100 μL基质胶于上室中,37 ℃培养箱中孵育2 h,其余实验步骤与迁移实验一致。
1.12 免疫荧光
将细胞重悬至1×105/mL,取500 μL细胞接种于24孔板爬片内,常规培养24 h后,弃去培养基,PBS洗1次,取300 μL 4%多聚甲醛固定细胞10 min;PBS洗3次,取300 μL 0.1% Triton X-100通透细胞15 min;PBS洗3次,取300 μL免疫染色封闭液室温摇床封闭细胞1 h;分别加入200 μL兔抗人STAT3抗体(1∶200)和兔抗人p-STAT3抗体(1∶100)4 ℃摇床12~16 h;PBS洗3次,加入200 μL荧光二抗(1∶500),室温避光摇床1 h;PBS洗3次,取200 μL DAPI(1∶10)染核30 min;将爬片取出封片至载玻片上,晾干后拍照。
1.13 统计学分析
实验数据采用GraphPad Prism 7.0 软件进行统计学分析,每组实验均重复3次。采用Student’st检验比较两组间数据。P<0.05为差异具有统计学意义。
2 结果
2.1 IFIH1在人宫颈癌组织和HPV阳性的宫颈癌细胞中高表达
为观察IFIH1在宫颈癌组织中的表达,利用基因表达谱交互分析数据库(GEPIA,http://gepia.cancer-pku.cn/)内收集的306例人宫颈癌组织和13例正常人宫颈组织的分析得知,IFIH1在肿瘤组织中的表达明显高于正常宫颈组织(P<0.05,图1A)。在HPV18阳性的宫颈癌细胞中验证IFIH1的表达,Western blot实验结果显示,相比于对照组C33A细胞,HPV18阳性的HeLa细胞中IFIH1的蛋白表达水平明显增加(P<0.01,图1B、C)。提示HPV阳性宫颈癌的发生可能与IFIH1的高表达有关。
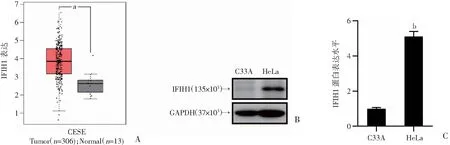
A:GEPIA数据库分析IFIH1在宫颈癌组织和正常宫颈组织中的表达;B:Western blot检测HeLa细胞中IFIH1的蛋白表达水平;C:HeLa细胞中IFIH1蛋白水平的半定量分析;a:P<0.05,与正常宫颈组织比较;b:P<0.01,与C33A比较
2.2 转染HPV18基因组促进正常上皮细胞HaCaT中IFIH1的表达
本研究选择在人角质形成细胞HaCaT中探究HPV是否通过IFIH1促进宫颈癌的发生。将HPV18基因组转染HaCaT细胞,并通过qRT-PCR检测转染效率。实验结果显示转染HPV18基因组的HaCaT细胞中HPV18 E6/E7 mRNA水平明显增高(P<0.01,图2A),表明HaCaT细胞中HPV18基因组成功转染。Western blot和qRT-PCR检测结果显示,与正常HaCaT细胞相比,转染HPV18基因组的HaCaT细胞,IFIH1的蛋白水平和mRNA水平明显增加(P<0.01,图2B~D)。结果提示,HPV上调IFIH1可能是其诱导宫颈癌发生的机制之一。
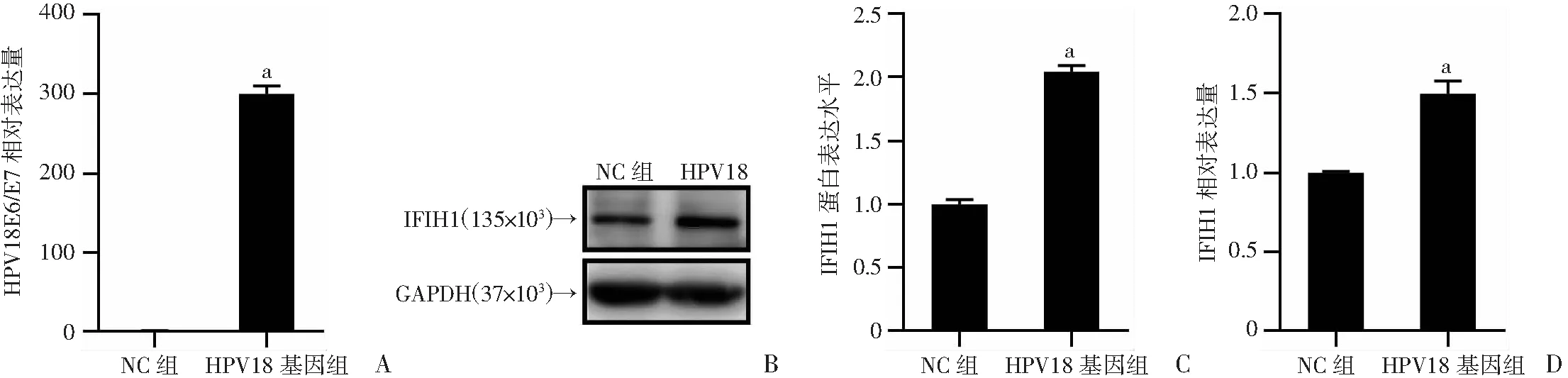
A:qRT-PCR检测HaCaT细胞中HPV18转染效率;B:Western blot检测HaCaT细胞中IFIH1蛋白表达水平;C:HaCaT细胞中IFIH1蛋白水平的半定量分析;D:qRT-PCR检测HaCaT细胞中IFIH1 mRNA水平 a:P<0.01,与NC组比较
2.3 IFIH1在人宫颈癌HeLa细胞中成功敲低
为研究IFIH1在宫颈癌细胞中的作用,利用shRNA构建敲低IFIH1的宫颈癌HeLa细胞株。Western blot和qRT-PCR实验结果显示,与对照组相比,HeLa-shIFIH1#1和HeLa-shIFIH1#2细胞中IFIH1的蛋白水平和mRNA水平均明显降低(P<0.01,图3)。以上实验结果表明IFIH1在HeLa细胞中成功敲低。
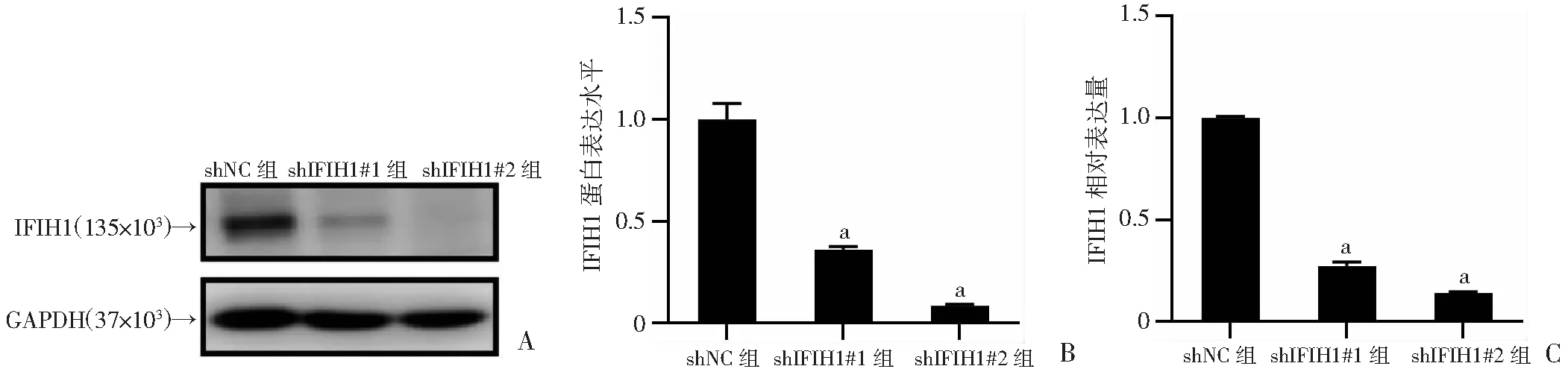
A:Western blot检测HeLa细胞中IFIH1的蛋白表达水平;B:HeLa细胞中IFIH1蛋白水平的半定量分析;C:qRT-PCR检测HeLa细胞中IFIH1的mRNA表达水平 a:P<0.01,与shNC组比较
2.4 敲低IFIH1抑制人宫颈癌细胞HeLa的增殖
为探究IFIH1对宫颈癌细胞增殖的影响,使用RTCA实验和CCK8法检测IFIH1敲低后对HeLa细胞增殖的影响。结果显示,相比于对照组,敲低IFIH1的HeLa细胞在48、72、96 h的增殖能力明显减弱(P<0.05,图4)。结果表明,敲低IFIH1后抑制宫颈癌细胞的增殖能力。
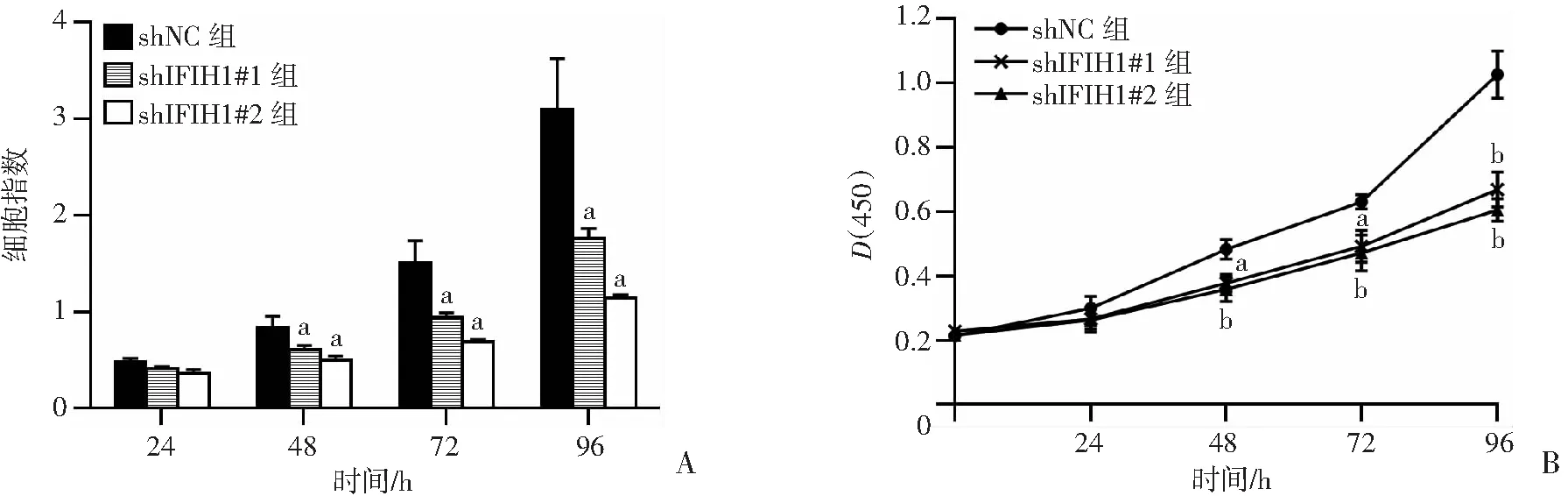
A RTCA检测HeLa细胞的增殖能力;B:CCK8法检测HeLa细胞的增殖能力 a: P<0.05, b: P<0.01,与shNC组比较
2.5 敲低IFIH1抑制人宫颈癌细胞HeLa的迁移和侵袭
为探究IFIH1对宫颈癌细胞迁移和侵袭的影响,利用划痕愈合实验、Transwell迁移和侵袭实验分别检测敲低IFIH1后对HeLa细胞横向迁移、纵向迁移和侵袭能力的影响。划痕愈合实验结果显示,与对照组相比,敲低IFIH1的HeLa细胞在24 h和48 h的划痕愈合率明显降低(P<0.01,图5A、B)。Transwell迁移实验结果显示,相比于对照组,敲低IFIH1的HeLa细胞穿透小室膜的细胞数目明显减少(P<0.01,图5C、D)。Transwell侵袭实验结果显示,敲低IFIH1后,穿膜的HeLa细胞明显少于对照组(P<0.01,图5E、F)。结果表明,敲低IFIH1后可抑制宫颈癌细胞迁移和侵袭能力。
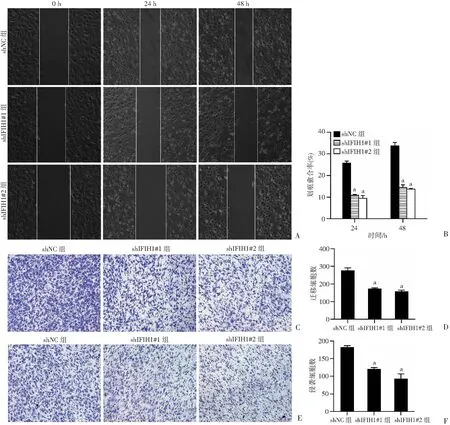
A:划痕愈合实验检测HeLa细胞横向迁移能力(×100);B:HeLa细胞划痕愈合率的半定量分析;C:Transwell迁移实验检测HeLa细胞的迁移能力(结晶紫染色×100);D:HeLa细胞迁移细胞数的半定量分析;E:Transwell侵袭实验检测HeLa细胞的侵袭能力(结晶紫染色×100);F:HeLa细胞侵袭细胞数的半定量分析 a:P<0.01,与shNC组比较
2.6 过表达IFIH1促进C33A细胞增殖
为探究IFIH1对C33A细胞增殖的影响,利用PEI将带FLAG标签的IFIH1过表达质粒与阴性对照质粒转染C33A细胞。Western blot实验结果表明,IFIH1在C33A细胞中过表达成功(图6A)。RTCA实验结果显示,与对照组相比,过表达IFIH1促进C33A细胞的增殖(P<0.01,图6B、C)。CCK8实验结果显示,相比于对照组,过表达IFIH1的C33A细胞在48、72、96 h的增殖能力增强(P<0.01,图6D)。结果表明过表达IFIH1可以促进C33A细胞的增殖。

A:Western blot检测IFIH1在C33A细胞中的过表达效果;B:RTCA检测C33A细胞的增殖能力:C:CCK8法检测C33A细胞的增殖能力 a: P<0.01,与NC比较
2.7 过表达IFIH1促进C33A细胞迁移和侵袭
划痕愈合实验结果显示,与对照组相比,过表达IFIH1的C33A细胞在48 h划痕愈合率明显增加(P<0.01,图7A、B);Transwell迁移实验结果显示,相比于对照组,过表达IFIH1组的C33A细胞穿透小室膜的细胞数目明显增加(P<0.01,图7C、D)。Transwell侵袭实验结果显示,过表达IFIH1后,穿膜的C33A细胞明显多于对照组(P<0.01,图7E、F)。结果表明,过表达IFIH1可促进C33A细胞的迁移和侵袭。

A:划痕愈合实验检测C33A细胞横向迁移能力(×100);B:C33A细胞划痕愈合率的半定量分析;C:Transwell迁移实验检测HeLa细胞的纵向迁移能力(结晶紫×100);D:HeLa细胞迁移细胞数的半定量分析;E:Transwell侵袭实验检测HeLa细胞的侵袭能力(结晶紫×100);F:HeLa细胞侵袭细胞数的半定量分析 a:P<0.01,与NC组比较
2.8 敲低IFIH1抑制人宫颈癌细胞HeLa中磷酸化STAT3蛋白的表达
为探究IFIH1在宫颈癌中发挥作用的机制,利用GEPIA数据库分析发现,宫颈癌中IFIH1与STAT3有一定的相关性(r=0.34,P<0.01),见图8A,提示IFIH1可能通过STAT3通路影响宫颈癌的发生发展。Western blot实验结果显示,敲低IFIH1后,HeLa细胞中STAT3蛋白水平无明显变化,而p-STAT3蛋白水平明显降低(P<0.01,图8B、C)。免疫荧光实验结果显示STAT3和p-STAT3主要位于细胞核。敲低IFIH1后,STAT3和p-STAT3的定位未发生改变,STAT3的表达也无明显变化,而p-STAT3的表达减少(P<0.01,图8D~G)。结果表明,敲低IFIH1可抑制STAT3的磷酸化。
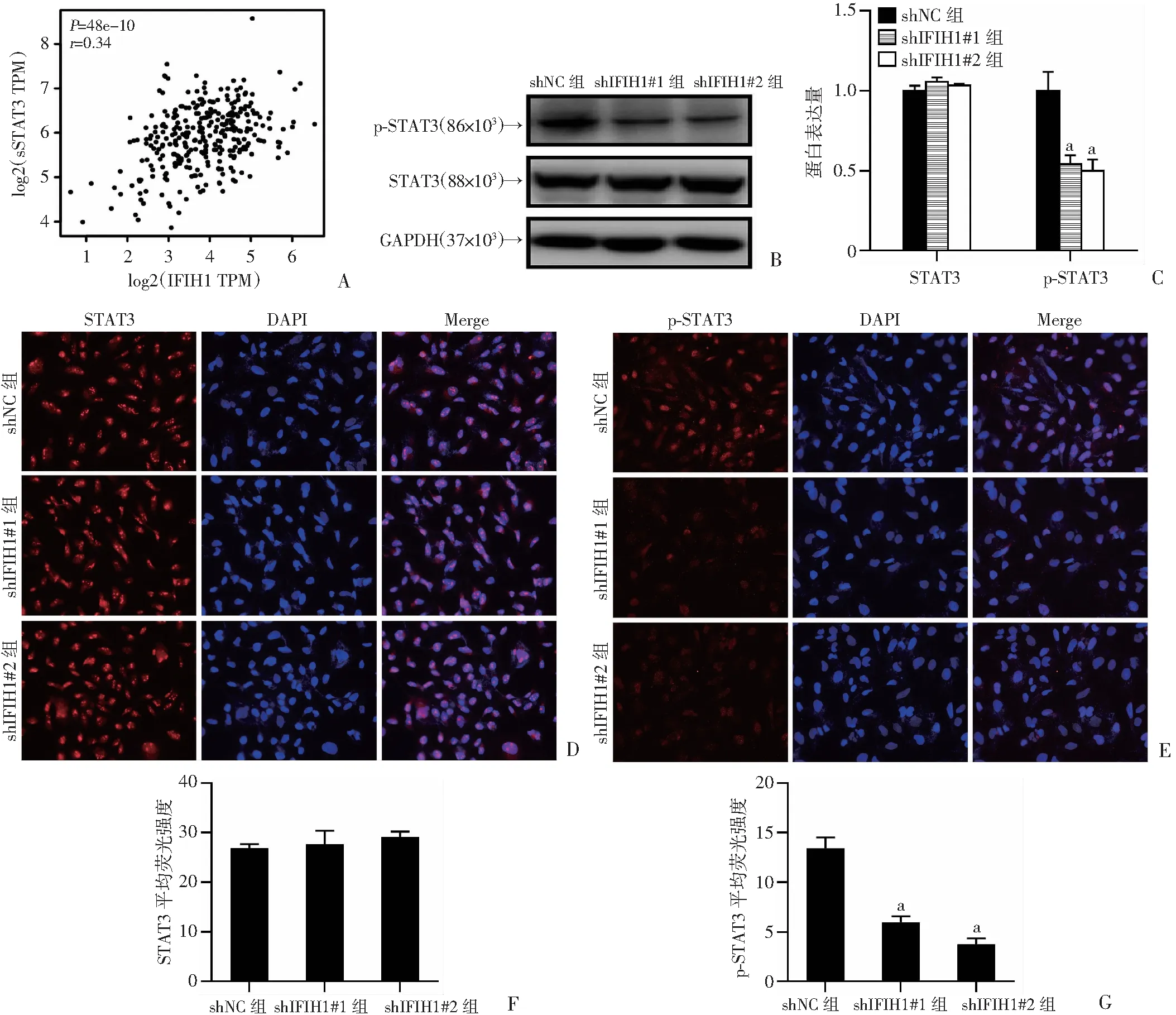
A:GEPIA数据库分析宫颈癌中IFIH1与STAT3的相关性;B:Western blot检测HeLa细胞中STAT3和p-STAT3蛋白的表达水平;C:HeLa细胞中STAT3和p-STAT3蛋白水平的半定量分析;D:免疫荧光实验检测Hela细胞中STAT3的表达和定位(×400);F:HeLa细胞中STAT3平均荧光强度的半定量分析;E:免疫荧光实验检测HeLa细胞中p-STAT3的表达和定位(×400);G:HeLa细胞中p-STAT3平均荧光强度的半定量分析 a:P<0.01,与shNC比较
3 讨论
宫颈癌的发生与HPV感染密切相关。从HPV感染到宫颈癌的发生是一个缓慢且复杂的过程。在这个过程中,肿瘤细胞和免疫系统之间存在着持续的斗争。由于持续不断的免疫压力,肿瘤形成了不同的逃避免疫监视的机制,从而逃避免疫系统的控制[17]。
一般来说,当外界有病毒入侵时常常在第一线发挥哨兵作用的是病毒核酸传感器。核酸传感器包括DNA传感器和RNA传感器,分别识别并结合病毒DNA和RNA,从而发挥抗病毒功能。由于HPV是DNA病毒,大多数研究主要集中在DNA传感器上。而本研究发现,在转染HPV18基因组的HaCaT细胞中,作为RNA传感器的IFIH1的mRNA水平和蛋白水平都升高。这表明IFIH1不仅可以识别病毒RNA,对DNA病毒也有一定的作用。此外,越来越多的证据表明,IFIH1的异位表达可导致癌细胞的生长停滞和凋亡[18-19]。在神经母细胞瘤中,IFIH1的高表达与良好的预后相关[20]。IFIH1可通过内源性IFIH1/MAVS途径和外源性Fas介导的凋亡诱导胰腺癌细胞凋亡[21]。IFIH1也可激活Caspase-3/7途径诱导肝癌细胞凋亡并抑制小鼠肝癌移植瘤生长[22]。IFIH1/MAVS和促凋亡蛋白NOXA的激活协同黑色素瘤细胞凋亡,并抑制小鼠黑色素瘤的肺转移[23]。目前,IFIH1与HPV诱导的宫颈癌的关系尚不清楚,因此对IFIH1在宫颈癌中发挥的作用的研究,可能为宫颈癌的治疗和开发新的药物提供帮助。
本研究首先利用GEPIA数据库分析发现,IFIH1在宫颈癌组织中表达上调。其次,通过Western blot实验发现IFIH1在HPV阳性的宫颈癌细胞中高表达,这提示IFIH1可能参与HPV阳性宫颈癌的发生。为探讨HPV感染诱导的宫颈癌是否与IFIH1的高表达有关,本研究将HPV18基因组转染HaCaT细胞,并利用Western blot和qRT-PCR实验检测IFIH1的表达。结果表明,转染HPV18基因组后,HaCaT细胞中IFIH1的表达上调。通过shRNA在宫颈癌HeLa细胞中敲低IFIH1,利用RTCA和CCK8法检测其对HeLa细胞增殖的影响。结果显示,敲低IFIH1的HeLa细胞增殖能力明显减弱。划痕愈合实验、Transwell迁移实验和侵袭实验表明,敲低IFIH1的HeLa细胞迁移能力和侵袭能力明显减弱。同样,在C33A细胞中过表达IFIH1,发现其能促进C33A细胞增殖、迁移和侵袭。以上结果显示,IFIH1可增强宫颈癌细胞的增殖、迁移和侵袭能力,这与IFIH1在其他癌症细胞中所报道的作用不一致,表明IFIH1在不同癌症细胞中发挥的作用可能不同。其具体的作用以及分子机制需要进一步阐释。
为了进一步探讨IFIH1在宫颈癌细胞中发挥的作用,本研究通过GEPIA数据库分析发现,宫颈癌中IFIH1与信号传导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)有一定的相关性。STAT3是STAT家族的重要成员,其可通过调节细胞增殖、迁移、侵袭、细胞凋亡和细胞周期的方式参与癌症的发生和发展[24-25]。有研究发现乳腺癌组织中磷酸化的STAT3(phosphorylated STAT3,p-STAT3)的表达显著升高,且与淋巴结转移呈正相关,这表明p-STAT3可能与乳腺癌细胞的增殖和侵袭有关[26]。p-STAT3在结直肠癌组织中高表达,与肿瘤浸润深度、血管浸润和淋巴结转移有关[27]。p-STAT3在非小细胞肺癌中的表达与分期、分化、淋巴结转移及预后有关[28]。同时,有研究表明STAT3的激活与宫颈癌发生和转移有关[29]。本研究发现,在宫颈癌细胞中敲低IFIH1可抑制STAT3的磷酸化,这提示IFIH1促进宫颈癌细胞增殖、迁移和侵袭可能与STAT3信号通路有关。然而,IFIH1调控STAT3磷酸化的机制以及HPV上调IFIH1的机制需做进一步的研究。
综上所述,本研究证明IFIH1在宫颈癌中高表达,HPV感染可导致宫颈癌细胞中IFIH1的表达上调。敲低IFIH1抑制宫颈癌细胞的增殖、迁移和侵袭,该抑制作用可能是通过阻碍STAT3的磷酸化实现。IFIH1有望成为开发新的宫颈癌治疗药物的候选靶点。
——一道江苏高考题的奥秘解读和拓展

