甘肃省部分中小规模猪场猪乙型脑炎流行现状调查
姚奕蕾,宋建国,康文彪,周 峰,豆 玲,高军军,潘永红
(甘肃省动物疫病预防控制中心,甘肃兰州 730046)
猪乙型脑炎也称猪日本脑炎(Japanese encephalitis,JE)是自然疫源性传染病,猪是主要的储存宿主和扩增宿主,日本脑炎病毒(Japanese encephalitis virus,JEV)对猪致死率不高,但会引起母猪繁殖障碍,导致怀孕母猪流产、死胎或产木乃伊胎,引起公猪睾丸急性炎症反应或不育[1]。在温带地区,猪乙型脑炎具有典型的季节性,通常始于4月份或5月份,并可持续到9月份或10月份[2]。1988年甘肃省秦安县发现猪乙型脑炎[3],2010年甘肃省10个市州猪群的JEV抗体阳性率达到73.3%[4],以后未见有关JEV感染的报道。相比较而言,由于乙型脑炎的危害小于猪瘟(CSF)、猪繁殖与呼吸综合征(PRRS)和伪狂犬病(PR)等疫病,因此,甘肃省以往对该病的调查研究仅限于感染抗体检测,缺乏病原学检测和混合感染调查。2014年,我们申报了甘肃省农业科技创新项目,将猪乙型脑炎纳入猪垂直传播疫病之一,从感染抗体、病毒核酸和混合感染三个方面对规模猪场猪乙型脑炎的感染现状开展了较为系统的调查,其目的是查明甘肃省中小型规模猪场猪乙型脑炎的流行现状,为该病的临床防控提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 样品 在兰州市和武威市选取10个均未对JE免疫的(榆中县4个、凉州区6个)中小型猪场采集531份血清和春季、秋季分别采集的481份和511份脑组织样品,其中种公猪29份、生产母猪30份、后备母猪269份、空怀母猪224份、哺乳仔猪90份、保育猪253份、育成猪67份、育肥猪561份,进行JEV抗体和病毒核酸检测。
1.1.2 试剂和仪器 猪乙型脑炎病毒ELISA抗体检测试剂盒,武汉科前生物股份有限公司产品;日本脑炎病毒RT-PCR检测试剂盒、猪繁殖与呼吸综合征病毒通用型RT-PCR检测试剂盒、猪伪狂犬病病毒PCR检测试剂盒、猪细小病毒PCR检测试剂盒、猪圆环病毒PCR检测试剂盒,北京世纪元亨动物防疫技术有限公司产品;全波长酶标仪,美国博腾公司产品;普通PCR仪,德国Eppendorf公司产品;凝胶成像系统,UVITEE公司产品;水平电泳槽,北京六一生物科技有限公司产品。
1.2 方法
1.2.1 JEV抗体检测 采用间接ELISA方法检测,将采集到的531份猪血清按说明书要求用稀释液稀释好后,加入到包被好灭活病毒的包被板上,37℃温育30 min,洗涤5次后加入酶标二抗37℃温育30 min,洗涤5次后加入底物液避光显色10 min,加入终止液。最后用酶标仪检测在630 nm处的吸光度值,读取结果。
1.2.2 JEV核酸检测 按《流行性乙型脑炎诊断技术》(GB/T 18638-2021)7.1至7.5中规定的普通RT-PCR的检验操作方法进行检测。将春季采集的481份和秋季采集的531份猪脑组织样品,取1.5 g左右放入无菌研磨棒中研碎后,加入pH7.4的PBS制成悬液,离心后取上清液进行病毒RNA的提取,按照试剂盒说明书使用柱式法提取病毒RNA,将提取好的模板加入反应体系中,按照50℃ 30 min;94℃ 5 min;94℃ 40 s,55℃ 30 s,72℃ 30 s 30次循环,进行RT-PCR扩增,扩增产物用15 g/L琼脂糖凝胶电泳检测,观察结果。
1.2.3 其他病毒核酸检测 PRRSV按《猪繁殖与呼吸综合征诊断方法》(GB/T 18090-2008)中9反转录-聚合酶链式反应中的规定进行;PRV按《伪狂犬病诊断方法》(GB/T 18641-2018)中7聚合酶链式反应的规定进行;PCV2按《猪圆环病毒聚合酶链反应试验方法》(GB/T 21674-2008)中的规定进行;PPV按《猪细小病毒病检疫技术规范》(SN/T 1919-2016)中7.5的规定进行病毒核酸检测。
2 结果
2.1 JEV抗体检测
10个猪场均检测到了抗体阳性猪只,场阳性率为100%;共检测血清样品531份,阳性418份,抗体个体阳性率为78.72%,10个场7个不同种类猪群全部检测出阳性样品,其中1个场的生产母猪个体阳性率为100%,2个场种公猪的个体阳性率为60.00%(表1)。
2.2 JEV核酸检测
春季检测来自10个场户的481份样品,从4个场的育肥猪和空怀母猪群体内检出阳性26份,场阳性率为40%,个体阳性率为5.41%;秋季检测10个场的511份样品,从5个场的后备母猪、空怀母猪、育成猪和育肥猪群体内检出检出阳性32份,场阳性率为50%,个体阳性率为6.26%(表2)。
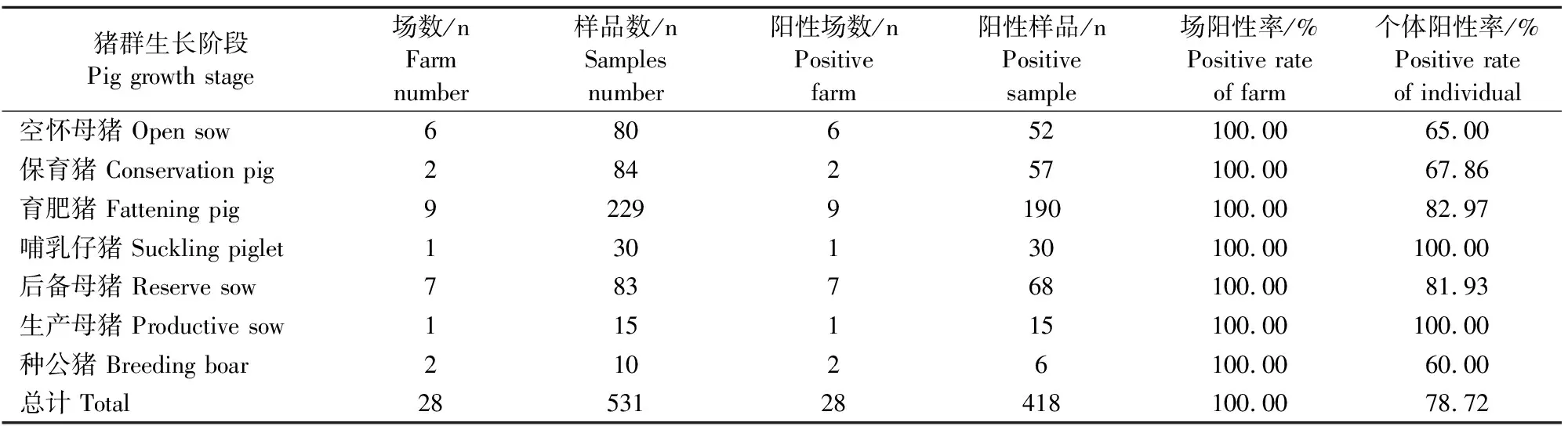
表1中小规模场JEV抗体检测结果
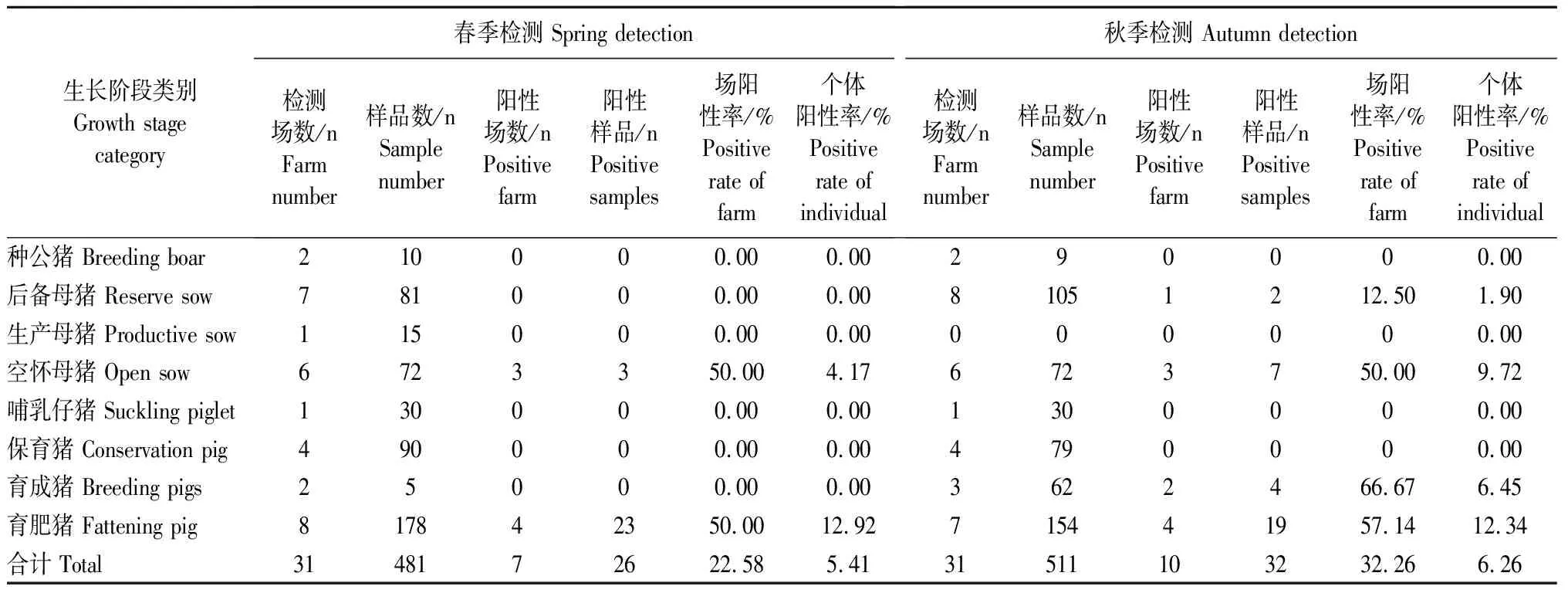
表2中小型猪场JEV核酸检测结果
2.3 混合感染情况
甘肃省中小规模场对猪乙型脑炎不开展免疫,各生长阶段猪群的感染抗体均呈阳性;后备母猪、空怀母猪和育肥猪3个群体均存在JEV感染;对JE抗体检测阳性的猪只进行PRV、PRRSV和PPV的病毒核酸RT-PCR和PCR检测发现发生混合感染率为30%。春季在3个场内检测到空怀母猪和育肥猪群体存在JEV与PRV、和PPV等3种病原的混合感染。其中2个场内空怀母猪和育肥猪同时发生混合感染;秋季在3个场内检测到空怀母猪、后备母猪和育肥猪群体发生JEV与PRRSV、PRV、和PPV等4种病原的混合感染。有2个场存在空怀母猪和育肥猪,后备母猪和育肥猪同时发生感染,混合感染有2~5种病原的二重、三重、四重和五重共10种方式(表3)。

表3中小型猪场其他病毒与JEV混合感染情况
3 讨论
本次抗体检测和病毒核酸检测发现,JEV场阳性率和个体阳性率都比较高。2000年甘肃省规模化猪场猪群猪乙型脑炎抗体的个体阳性率为15.56%[12],2010年为73.3%[4],本次调查结果为78.72%。JEV核酸检测发现其场阳性率和个体阳性率分别高达50%和6.26%。可见甘肃省规模化猪场的猪乙型脑炎感染有不断加重的趋势。究其原因:一是动物防疫机构和养猪场对猪乙型脑炎防控工作的重视程度不够,免疫接种不到位;二是猪的频繁调运,尤其是从南方地区调猪起到了推波助澜的作用;三是养殖场防蚊灭鼠、无菌操作等不扎实不规范。
乙型脑炎是重要的人畜共患病,猪是人乙型脑炎最重要的传染源,事实上甘肃省天水、陇南等地每年都有人乙型脑炎发生,因而严格有效防控猪乙型脑炎势在必行。建议养猪场和各级动物防疫机构重视猪乙型脑炎的防控,做好种猪乙型脑炎的程序化免疫工作和检疫检测、调运监管工作。及时开展动物疫病风险分析,提高生物安全水平,降低传染病发生和传播的风险。养猪场还应做好防虫灭鼠工作,减少传播媒介和易感动物。规范防疫和生产操作,特别是剪牙、断尾、注射等无菌操作。
此外本次检测发现中小规模场猪群存在多种病毒的混合感染,如猪圆环病毒2型和猪乙型脑炎毒的混合感染,猪繁殖与呼吸综合征病毒和猪乙型脑炎病毒的混合感染,猪细小病毒和猪乙型脑炎病毒的混合感染,伪狂犬病病毒、猪细小病毒和猪乙型脑炎病毒的混合感染,猪繁殖与呼吸综合征病毒、伪狂犬病病毒和猪乙型脑炎病毒的混合感染,猪繁殖与呼吸综合征病毒、伪狂犬病病毒、猪细小病毒和猪乙型脑炎病毒等多种复杂的混合感染。因而养猪场要贯彻预防为主,预防与控制、净化和消灭相结合的动物防疫方针,重视各类疫病的综合防控,尤其要重视垂直传播疫病的防控,逐渐净化垂直传播疫病。

