对溶液质子平衡方程式书写中若干问题的探讨
肖开提·阿布力孜,武荣兰
(新疆大学化工学院 石油天然气精细化工教育部/自治区重点实验室,新疆 乌鲁木齐 830017)
酸碱滴定法是工科分析化学教学的重要内容之一。酸碱滴定法的理论基础是酸碱平衡理论,酸碱平衡作为普遍存在的化学平衡对溶液中物种的存在形式有一定的影响。酸碱平衡受氢离子影响,溶液酸度的变化引起酸碱平衡的不断更新。酸碱之间的质子转移是酸碱反应的实质。
溶液中酸碱反应达到平衡时碱质子化所得到质子的量与酸解离所失去质子的量应该相等。根据质子得失数和相关组分的浓度列出的溶液总 H+浓度与得失质子有关组分平衡浓度之间的关系式称为质子平衡方程式(PBE)[1-2]。在书写中出现不正确的PBE会导致推导溶液pH计算式的过程中要经历复杂烦琐的途径,甚至列出不正确的pH计算式。因此,探讨书写PBE过程中易出现的错误及其原因和避免措施是非常有必要的。
教科书中书写PBE的方法有参考水准法和合并法。从质子转移的量守恒角度能写出PBE,即参考水准法。此法首先要选择一些酸碱组分作为参考水准,列出参考水准得失质子产物,最终建立得质子产物和失质子产物之间的定量关系并整理,所以,它涉及到参考水准的选择、定量关系的建立和整理等过程。合并法也可以写出PBE,但是不能帮助学生掌握PBE的本质,所以不是很提倡。除此之外,分析化学各教学团队在长期的教学过程中也总结出了适合自己教学环境的简便的书写方法[3-10],不管用哪一种方法关键在于PBE的正确列出,这是正确推导溶液pH计算式及处理相关问题的基础。
正确书写PBE涉及参考水准的正确选择,参考水准应该满足以下两个基本条件的酸碱组分,其一是在溶液中大量存在,其二是与质子转移直接相关,需要注意的是,对于同一物质,只能选择其中一种型体作为参考水准,一般选择为参考水准的型体不会出现在PBE中。书写各种酸碱溶液的PBE基于质子参考水准的选择。下面强调书写各种溶液PBE时的注意点,探讨书写PBE时易出现的若干问题及其原因和避免措施。
1 缓冲溶液(共轭体系)PBE的书写
酸碱缓冲溶液一般是由浓度较高的弱酸及其共轭碱组成的共轭体系,书写缓冲溶液的PBE时,首先涉及的是参考水准的选择,如对于HAc-NaAc缓冲溶液PBE的书写,普遍存在以HAc、Ac-、H2O为参考水准,写成如下PBE的现象:
[H+]=[OH-]+[Ac-]-[HAc]或[H+]+[HAc]=[OH-]+[Ac-]
选 HAc和 Ac-为参考水准的主要原因是 HAc-NaAc溶液中 HAc和Ac-作为缓冲组分在溶液中大量存在并能得失质子。HAc和Ac-是共轭酸碱对,互为得失质子产物,因此,在PBE中同时出现[HAc]和[Ac-]两项。被选为质子参考水准的组分是判断得失质子产物的依据,一般在PBE中不会出现。对于此类共轭体系,可以将其视作由弱酸与强碱或强酸与弱碱反应而来(即由弱酸与其共轭碱盐或共轭酸盐与弱碱组成),因此,其质子参考水准可选相应的弱酸与强碱或者弱碱与强酸[1-2]。下面以几种缓冲溶液为例,与读者讨论书写缓冲溶液PBE时的注意点:
针对 HAc-NaAc缓冲溶液,可用两种方式书写其PBE,其一是将其视为由弱酸(HAc)与强碱(NaOH)反应而来,其质子参考水准可选为HAc、NaOH和H2O,基于此质子参考水准,PBE可书写为如下:
[H+]=[OH-]+[Ac-]-[Na+](其中 [Na+]=CNaAc),即 [H+]=[OH-]+[Ac-]-CNaAc
其二是将其视作由弱碱(Ac-)与强酸(HCl)反应而来,因此,选Ac-、HCl与H2O为质子参考水准,基于此质子参考水准,书写PBE如下:
[H+]=[OH-]-[HAc]+[Cl-](其中 [Cl-]=CHAc),即 [H+]=[OH-]-[HAc]+CHAc
(2)Cmol· L-1NaH2PO4-Na2HPO4缓冲溶液:
将NaH2PO4-Na2HPO4缓冲溶液视为弱酸(H2PO4-)与强碱(NaOH)的混合溶液,因此,其质子参考水准可选H2PO4-(即弱酸)、NaOH(即强碱)与H2O,基于此参考水准,其PBE如下:
问题1主要考查学生运用不同数据分析方法的意识和能力.如利用表格的基本数据,可以通过空气指数的平均数、中位数、众数、方差等统计量去比较两个城市的空气质量.由于统计量的值是对样本特征的数值体现,因此,对两个城市空气质量的比较,其结果往往因数据分析方法的不同而有所差异.譬如从空气等级的优良率(昆明100%,乌鲁木齐85.7%)看,昆明的空气质量好于乌鲁木齐;从空气等级为“优”的天数(乌鲁木齐2,昆明0)看,乌鲁木齐的空气质量好于昆明.从空气指数的平均值(乌鲁木齐66.6,昆明68.3)来看,昆明的空气质量好于乌鲁木齐,等等.
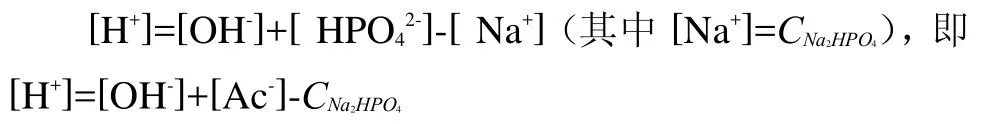
同样,将其也视为强酸(HCl)与弱碱(HPO42-)的混合溶液,因此,可选HPO42-(即弱碱)、HCl(即强酸)和H2O为参考水准,其PBE为如下:
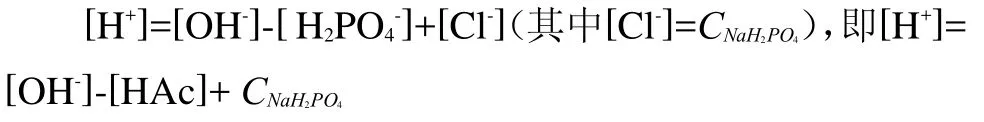
(3)0.2 mol· L-1NaAc-0.1 mol· L-1HAc-溶液:
其质子参考水准可选HAc(即弱酸)、NaOH(即强碱,0.20mol·L-1)与H2O,基于此质子参考水准,PBE可书写为如下:
[H+]=[OH-]+[HPO42-]-[Na+](其中[Na+]=CNaAc=0.2 mol· L-1)即[H+]=[OH-]+[Ac-]-0.2
质子参考水准也可选为Ac-(即弱碱)、HCl(即强酸,0.1mol·L-1)与H2O为质子参考水准,基于此参考水准,其PBE为如下:
[H+]=[OH-]-[HAc]+[Cl-](其中[Cl-]=CHac=0.1mol·L-1),即[H+]=[OH-]-[HAc]+0.1
总之,书写缓冲溶液质子条件式时,要避免将作为缓冲组分的弱酸及其共轭碱或弱碱及其共轭酸同时选为参考水准,一般缓冲组分中作为弱酸的组分选为参考水准时,同时可选强碱与溶剂分子H2O为参考水准。如作为弱碱的组分选为参考水准时,同时可选强酸与H2O为参考水准,这样可以避免,因两个缓冲组分同时被选为质子参考水准,在PBE中出现质子参考水准项的现象。
2 C mol·L-1H2SO4溶液PBE的书写
在书写各种酸碱溶液PBE时,除了常规的一元强酸、一元弱酸和多元弱酸外还会遇到像硫酸一样第一级解离属于强酸,而第二级解离属于弱酸的多元酸溶液。对于H2SO4溶液,其PBE经常书写如下形式:
[H+]=[OH-]+[HSO-]+2[SO2-]或[H+]=[OH-]+2Cmol·L-1
对于[H+]=[OH-]+[HSO-]+2[SO2-]的书写形式,其主要原因是把H2SO4的两级解离都归属为弱酸型解离,而忽略其第一级解离属于完全解离,结果选H2SO4和H2O为参考水准而得到的。
对于[H+]=[OH-]+2Cmol·L-1的书写形式,其主要原因是把H2SO4的两级解离都归属为强酸型解离,即H2SO4的第一级和第二级解离都归属为完全解离。实际上H2SO4的第一级解离属于完全解离,即H2SO4→H++HSO4-,所以不存在第一级解离平衡及其平衡常数Ka1。其第二级解离不属于完全解离,因此,存在第二级解离平衡即HSO4-H++SO42-,其第二级解离常数Ka2=1.0×10-2,这也是在相关的教科书上找不到H2SO4的Ka1而只找到Ka2的原因。总之,针对这样的第一级解离是属于完全解离的,但第二级解离不是完全解离的多元酸,因此,需要注意的是将此类溶液视为一元强酸和一元弱酸的混合溶液,H2SO4溶液中由于H2SO4的第一级解离,溶液中实际存在的主要酸碱组分与原始组分不同,即H2SO4溶液中不存在H2SO4分子,而主要存在的并与质子转移直接相关的组分是HSO4-。选参考水准时把H2SO4溶液看成一元强酸/H(HSO4)和一元弱酸/HSO4-的混合溶液;H(HSO4)作为强酸完全解离,解离后向溶液提供的 H+浓度等于酸的原始浓度,即 [H+]=CH2SO4;HSO4-作为弱酸部分解离,解离后向溶液提供的H+浓度等于HSO4-的解离产物SO42-的平衡浓度,即[H+]HSO4=[SO42-]。
所以,C mol· L-1H2SO4溶液的 PBE应为:[H+]=[OH-]+[SO2-]+CH2SO4mol· L-1。
3 C mol·L-1Na2S溶液PBE的书写
Na2S是强电解质,溶于水时完全解离成Na+和S2-,溶液中实际存在的主要组分是Na+和S2-,其中与质子转移直接相关的组分是S2-,S2-具有很强的质子化倾向,因此,此溶液相当于二元碱溶液。一般书写Na2S溶液PBE时,可选S2-和H2O选为质子参考水准,由此得到的PBE如下:
[H+]=[OH-]-[HS-]-2[H2S]即[OH-]=[H+]+[HS-]+2[H2S]
此PBE是把S2-看成弱碱,选它为参考水准而书写的结果,这给Na2S溶液pH计算式的推导带来复杂烦琐的替换及简化整理过程。
在Na2S溶液pH计算式的推导过程中,[HS-]和[H2S]项的替换需要H2S的第一级和第二级解离平衡常数Ka1和Ka2(或S2-的第一级和第二级质子化平衡常数Kb1和Kb2)。因H2S为二元弱酸,其第一级解离很弱,Ka1为1.3×10-7,更要注意的是其第二级解离极弱,Ka2为7.1×10-15,在分析化学教科书上的附录表中未查到Ka2,可视为第二级解离几乎不存在。HS-和 S2-作为 H2S的第一级和第二级解离产物,其第一级和第二级质子化常数Kb1和Kb2分别为1.4和7.7×10-8。Kb1为1.4能够说明S2-的第一级质子化极强,即S2-是“第一级质子化极强的二元碱”,因此,保证误差在所允许范围内的基础上,为了简化Na2S溶液pH计算式的推导过程,在书写Na2S溶液PBE时,建议将S2-可视为第一级质子化属于完全质子化,而第二级质子化属于部分质子化的二元碱。这样Na2S溶液PBE的书写与H2SO4溶液PBE的书写相似,只是H2SO4是二元酸,Na2S(即S2-)是二元碱。
4 C mol·L-1H3BO3和H3PO3溶液PBE的书写
硼酸和亚磷酸看似三元弱酸,通常按多元弱酸PBE的书写方法,H3BO3和H3PO3溶液的PBE易写出如下:[H+]=[OH-]+[H2BO3-]+2[HBO32-]+3[BO33-]和[H+]=[OH-]+[H2PO3-]+2[HPO32-]+3[PO33-]。
此PBE看似是对的,实际上并不正确。对于Cmol·L-1H3BO3溶液来说,H3BO3溶液中只有其第一级解离,其第二级解离和第三级解离不存在,因此可以忽略。所以H3BO3虽然看似三元弱酸,但作为一元弱酸书写PBE就可以。在相关教学资料中也只提供了其第一级解离常数(Ka1=5.8×10-10)。
总之,书写H3BO3溶液PBE时,把H3BO3作为一元弱酸来对待列出其PBE才是简便合理的,因此,H3BO3溶液的PBE为:[H+]=[OH-]+[H2BO-]。
对于C mol·L-1H3PO3溶液来说,H3PO3溶液中只存在其第一级和第二级解离,第三级解离不存在,因此可以不考虑。所以,H3PO3是看似三元弱酸,实际上相当于二元弱酸,相关教科书中也只有其第一级和第二级解离常数(Ka1=5.0×10-2,Ka2=2.5×10-7)。因此,书写 H3PO3溶液 PBE时,作为二元弱酸来对待,列出其PBE如下:[H+]=[OH-]+[H2PO-]+2[HPO2-]。
5 C mol·L-1NaHSO4和Na2SO4溶液PBE的书写
NaHSO4是强电解质,溶于水时完全解离成 Na+和HSO4-,溶液中大量存在的并能得失质子的组分是HSO4-,所以,通常选HSO4-与H2O为参考水准,易列出如下PBE:
[H+]=[OH-]+[SO42-]-[H2SO4]
但这个PBE是不正确的,主要原因是把HSO4-看成是两性物质,既有酸型解离,又有碱型解离(质子化)。实际上HSO4-的碱型解离(质子化)不存在,只存在酸型解离,因此其正确的PBE应为:[H+]=[OH-]+[SO42-]。
同样Na2SO4溶于水时完全解离成Na+和SO42-,溶液中大量存在的并能得失质子的组分是SO42-,因此,可选SO42-和H2O为参考水准,在书写PBE时,有时易列出如下不正确的PBE:[H+]=[OH-]-[HSO4-]-2[H2SO4]。出现错误的原因是把SO42-看成强碱,认为其两级质子化都存在,实际上其第二级质子化不存在,即HSO4-+H2O→H2SO4+OH-不存在。所以,其正确的PBE应为:[H+]=[OH-]-[HSO4-]或[OH-]=[H+]+[HSO4-]。
6 结语
总之,各种酸碱溶液PBE的正确书写是准确推导该酸碱溶液pH计算式的基础;出现在PBE中的不该出现的各项对溶液pH计算式的推导和简化过程带来不必要的麻烦,甚至导致不正确的溶液pH计算式的推导。在教学中,针对PBE书写中的以上注意点进行补充讲解和强调,有利于在书写PBE和推导溶液pH计算式中的重点和难点的更好掌握。

