LncRNA OSER1-AS1/miR-149-5p对口腔鳞癌细胞HSC-3生物学行为的影响
高磊 杨光 冯培 肖震 武家明 于浩
(齐齐哈尔市第一医院口腔颌面外科,黑龙江 齐齐哈尔 161000)
口腔鳞癌是一种常见的头颈部恶性肿瘤,其发病率占全身肿瘤的3%,我国口腔鳞癌发病率逐年增加且已严重威胁人类生命安全,手术、放化疗等技术水平的提高可明显改善口腔鳞癌患者生存质量,而口腔鳞癌转移是治疗的关键问题,亦是影响患者预后的重要因素,因而探究口腔鳞癌发病机制对口腔鳞癌转移的预防及治疗均具有重要意义,长链非编码RNA(LncRNA)在肿瘤中异常表达并可发挥重要调控作用,已有研究表明LncRNA在口腔鳞癌中差异表达,通过调节癌细胞生物学行为在癌症进展中发挥重要作用〔1~4〕。LncRNA OSER1-AS1在肝细胞癌中呈高表达,并可通过调节miR-372-3p/Rab23轴促进肝细胞癌的发生〔5〕。靶基因预测显示OSER1-AS1与miR-149-5p存在结合位点,miR-149-5p在胃癌中表达水平降低〔6〕。因此,本研究主要探讨OSER1-AS1/miR-149-5p分子轴在口腔鳞癌发生及发展过程中的可能作用机制,为口腔鳞癌治疗策略的发展提供新的研究方向。
1 材料与方法
1.1材料与试剂
1.1.1一般资料 43例从2018年2月至2019年10月在齐齐哈尔市第一医院收治的口腔鳞癌患者被纳入此次研究〔男32例,女11例,平均年龄(63.29±6.98)岁〕。口腔鳞癌患者均经病理确诊。收集术中切除的癌旁及口腔鳞癌组织并置于-80℃保存。合并其他恶性肿瘤或者自身免疫性疾病患者被排除。
1.1.2细胞与主要试剂 上海冠导生物人口腔鳞癌细胞HSC-3;美国Gibco公司提供DMEM培养液、胎牛血清、胰蛋白酶;美国Invitrogen公司提供Trizol试剂与Lipofectamine2000;美国Hyclone公司提供Opti-MEM减血清培养基;美国Thermo Fisher公司提供反转录与SYBR荧光定量检测试剂;广州锐博生物提供si-NC、si-OSER1-AS1、miR-NC、miR-149-5p mimics、miR-149-5p inhibitor及其阴性对照(NC);北京索莱宝提供MTT试剂与膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)试剂、基质胶;美国Corning公司提供Transwell小室;北京全式金生物提供RIPA裂解液、BCA蛋白定量检测试剂盒;美国Santa Cruz公司提供兔抗人B淋巴细胞瘤/白血病(Bcl)-2、Bcl-2相关X蛋白(Bax)、钙黏蛋白E(E-cadherin)、N-钙黏蛋白(cadherin)抗体;北京中杉金桥生物提供辣根过氧化物酶(HRP)标记的山羊抗兔二抗。
1.2方法
1.2.1实验分组 将1×106个/ml对数生长期的HSC-3细胞接种于6孔板(200 μl/孔),细胞进行转染:采用Opti-MEM减血清培养基与si-NC、si-OSER1-AS1、si-OSER1-AS1与NC、si-OSER1-AS1与miR-149-5p inhibitor充分混合,将其置于室温条件下孵育5 min作为A液,Lipofectamine2000转染试剂和Opti-MEM减血清培养基充分混合作为B液,将A液与B液充分混合后置于室温条件下孵育20 min,将混合液加入HSC-3细胞后于培养箱内继续孵育6 h,弃上清后更换DMEM完全培养液继续培养48 h,分别记为si-NC组、si-OSER1-AS1组、si-OSER1-AS1+NC组、si-OSER1-AS1+miR-149-5p inhibitor组。
1.2.2qRT-PCR 采用Trizol法提取组织及细胞总RNAs。检测RNA浓度后,根据反转录试剂盒说明书操作合成cDNA。应用美国ABI StepOnePlus实时荧光定量PCR仪检测OSER1-AS1(内参GAPDH)、miR-149-5p(内参U6)相对表达量。
1.2.3MTT检测细胞存活率 收集各组HSC-3细胞后加入MTT试剂(20 μl/孔),将其置于培养箱内继续培养4 h后经3 000 r/min离心5 min弃上清,将二甲基亚砜(DMSO)加入其中(150 μl/孔)后室温孵育1 h,检测细胞相对吸光度值(OD 490 nm)并计算细胞存活率〔实验组OD值/对照组OD值×100%〕。
1.2.4平板克隆形成实验 收集各组HSC-3细胞(1×105个/ml)接种于6孔板(100 μl/孔),将其置于培养箱内培养直至出现肉眼可见的细胞克隆团,用多聚甲醛(4%)固定细胞20 min,然后用结晶紫(1%)染色15 min。蒸馏水洗涤后,通过光学显微镜对菌落数(>50 个细胞)进行计数和拍照。
1.2.5流式细胞术 将各组HSC-3细胞重悬于100 μl结合缓冲液(1×)中,根据凋亡检测试剂盒说明书用Annexin V-FITC(10 μl)和PI(5 μl)染色。通过流式细胞术对样品进行分析。
1.2.6Transwell 将各组HSC-3细胞悬液(2×104细胞/200 μl无血清培养基)添加到Transwell 室上室中〔基质胶涂层(40 μl/孔)用于侵袭检测和未涂层用于迁移检测〕,并将500 μl添加有10%胎牛血清的培养基添加到下隔室中。24 h后,磷酸盐缓冲液(PBS)洗涤,通过膜的细胞用4%多聚甲醛固定,0.1%结晶紫染色,然后显微镜观察计数。
1.2.7双荧光素酶报告实验 构建野生型(WT)或突变型(MUT)荧光素酶报告载体(WT/MUT-OSER1-AS1)。参照Lipofectamine2000转染试剂说明书分别将miR-NC、miR-149-5p mimics与WT-OSER1-AS1、MUT-OSER1-AS1共转染入HSC-3细胞。48 h后,检测荧光素酶活性。
1.2.8Western印迹检测蛋白表达 采用500 μl RIPA裂解液提取各组HSC-3细胞的总蛋白。BCA法检测蛋白浓度后,30 μg蛋白样品被10%的十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离,并转移到聚偏氟乙烯(PVDF)膜上。用5%脱脂奶粉封闭2 h,加入稀释比1∶1 000的一抗稀释液孵育24 h(4℃条件下),随后加入稀释比为1∶5 000的二抗稀释液孵育1 h(37℃)。TBST洗涤后,采用电化学发光(ECL)试剂盒检测蛋白信号随后应用ImageJ软件分析各条带灰度值。
1.3统计学处理 采用SPSS21.0软件进行独立样本t检验。
2 结 果
2.1OSER1-AS1和miR-149-5p在口腔鳞状细胞癌细胞中的表达 相较于癌旁组织,OSER1-AS1在口腔鳞癌组织中显著升高(P<0.05),而miR-149-5p的表达水平降低(P<0.05),见表1。
2.2干扰OSER1-AS1对HSC-3增殖的影响 转染si-OSER1-AS1后细胞活力显著降低(P<0.05)且克隆形成数显著减少(P<0.05),而si-NC转染不影响细胞增殖(P>0.05)。此外OSER1-AS1敲除导致miR-149-5p的表达水平显著升高(P<0.05),见图1、表2。

表1 OSER1-AS1和miR-149-5p的表达

表2 干扰OSER1-AS1对HSC-3细胞存活率、克隆形成及凋亡的影响

图1 干扰OSER1-AS1对HSC-3克隆形成的影响
2.3干扰OSER1-AS1对HSC-3凋亡的影响 如表2、图2、图3所示,与si-NC组比较,si-OSER1-AS1转染诱导细胞凋亡显著增加(P<0.05),并伴随着Bax蛋白显著升高,Bcl-2蛋白显著降低(均P<0.001)。
2.4干扰OSER1-AS1对HSC-3迁移、侵袭及EMT的影响 相较于si-NC转染,si-OSER1-AS1转染显著抑制细胞迁移及侵袭(P<0.05),si-OSER1-AS1组细胞E-cadherin蛋白含量显著升高(P<0.05),N-cadherin蛋白含量显著降低(P<0.05),见图4、图5、表3。

1,2:si-NC组,si-OSER1-AS1组;图3~5同图2 干扰OSER1-AS1对HSC-3凋亡
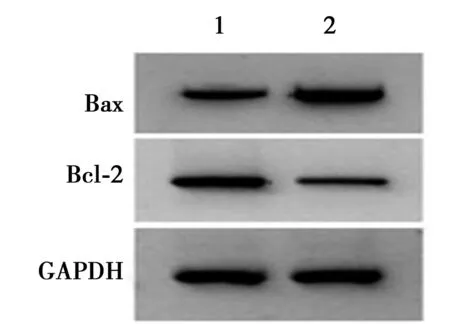
图3 凋亡蛋白表达

图4 干扰OSER1-AS1对HSC-3迁移、侵袭(结晶紫染色,×200)

图5 Western印迹检测E-cadherin、N-cadherin蛋白表达

表3 OSER1-AS1下调对HSC-3迁移、侵袭及EMT的影响
2.5OSER1-AS1和miR-149-5p靶向关系的验证 图6显示miR-149-5p在OSER1-AS1的结合位点。 miR-149-5过表达明显降低野生型OSER1-AS1报告载体的荧光素酶活性(P<0.05),但不影响突变型(P>0.05),见表4。

图6 OSER1-AS1靶向miR-149-5p

表4 双荧光素么报告实验
2.6抑制miR-149-5p对干扰OSER1-AS1处理的HSC-3增殖、凋亡的影响 与si-OSER1-AS1+NC组比较,si-OSER1-AS1+miR-149-5p inhibitor组细胞存活率显著升高(P<0.05),克隆形成数显著增多(P<0.05),细胞凋亡率显著降低(P<0.05),Bax蛋白水平显著降低(P<0.05),Bcl-2蛋白水平显著升高(P<0.05),见图7~9、表5。

1,2:si-OSER1-AS1+NC组,si-OSER1-AS1+miR-149-5p inhibitor组;下图同图7 抑制miR-149-5p对干扰OSER1-AS1处理的HSC-3凋亡的影响

图8 抑制miR-149-5p对干扰OSER1-AS1处理的HSC-3 克隆形成的影响

图9 Bax、Bcl-2蛋白表达

表5 抑制miR-149-5p对干扰OSER1-AS1处理的HSC-3细胞存活率、克隆形成和凋亡的影响
2.7抑制miR-149-5p对干扰OSER1-AS1处理的HSC-3迁移、侵袭及EMT的影响 相较于si-OSER1-AS1+NC组,细胞迁移及侵袭的数量在si-OSER1-AS1+miR-149-5p inhibitor组显著增多(P<0.05),且E-cadherin蛋白含量显著下降(P<0.05),N-cadherin蛋白含量显著升高(P<0.05),见图10、图11、表6。
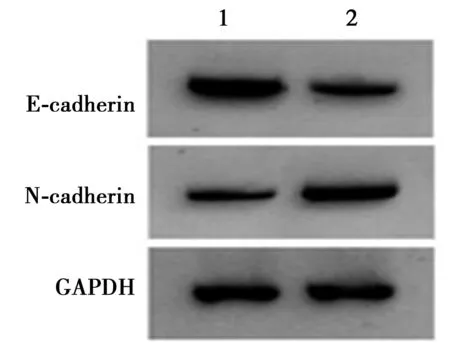
图10 E-cadherin、N-cadherin蛋白表达

图11 抑制miR-149-5p对干扰OSER1-AS1处理的HSC-3迁移、侵袭的影响(结晶紫染色,×200)

表6 抑制miR-149-5p对干扰OSER1-AS1处理的HSC-3迁移、侵袭的影响
3 讨 论
有研究表明LncRNA 在口腔鳞癌患者中异常表达,此外,环状RNAs(circRNAs )差异表达可能通过充当miRNA竞争性内源RNA在口腔鳞癌的病理进展中起作用。例如,LncRNA LACAT1通过抑制miR-4301促进口腔鳞癌细胞增殖〔7〕。LncRNA HOXA11-AS通过抑制miR-214-3p表达而促进口腔鳞癌细胞增殖〔8〕。LncRNA人母系表达基因(MEG)3的低表达通过靶向miR-21促进口腔鳞癌的发展〔9〕。LncRNA膀胱癌相关转录本(BLACAT)1通过靶向miR-142-5p调节口腔鳞癌细胞的活力、迁移和侵袭〔10〕。LncRNA核旁斑组装转录本(NEAT)1通过调控miR-365/G蛋白信号转导调节因子(RGS)20在口腔鳞癌中促进细胞增殖和侵袭〔11〕。然而关于口腔鳞癌中OSER1-AS1表达,功能及机制的研究仍然较少。
有研究表明,OSER1-AS1通过竞争性结合miR-433-3p而促进Smad2的表达从而促进非小细胞肺癌的发展〔12〕。本研究结果显示,口腔鳞癌组织中OSER1-AS1的表达水平高于癌旁组织,干扰OSER1-AS1表达能够抑制口腔鳞癌细胞增殖及克隆形成能力。Bcl-2属于抗凋亡蛋白,Bax属于促凋亡蛋白,Bcl-2/Bax比值降低,即Bax的表达水平升高可通过线粒体凋亡途径的激活促进细胞凋亡〔13〕。在本次实验中,OSER1-AS1敲除可通过促进Bax的表达及抑制Bcl-2的表达显著刺激口腔鳞癌细胞凋亡,提示干扰OSER1-AS1表达可促进口腔鳞癌细胞凋亡。EMT已被证明在肿瘤转移中至关重要,其标志是 N-cadherin 上调及E-cadherin 的下调〔14〕。随后本研究发现,OSER1-AS1下调抑制口腔鳞癌细胞迁移和侵袭能力及EMT过程。
为进一步探究OSER1-AS1在口腔鳞癌发生及发展过程中的作用机制,本研究证实OSER1-AS1与miR-149-5p存在靶向调控作用,其可负向调控miR-149-5p的表达。circ_0075341通过上调miR-149-5p的表达而促进宫颈癌的发展〔15〕。LncRNA前列腺癌相关转录本(PCAT)-1通过靶向miR-149-5p调节结直肠癌细胞增殖、侵袭、迁移和凋亡〔16〕。LncRNA PCAT-1通过调节miR-149-5p/LRIG2轴促进非小细胞肺癌的进展〔17〕。在甲状腺髓样癌中上调miR-149-5可靶向抑制GIT1减弱癌细胞的侵袭和增殖〔18〕。circCTNNA1通过充当miR-149-5p的海绵分子并调节FOXM1表达而促进结直肠癌的进展〔19〕。LncRNA BLACAT1通过充当miR-149-5p的海绵分子并靶向驱动蛋白家族成员(KIF)2A而促进胃癌的发生〔20〕。本研究结果显示,口腔鳞癌组织中miR-149-5p的表达水平低于癌旁组织,抑制miR-149-5p表达明显削弱OSER1-AS1敲除对口腔鳞癌细胞生长以转移的抑制作用。
综上所述,下调口腔鳞癌细胞中OSER1-AS1的表达可通过升高miR-149-5p的表达从而抑制癌细胞生长和转移,为口腔鳞癌的治疗提供潜在靶标。但关于OSER1-AS1/miR-149-5p如何调控下游靶基因表达仍需进一步探究,仍需进行体内实验进一步验证OSER1-AS1/miR-149-5p分子轴在口腔鳞癌发生及发展过程中的作用机制。

