重组腺病毒疫苗插入基因表达产物鉴别方法的建立及验证
孙博,刘晓晖,马达,原秀娟,闫慧,刘新涛,张海红,谷铁军,吴婷婷
1.吉林大学生命科学学院,吉林 长春 130012;2.吉林大学艾滋病疫苗国家工程实验室,吉林 长春 130012;3.吉林省产品质量监督检验院,吉林 长春 130022;4.长春百克生物科技股份公司,吉林 长春 130103;5.长春安沃高新生物制药有限公司,吉林 长春 130012
跨膜黏蛋白在人类癌症中的过度表达使其成为疫苗、抗体和药物抑制剂开发的极具吸引力的靶点。最近的研究表明,黏蛋白1(mucin 1,MUC1)胞浆结构域是一个直接的药物靶点,在临床前模型中,抑制MUC1功能可阻止人乳腺癌和前列腺癌的生存及致瘤性[1]。癌症是一组异质性疾病,不仅是细胞异常增殖的结果,也是缺乏良好调控的细胞死亡的结果。凋亡抵抗是肿瘤细胞产生化疗耐药从而促进肿瘤进展的重要逃避机制之一。因此,参与细胞凋亡调控的分子被认为是癌症治疗的潜在靶点。在这方面,生存素(Survivin)作为凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族中最小的成员,其在细胞周期进程和凋亡抑制中起着双重作用[2]。
MUC1癌蛋白在大多数人类癌症和某些血液系统恶性肿瘤中高水平异常表达。据统计,美国每年确诊的140万例癌症患者中,约90万例肿瘤中MUC1过表达。因此,MUC1已成为疫苗、抗体和小分子等新型抗癌药物开发的极具吸引力的靶点[3]。然而,目前尚无被批准的针对MUC1的药物。MUC1是黏蛋白家族之一,其基因位于1号染色体长臂(1q21)的第21条带上[4]。MUC1黏蛋白结构包含2个不同的亚基:1个大的N-末端亚基(MUC1-N,亚基α)和1个短的C-末端亚基(MUC1-C,亚基β),来源于海胆精子蛋白肠激酶和内质网中的集聚蛋白结构域。这些亚基被非共价相互作用结合。MUC1-N结构域包含N-末端(104 aa)和可变数目的串联重复(VNTR)片段(20 aa)序列(PDTRPAPGSTAPPAHGVTSA),重复20~200次[5]。对应编码的20个氨基酸序列中PDTRP部位均可被B细胞和T细胞识别,B细胞和T细胞的反应依赖于蛋白质片段的蛋白水解处理和MHC呈递[6]。MUC1的相对分子质量约(1~40)×106。大多数蛋白质修饰包括糖基,糖基占蛋白质总重量的60%~80%,主要为O-多糖。已有研究表明,活化的T细胞表达的MUC1黏蛋白可能通过下调T细胞的增殖反应来帮助主动终止T细胞的免疫反应,并由于其黏附和 /或抗黏附特性而在淋巴细胞运输中发挥作用[7]。
Survivin是一种小蛋白,属于凋亡抑制蛋白家族,其蛋白的结构含有杆状病毒IAP重复序列[2]。与成人分化组织相比,其在肿瘤中大量表达,在许多人类肿瘤中预后较差。这种凋亡抑制因子在促进癌细胞存活和抑制细胞死亡方面均有相关作用。因此,Survivin的异常表达刺激肿瘤进展,并在多种肿瘤中对多种治疗策略产生抵抗。事实上,有效的Survivin下调或抑制会导致自发性细胞凋亡或对化疗和放疗增敏。因此,这些特点使得Survivin成为治疗癌症的一个有吸引力的治疗靶点。Survivin可能参与了肿瘤转移的发生,其可能被用作疾病进展的生物标志物[8]。
为增强疫苗的广谱性和有效性,本研究构建了针对MUC1和Survivin的融合基因MS作为肿瘤抗原,用以构建腺病毒载体疫苗。重组腺病毒疫苗(又称MUC1-Survivin治疗性癌症疫苗,Admax-MS,代号ADMS)是以重组腺病毒为载体开发的一种治疗性生物制品,是利用分子生物学技术将肿瘤抗原基因MUC1(327 bp)和Survivin(411 bp)插入至去除了E1B-55KD蛋白基因的重组腺病毒载体上获得重组腺病毒制品。重组腺病毒载体疫苗的外源基因包括肿瘤抗原MUC1和Survivin。MUC1选用的是其可变数目的串联重复区(variable-number tandem repeat,VNTR)。VNTR是免疫显性结构域,已有多个研究用该部分构建疫苗并在动物体内检测到细胞和体液免疫反应,而在该疫苗中我们使用5个拷贝的VNTR,简称5M。5M的获得过程如下:首先通过重叠延伸PCR技术获得1个拷贝的VNTR,然后通过克隆构建依次获得2、4和5个拷贝的VNTR。Survivin在多种肿瘤中均高表达,是抗凋亡蛋白家族成员,具有抗凋亡和调控细胞分裂的作用,如果用其全长来设计疫苗可能存在安全隐患。本研究团队设计并筛选了其抗凋亡功能剪切体S8(即N-末端缺失7个氨基酸的剪切体)用于疫苗的构建。该疫苗中的Survivin是通过PCR技术从293细胞中获得的,其目的基因cDNA全长744 bp,编码相对分子质量约37 000的蛋白。构建该重组腺病毒制品的目的是用于治疗表达MUC1和Survivin的肿瘤。
为满足样品生产的需求并提供产量稳定、质量可靠的产品,根据《中国药典》四部(2020版)通则9101分析方法验证指导原则[9]以及2003年公布的《预防用以病毒为载体的活疫苗制剂的技术指导原则》[10]和《人基因治疗研究和制剂质量控制技术指导原则》[11]的相关技术要求,进行了重组腺病毒载体疫苗的质量研究及相应的方法学验证工作。由于制品采用复制缺陷型5型腺病毒载体,根据NMPA颁布的《预防用以病毒为载体的活疫苗制剂的技术指导原则》和《人基因治疗研究和制剂质量控制技术指导原则》的要求,鉴别试验包括对限制性酶切图谱的鉴别和对插入基因的检测。
本研究采用病毒感染后的细胞上清液进行Western blot分析,建立了插入基因表达产物的检测方法,并对该方法的专属性和耐用性进行了验证。
1 材料与方法
1.1 细胞及样品HEK293细胞购自ATCC(货号:CRL-1573TM),由吉林大学艾滋病疫苗国家工程实验室提供。重组腺病毒疫苗(ADMS)样品由长春百克生物科技股份公司提供,批号:S191201、P191201、P191202和P191203;阴性对照:转染质粒pDC316的腺病毒收获液(批号:C191007P3),由该公司制备;阳性对照:感染ADMS的腺病毒收获液(批号:C191005P2),由该公司制备。
1.2 主要试剂 牛血清、DMEM培养基购自美国Gibco公司;胰蛋白酶消化液购自美国Hyclone公司;封闭液、RIPA裂解液、鼠源Survivin多抗由长春百克生物科技股份公司自制;鼠源MUC1单抗购自美国BD公司;AP标记的兔和AP标记的鼠二抗购自美国Jackson Immuno公司;蛋白预染marke(r1 kb,500 μL)购自美国Bio-Rad公司。
1.3 细胞培养 取出冻存的HEK293细胞,经37℃水浴融化,用含10%胎牛血清的DMEM培养基重悬后,加至T25细胞培养瓶中,37℃,5% CO2培养箱培养。细胞经扩大培养后,铺板至6孔板,待细胞密度达80%时进行感染试验。
1.4 细胞感染 将2 μL ADMS样品加至198 μL含2%胎牛血清的DMEM培养液中,混匀;取100 μL加至1.9 mL含2%胎牛血清的DMEM培养液中,混匀。吸弃细胞培养板中液体,每孔加入2 mL含疫苗样品的培养基,阴性对照孔加入2 mL含2%胎牛血清的DMEM培养基。将6孔板置37℃,5% CO2培养箱继续培养40~44 h。感染后的细胞一部分为悬浮状态,一部分为贴壁状态。用移液器将贴壁细胞吹下,转移至灭菌1.5 mL EP管中,室温560×g离心5 min,弃上清,置-20℃保存。
1.5 ADMS插入基因表达产物的分析 在细胞样品中依次加入4×SDS凝胶加样缓冲液75 μL、RIPA裂解液75 μL,充分裂解细胞后,置100℃干式恒温器上加热20 min,6 720×g离心1 min,沉淀细胞碎片,取上清进行Western blot检测:按照相同次序上样2组,样品经10% SDS-PAGE分离后,通过半干转移电泳槽15 V电压下转膜18 min;3%封闭液室温封闭1 h;PBST缓冲液洗膜3次,一组加入MUC1单抗,另一组加入Survivin兔多抗(均1∶1 000稀释),4℃过夜;PBST缓冲液洗膜3次,一组加入AP标记的兔二抗,另一组加入AP标记的鼠二抗(均1∶10 000稀释),室温摇床孵育45 min;PBST缓冲液洗膜3次,加入BCIP/NBT避光显色。
1.6 ADMS插入基因表达产物检测方法的验证
1.6.1 专属性 取ADMS(S191201批)、阴性对照、阳性对照样品,由1名实验人员在同一试验参数下(均为2.0×108VP,40 h),重复测定3次。判定标准:重组腺病毒疫苗插入基因表达产物能被MUC1-Survivin的两种抗体分别识别,在目标位置(相对分子质量约37 000)可见特异性条带,大小及组成与实际值相符,阴性对照不能被识别。
1.6.2 耐用性 取ADMS、阴性对照、阳性对照样品,采用不同VP和不同的细胞感染时间,由1名实验人员分别进行检测,具体试验操作参数见表1。判定标准:重组腺病毒疫苗插入基因表达产物能被MUC1-Survivin的两种抗体分别识别,在目标位置(相对分子质量约37 000)可见特异性条带,大小和组成与实际值相符,阴性对照不能被识别。

表1 耐用性试验参数Tab.1 Parameters in durability test
1.7 方法的初步应用 采用建立的方法分别检测3批(P191201、P191202、P191203)ADMS及阴性对照、阳性对照样品,试验参数均为:2.0×108VP,40 h。
2 结果
2.1 插入基因表达产物检测方法的专属性验证结果 表达产物能被MUC1-Survivin的两种抗体分别识别,在相对分子质量约37 000处可见特异性条带,大小和组成与实际值相符,阴性对照不能被识别。见图1。
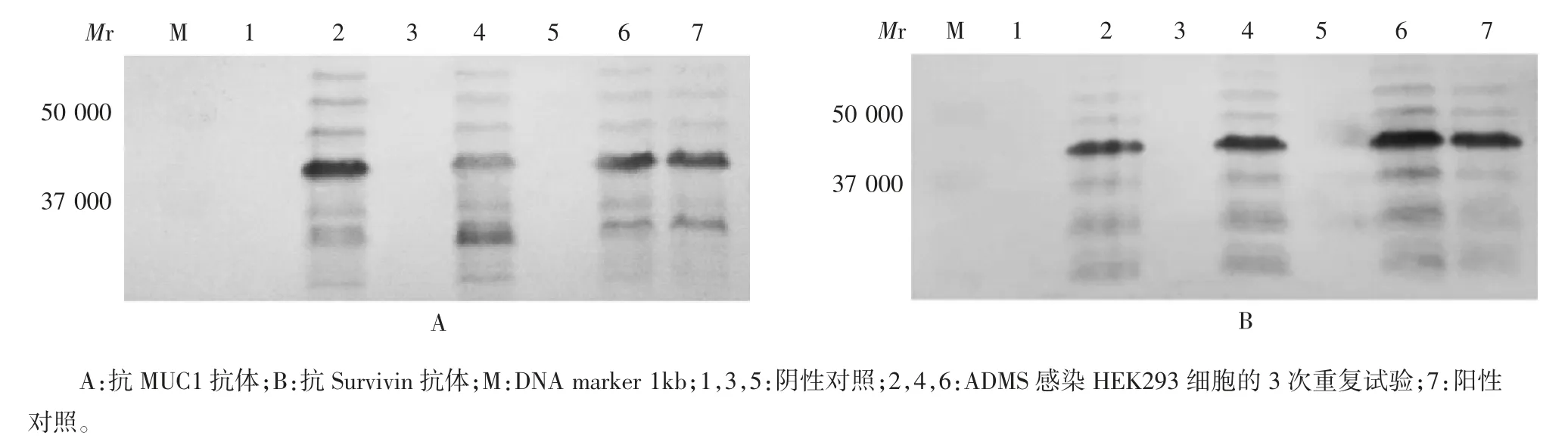
图1 专属性验证试验中表达产物的Western blot分析Fig.1 Western blotting of expressed products in validation for specificity
2.2 插入基因表达产物检测方法的耐用性验证结果 表达产物能被MUC1-Survivin的两种抗体分别识别,在相对分子质量约37 000处可见特异性条带,大小和组成与实际值相符,阴性对照不能被识别。见图2。

图2 耐用性验证试验中表达产物的Western blot分析Fig.2 Western blotting of expressed products in validation for durability
2.3 方法的初步应用3批ADMS样品插入基因表达产物均能被MUC1-Survivin的两种抗体分别识别,在相对分子质量约37 000处可见特异性条带,大小和组成与实际值相符,阴性对照不能被识别,见图3。

图3 3批ADMS插入基因表达产物的Western blot分析Fig.3 Western blotting of expressed products of inserted genes in three batches of ADMS
3 讨论
2010年第一个肿瘤治疗性疫苗(Provenge疫苗[12])被美国FDA批准,但由于Provenge属于DC疫苗,制备困难,且由于经营不善,导致生产该疫苗企业破产,使肿瘤治疗性疫苗的研究进入低谷。至目前为止,仍无肿瘤治疗性疫苗获FDA批准。但近几年肿瘤免疫疗法的成功又使人们的目光聚焦至肿瘤治疗性疫苗的研究上。免疫检查点阻滞剂(immunecheckpoint blockers,ICBs)包含CTLA-4、PD-1/PD-L1单克隆抗体在内,在癌症治疗中已获得巨大成功。由于其在肿瘤模型中体现出的生物活性及其反应持久性,以及即使在转移性和化疗耐药疾病中也能观察到的治疗效果[13-15],使得ICBs在多种肿瘤中成为一线治疗药物,但其仅对少部分患者有效[16]。
在研究其有效性相关的生物标记物时发现,CD8+T细胞是治疗的关键,在治疗前和治疗过程中未产生CD8+T细胞免疫反应的患者,对PD-1/L1抗体无反应[17-18]。而肿瘤治疗性疫苗的作用机制就是通过导入肿瘤抗原,诱导机体产生肿瘤抗原特异性CD8+T细胞免疫反应。因此,科学家们预言,肿瘤治疗性疫苗将成为肿瘤药物研发的下一个热点。
本研究团队前期构建了肿瘤抗原MUC1和Survivin融合的双靶点肿瘤腺病毒载体疫苗,该疫苗可有效抑制小鼠肿瘤的生长,与化药联用可显著延长荷瘤小鼠的生命[19]。预期这种新型疫苗将在人体临床中表现出有效的抗肿瘤免疫反应。
本研究采用感染试验和常规Western blot法成功鉴别了重组腺病毒疫苗插入基因表达产物。根据《中国药典》四部(2020版)通则9101分析方法验证指导原则规定,对鉴别试验项目的验证指标即专属性和耐用性进行了验证。在感染试验中,通过采用不同VP和不同的细胞感染时间来验证此鉴别方法的专属性和耐用性,实验结果均符合规定。因此,可用感染试验和常规Western blot法来检测重组腺病毒疫苗插入基因表达产物,并用于该疫苗产品的质量控制。

