不同剂量阿帕替尼联合肝动脉化疗栓塞术对原发性肝癌术后淋巴细胞亚群和肝功能的影响
何行昌,赵杰
商丘市第一人民医院胃肠肝胆外科,商丘 476000
原发性肝癌(hepatocellular carcinoma,HCC)是一种恶性程度很高的恶性肿瘤,指肝细胞或肝内胆管细胞发生病变,具有较高的发病率和死亡率。因早期发病较为隐匿,大多患者在确诊时就已发展至中晚期,使得治疗难度大大增加[1-2]。目前,肝切除术是HCC患者的首选治疗方法,但仅靠手术难以达到完全根治效果,故术后往往给予化疗,其中以经动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)最为常见。但是,TACE并无法使肿瘤细胞达到病理学上的完全坏死,且反复治疗还会导致肿瘤细胞对化疗药物产生耐药性,并影响患者肝功能[3-4]。因此,在进行TACE的同时还需辅以药物联合治疗。阿帕替尼是一种小分子血管内皮生长因子受体2抑制剂,其可阻断血管内皮细胞的迁移,降低肿瘤内血管密度,从而抑制肿瘤生长,同时还可增加肿瘤细胞对化疗的敏感性[5-6]。然而,很多患者会因为阿帕替尼的药物不良反应而中断治疗,故如何选择阿帕替尼的最佳剂量以达到高效低毒十分关键。孙志强等[7]将125、250mg和500mg阿帕替尼用于经肝动脉化疗栓塞术治疗的中晚期肝癌患者中,结果显示250mg阿帕替尼效果最佳,500mg不良反应较大。顾杰等[8]将250mg阿帕替尼联合TACE用于HCC患者,后续又根据患者情况将阿帕替尼剂量调整为125mg,结果其临床疗效良好。张益琴等[9]研究显示,针对卡瑞丽珠单抗所致实体肿瘤患者出现反应性毛细血管增生症,阿帕替尼125mg相比于250mg具有更好的安全性,且疗效较好。根据以上研究可以看出,关于阿帕替尼剂量的选择仍有争议。因此,本研究旨在分析125mg和250mg 2个剂量的阿帕替尼联合TACE对HCC术后患者淋巴细胞亚群和肝功能的影响,以期为临床选择患者治疗剂量提供参考。
1 资料与方法
1.1 一般资料
选取本院2021年2月~2022年2月收治的行TACE的HCC患者98例作为研究对象。采用随机数字表法分为A组和B组,每组49例。A组:男性29例,女性20例;年龄37~68岁,平均年龄(56.24±7.25)岁。B组:男性33例,女性16例;年龄34~70岁,平均年龄(57.12±8.01)岁。两组患者性别、年龄等一般资料比较无统计学差异(P>0.05),具有可比性。本研究经本院伦理委员会批准(伦理批件号sqsdyyy20201159B)。本研究患者及家属知情并签署知情同意书。
纳入标准:①符合《原发性肝癌诊疗规范》[10](2022年版)中的诊断标准,并经肝组织检查确诊者。②行肿瘤根治术者。③18~70岁者。④BCLC分期[11]B期或C期者。⑤预计生存期>3个月者。
排除标准:①合并器质性疾病者。②合并其他恶性肿瘤者。③对化疗不耐受者。④合并免疫系统疾病者。⑤近1个月服用过影响肝功能的药物者。
1.2 治疗方法
所有患者均行肿瘤切除术,术后2个月行TACE,即行右侧股动脉穿刺置管,造影后将导管超选择送至肝固有动脉,灌入栓塞采用注射用洛铂[海南长安国际制药有限公司,国药准字H20080359,规格10mg(以无水物计)]50mg和注射用雷替曲塞(南京正大天晴制药有限公司,国药准字H20090325,规格2mg)4mg。TACE治疗后4~6周复查计算机断层扫描(CT)、磁共振成像(MRI)、肿瘤标志物等,根据复查结果决定是否需要再次行TACE治疗。化疗后5天,A组口服甲磺酸阿帕替尼片[江苏恒瑞医药股份有限公司,国药准字H20140103,规格按阿帕替尼(C24H23N5O)计:0.25g]250mg,qd;B组口服甲磺酸阿帕替尼片125mg,qd。两组均服药至疾病进展或患者不耐受。
1.3 观察指标
1.3.1 T淋巴细胞亚群
治疗前及治疗3个月后,采用CytoFLEX LX流式细胞仪(贝克曼库尔特有限公司)收集患者治疗前后空腹静脉血检测T淋巴细胞亚群,即CD3+、CD4+和CD8+水平,并计算CD4+/CD8+比值。
1.3.2 血清肿瘤标志物
治疗前及治疗3个月后,采用ADVIA Centaur XP全自动化学发光免疫分析仪(西门子公司)测定血清中甲胎蛋白(alpha-fetoprotein,AFP);采用酶联免疫吸附法测定磷脂酰肌醇蛋白聚糖-3(glypican-3,GPC3),试剂盒购自生工生物(上海)股份有限公司。
1.3.3 肝功能
治疗前及治疗3个月后,采用AU5800全自动生化仪(贝克曼库尔特有限公司)测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBiL)。
1.3.4 临床疗效
治疗3个月后,参照《实体瘤疗效评价标准的研究进展》[12]评估临床疗效:①完全缓解:肿瘤病灶消失时间超过1个月。②部分缓解:病灶缩小体积达50%,时间持续至少1个月。③病变稳定:病灶缩小不超过50%,增大不超过25%,且无新病灶出现。④病变进展:病灶无减少,病灶体积增加超过25%,或有新病灶出现。客观缓解率(%)=(完全缓解+部分缓解病例数)/总病例数×100%;疾病控制率(%)=(完全缓解+部分缓解+病变进展病例数)/总病例数×100%。
1.3.5 不良反应
参考不良事件通用术语标准(CTCAE v4.0)[13]判定两组患者的不良反应发生情况,如高血压、恶心呕吐、乏力、腹泻、手足反应等。分级标准为1~4级,级别越高,表示不良反应越严重。
1.4 统计学分析
采用SPSS 22.0软件进行数据统计学分析。计量资料以x±s表示,组间用独立样本t检验,组内用配对样本t检验;计数资料以n(%)表示,采用χ2检验进行比较。P<0.05为具有统计学差异。
2 结果
2.1 两组患者基线资料比较
治疗前,两组患者Child-Pugh分级、BCLC分期、病灶数量、TACE治疗次数等基线资料比较无统计学差异。见表1。

表1 基线资料比较 n=49
2.2 治疗前后两组患者T淋巴细胞亚群比较
治疗前,两组患者两组CD3+、CD4+、CD8+水平和CD4+/CD8+比较无统计学差异。治疗3个月后,两组患者CD3+、CD4+水平和CD4+/CD8+比值均升高(P<0.05),CD8+降低(P<0.05);且与B组相比,A组CD3+、CD4+、CD4+/CD8+比值更高(P<0.05),CD8+更低(P<0.05)。见表2。

表2 两组患者T淋巴细胞亚群比较 n=49,x±s
2.3 治疗前后两组患者血清肿瘤标志物比较
治疗前,两组患者血清AFP和GPC3水平比较无统计学差异。治疗3个月后,两组患者血清AFP和GPC3水平均降低(P<0.05);与B组相比,A组血清AFP和GPC3水平更低(P<0.05)。见表3。

表3 两组患者血清肿瘤标志物比较 n=49,x±s,ng/ml
2.4 治疗前后两组患者肝功能比较
治疗前,两组患者ALT、AST和TBiL水平比较无统计学差异。治疗后,两组患者ALT、AST和TBiL水平均降低(P<0.05);且与B组相比,A组ALT、AST和TBiL水平更低(P<0.05)。见表4。

表4 两组患者肝功能指标比较 n=49,x±s
2.5 两组患者临床疗效比较
治疗3个月后,A组客观缓解率(71.43%)高于B组(51.02%,P<0.05);且A组疾病控制率(85.71%)高于B组(67.35%,P<0.05)。见表5。

表5 两组患者临床疗效比较 n=49,n(%)
2.6 两组患者不良反应发生情况比较
两组患者高血压、恶心呕吐、乏力、腹泻、手足反应等不良反应比较无统计学差异(P>0.05)。见表6。
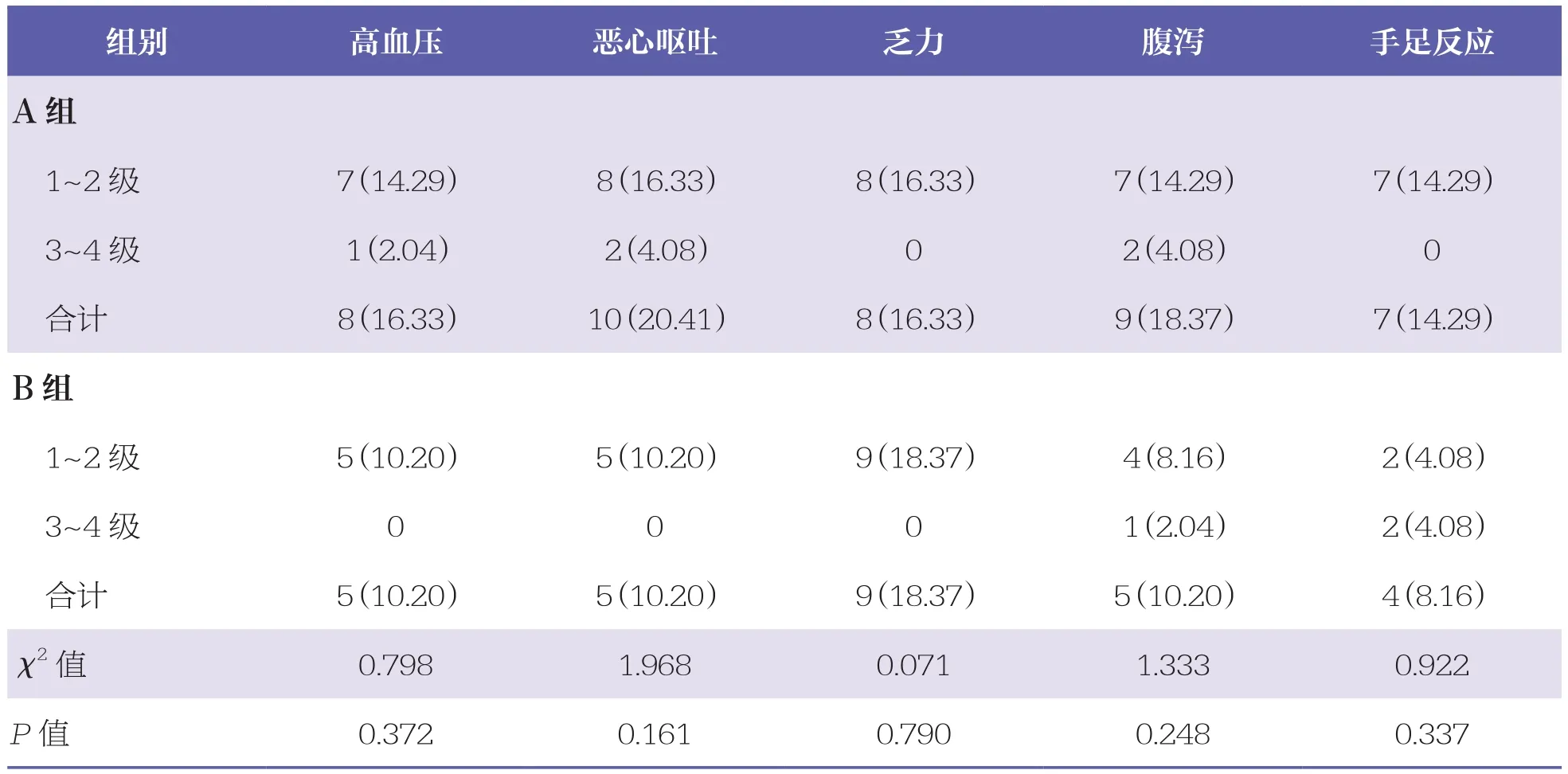
表6 两组患者不良反应发生情况比较 n=49,n(%)
3 讨论
TACE是治疗中晚期HCC患者的一种有效方法,患者5年生存率可达8%以上,有效率可达18%,其主要是通过介入的方法,使用导管将肿瘤化疗药物注入供血动脉,栓塞肿瘤血管,从而发挥抗肿瘤作用[15]。但是,因此治疗方法需反复进行,可对患者的肝功能产生一定损伤,不利于患者预后。此外,如果栓塞治疗不彻底,则无法完全阻断门静脉的血液供应,不仅无法使肿瘤彻底坏死,而且容易形成侧支循环,导致较高的复发率[16-17]。因此,HCC的治疗需在TACE的基础上联合其他治疗方法。阿帕替尼是酪氨酸激酶抑制剂,可竞争性地抑制血管内皮生长因子与其受体-2的ATP的结合位点,抑制肿瘤新生血管形成和细胞增殖,发挥抗肿瘤作用[18]。但是,阿帕替尼有一定的不良反应,故阿帕替尼的剂量选择至关重要。
本研究旨在分析不同剂量阿帕替尼对HCC患者的影响。A组客观缓解率和疾病控制率均高于B组,提示250mg阿帕替尼对提升HCC患者的临床疗效更佳。T淋巴细胞亚群常被用于评估机体免疫功能,其参与抗肿瘤、抗细胞内感染等各个环节。其中,CD3+T细胞主要负责信号传导;CD4+T细胞可辅助其他免疫细胞进行分化和免疫应答;CD8+T细胞则可特异性地杀伤靶细胞,攻击肿瘤细胞;CD4+/CD8+比值可用于衡量细胞免疫反应的平衡[19-20]。陈玉昌等[21]的研究将阿帕替尼用于治疗晚期胃癌患者中,结果表明其可改善患者的免疫功能。本研究中,A组CD3+、CD4+水平和CD4+/CD8+比值均高于B组,CD8+低于B组,提示250mg阿帕替尼改善患者T淋巴细胞亚群的效果更佳。
AFP是在胎儿肝细胞中合成的一种糖蛋白,临床有80%肝癌患者血清AFP会升高,其可抑制肿瘤坏死因子分泌,且其水平与病情严重程度呈正比。GPC3可用于反映肿瘤细胞对肝脏的侵袭情况,是近年发现的一种高灵敏度和高特异度的肿瘤标志物[22-23]。本研究中,A组血清AFP和GPC3水平均低于B组,提示250mg阿帕替尼对下调患者血清肿瘤标志物水平效果更佳。本研究中,A组ALT、AST和TBiL水平均低于B组,提示250mg阿帕替尼对改善患者肝功能指标效果更佳。吴彦彦[24]的研究显示,阿帕替尼治疗中晚期HCC患者,可调控新生血管生成、抑制肿瘤细胞增殖、缩小肝脏肿瘤直径,从而降低肝功能指标水平。上述研究结果表明,250mg阿帕替尼联合化疗的整体效果优于125mg剂量组,提示250mg剂量组患者获益更多。此外,本研究结果显示,两组患者不良反应无统计学差异,提示药物剂量增至250mg并未增加药物不良反应。本研究也存在一定的局限性,如样本量较小、病例均为本院患者,后续我们会进一步增加样本量、开展多中心研究以证实本结论。
综上所述,与阿帕替尼125mg相比,250mg可改善T淋巴细胞亚群、下调血清肿瘤标志物水平、改善肝功能、提升患者临床疗效,且不良反应比较无统计学差异,值得临床考虑。

