有机添加物对软枣猕猴桃组织培养的影响
王仕英 陈 煣
有机添加物对软枣猕猴桃组织培养的影响
王仕英陈煣
(阿坝师范学院四川阿坝623000)
文章以软枣猕猴桃茎尖为外植体,MS+6-BA 2.0 mg/L+IBA 0.1 mg/L为芽分化诱导培养基,MS+6-BA 2.0 mg/L+IBA 0.2 mg/L为增殖培养基,1/2MS+IBA 0.4 mg/L为生根培养基,分别添加不同浓度香蕉泥或椰汁,以不添加有机添加物为空白对照,探究香蕉泥和椰汁对软枣猕猴桃组织培养的影响。结果表明:软枣猕猴桃茎尖组织培养中,添加有机添加物能够有效促进植物组织芽分化、增殖及生根;添加100 g/L香蕉泥更有利于诱导芽分化,添加150 g/L香蕉泥或150 mL/L椰汁更有利于增殖,添加100 g/L香蕉泥更有利于生根及根系生长。
软枣猕猴桃;组织培养;香蕉泥;椰汁
软枣猕猴桃又称软枣子、藤梨等,为猕猴桃科猕猴桃属多年生藤本植物,在我国南北方均可栽培,既可作为果蔬资源,又可用于园林庭院绿化。研究表明,软枣猕猴桃为药食两用水果,不仅含有丰富的维生素、蛋白质、矿物质等营养成分,还含有蒽醌类、多糖类及多酚类等药理活性成分,具有抗炎、抗氧化活性[1-4]。随着人们生活水平的提高和对天然健康食品的追求,由软枣猕猴桃开发出的产品越来越多,如软枣猕猴桃果酱、饮料、果脯等[5]。由此可见,软枣猕猴桃的市场前景较为广阔。
依赖于其适应性强的特点,目前我国已开始规模化种植软枣猕猴桃,特别是在东北三省。软枣猕猴桃的繁殖方式以播种、嫁接及扦插为主,由于其繁殖受季节、气候等因素的影响较大,因此各国利用组织培养方式进行繁殖育种由来已久[6]。在我国,软枣猕猴桃组织培养研究可以追溯到1991年,张喜春等以软枣猕猴桃叶片为试材,成功诱导出适合于建立悬浮细胞系的愈伤组织[7]。1992年,胡桂珍等以软枣猕猴桃的胚为组织培养外植体,成功获得再生植株[8];2008年,郑小华等通过对软枣猕猴桃茎、叶离体培养的探索,极大地促进育苗效率[9-10];2018年,李强通过对“龙成2号”软枣猕猴桃组培体系的探索,得到了最佳诱导、增殖和生根培养基配方[11]。
目前对于软枣猕猴桃的组织培养,完全依赖化学添加剂,但在其他物种中成熟的实践表明,相比化学添加剂,简便易得的有机添加物同样能够增强植物组织培养中外植体的生长、分化效应,促进植物组织增殖及存活。目前植物组织培养中较常使用的有机添加物有椰乳、香蕉汁、苹果汁、番茄汁、胡萝卜汁、马铃薯汁等,已广泛应用于蝴蝶兰、铁皮石斛等珍贵物种的组织培养中[12-13]。本研究选取椰汁和香蕉泥作为有机添加物,探索其在组织培养的不同阶段对软枣猕猴桃生长的影响,以期找到一种适合软枣猕猴桃组织培养的有机添加物,加快软枣猕猴桃组织培养速度,为软枣猕猴桃种苗规模化工厂化繁殖提供理论和实践依据。
1 材料与方法
1.1 试验材料
软枣猕猴桃植株选用自花授粉品种“库库瓦”,购自虹越官方店,2020年3月选择当年生带芽幼嫩茎条作为试验材料。
1.2 外植体消毒
试验前取长势相同的带腋芽幼嫩茎段,放置于烧杯中,并用纱布封口,置于自来水下流水冲洗2 h,冲洗完毕后转移至提前消毒的超净工作台,用75%乙醇消毒10 s,无菌水清洗后置于无菌滤纸上吸干水分,继而置于三角瓶中用0.15%氯化汞溶液浸泡7 min~8 min,其间不断摇晃以使外植体充分接触氯化汞,保证消毒效果。最后用无菌水冲洗4次~5次,将消毒后的外植体置于灭菌的培养皿中滤纸上,切成长约2 cm的带芽茎段,便于之后接种于待测培养基中。
1.3 供试培养基配制
通过查阅资料,芽分化诱导培养基选择MS+6-BA2.0 mg/L+IBA 0.1 mg/L,增殖培养基选择MS+6-BA 2.0 mg/L+IBA 0.2 mg/L,生根培养基选择1/2MS+IBA 0.4 mg/L[11]。选择椰汁及香蕉泥作为有机添加物,其中香蕉泥通过市售香蕉去皮匀浆过滤制得。将两种有机添加物分别添加至3种培养基中,空白对照(CK)为不添加两种有添加机物的培养基,各处理组有机添加物添加浓度如表1所示。培养基配制完成后调节pH至6,121 ℃高压蒸汽灭菌锅灭菌15 min,静置冷却后用于外植体接种。
表1培养基中有机添加物的添加浓度设置
编号有机添加物添加浓度/mL/L编号有机添加物添加浓度/g/L A1椰汁50B1香蕉泥50 A2椰汁100B2香蕉泥100 A3椰汁150B3香蕉泥150 A4椰汁200B4香蕉泥200 CK无————
1.4 诱导培养
将经过消毒的外植体在超净工作台中于无菌条件下接种于含有不同有机添加物的芽分化诱导培养基中,每瓶接种5个外植体,每个处理接种6瓶共计30个外植体,于光照强度2 000 lx,光照时间14 h/d,温度(25±1)℃下培养25 d后观察腋芽萌发情况,统计腋芽萌发及褐化情况,筛选最适宜的芽分化诱导培养基。
1.5 增殖培养
将芽分化诱导培养基上生长至一定长度的腋芽从茎端基部剪下,剪成1.5 cm左右一芽一段,转接于含有不同有机添加物的增殖培养基中,每瓶接种3个~4个芽段,每个处理重复3次,每个重复接种3瓶,30 d后观察幼苗生长情况,筛选最适宜的增殖培养基。
1.6 生根培养
将增殖培养基上生长健壮的幼嫩无根苗转移至添加不同有机添加物的生根培养基中,每瓶接种无根苗2个,每个处理重复3次,每个重复接种3瓶,25 d后观察生根情况。
1.7 数据分析与处理
采用Excel、Origin 8.0对试验数据进行分析处理及作图。
2 结果与分析
2.1 不同有机添加物对软枣猕猴桃组培芽分化诱导的影响
添加不同有机添加物的芽分化诱导培养基上外植体褐化数及分化数如图1所示。
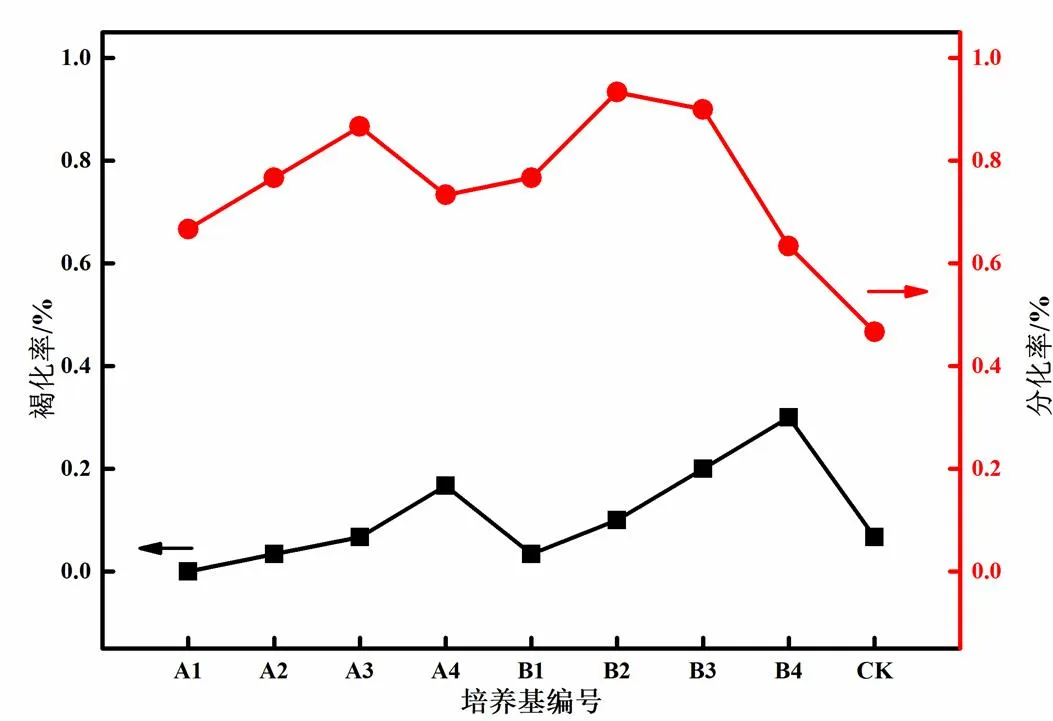
图1 不同芽分化诱导培养基上外植体褐化率及分化率
外植体在芽分化诱导培养基上培养第10天时腋芽开始萌动,由图1可以看出,所有芽分化诱导培养基都能在一定程度上诱导腋芽分化,但诱导效果存在差异。A3、B2、B3培养基诱导效果显著高于其他组,其中B2诱导分化率最高,达到93.3%。不同种类及添加浓度的有机添加物对芽分化诱导过程中褐化率的影响同样存在差异,添加200 g/L香蕉泥的B4培养基褐化率最高,其次为B3、A4培养基,其他组培养基对芽分化诱导过程中的褐化率没有显著影响,分析原因可能为培养基中含量过高的糖类等营养成分提高了多酚氧化酶活性,导致褐化率增大。
2.2 不同有机添加物对腋芽增殖及生长情况的影响
添加不同有机添加物的增殖培养基上腋芽增殖及生长情况如图2、图3、图4所示。

图2 不同增殖培养基中组培苗平均株高和叶片数

图3 不同增殖培养基中组培苗的增殖系数

图4 软枣猕猴桃组培苗增殖情况
由图2可知,不同有机添加物均可在一定程度上促进腋芽增殖和生长,与CK组相比,添加香蕉泥或椰汁的增殖培养基上生长的组培苗在株高和叶片数上有显著优势。由图4可知,A3、B3培养基上生长的组培苗,其株高、叶片数以及生长旺盛程度要明显优于CK组,说明香蕉泥和椰汁所含有机营养成分及矿物质等均可被软枣猕猴桃组培苗有效吸收。图3为不同增殖培养基中组培苗的增殖系数,可知添加有机添加物的增殖培养基的增殖系数显著高于CK组。其中添加150 g/L香蕉泥的B3组增殖系数最高,达到4.89,其次为添加150 mL/L椰汁的A3组,增殖系数为4.79,与其他组有显著差异,且此两组的平均株高及叶片数均显著高于其他组。综合分析A3、B3组,添加150 g/L香蕉泥或150 mL/L椰汁促进腋芽增殖的效果最好,两组的平均株高、平均叶片数和增殖系数没有显著差异,说明在适宜添加浓度下,香蕉泥与椰汁对软枣猕猴桃组培苗营养成分的供应是相似的,但随着有机添加物添加浓度继续增大,组培苗生长情况和增殖系数反而急剧下降,可能是由于养分过剩导致盐害,从而影响组培苗生长。
2.3 不同有机添加物对组培苗生根情况的影响
添加不同有机添加物的生根培养基上组培苗生根情况如图5、图6所示。

图5 不同生根培养基中组培苗平均根长和根数

图6 软枣猕猴桃组培苗生根情况
由图5可知,添加不同种类及含量有机添加物的生根培养基中组培苗的生根效果明显优于对照组,其中表现较好的两组培养基为A2和B2,特别是B2培养基,组培苗平均根长可达到1.81 cm,平均根数可达到5.32根。A2培养基平均根长为1.70 cm,平均根数为4.59,生根率达到100%。并且包括CK在内,所有生根培养基在不同时间内均可使组培苗生根。图6为将组培苗转移至生根培养基后第15天的生根情况,由图6可知,未添加任何有机添加物的对照组在第15天时只有部分须根及气生根长出,而添加香蕉泥或椰汁的试验组第15天时均有粗壮的主根长出,特别是添加100 g/L香蕉泥的B2组,第15天时根系生长已初步完善,主根和须根的根长以及数量均高于其他组。
3 讨论与结论
本研究以软枣猕猴桃品种“库库瓦”的幼嫩茎段为外植体,研究有机添加物香蕉泥和椰汁对软枣猕猴桃组织培养不同阶段的影响。试验选择不同添加浓度的两种有机添加物,通过统计在腋芽诱导阶段的诱导分化率及褐化率,增殖阶段的生长情况和增殖系数以及生根情况等相关数据并进行分析,综合表明有机添加物在一定程度上可以促进植物组织培养过程中的芽分化、增殖和生根。这与李扬等在有机添加物对马铃薯组培苗生长中的影响研究中所得出的结论一致[14]。在芽分化诱导阶段,随着培养基中两种有机添加物含量升高,外植体褐化率有升高趋势,这可能是由于培养基中含量过高的糖等营养成分会加剧褐化[15]。同样的抑制作用也体现在腋芽增殖及生根阶段。从试验结果可知,不同添加浓度的两种有机添加物均对组培苗增殖及生根均有促进作用,但超过适宜浓度后,随有机添加物添加浓度的持续增加,其促进作用会降低,说明组织培养过程中组培苗对营养物质的吸收是有限度的,过量添加有机物并不能持续促进其生长。
该研究结果表明,最适宜软枣猕猴桃外植体芽分化诱导的添加有机添加物培养基为MS+6-BA 2.0 mg/L+IBA0.1 mg/L+香蕉泥100 g/L,最适宜的增殖培养基为MS+6-BA 2.0 mg/L+IBA 0.2 mg/L+香蕉泥150 g/L,或MS+6-BA2.0 mg/L+IBA 0.2 mg/L+椰汁150 mL/L,最适宜的生根培养基为1/2MS+IBA 0.4 mg/L+香蕉泥100 g/L。香蕉泥、椰汁等均为易得的有机添加物,其中含有复合营养成分,如无机物、有机物、生长离子等,任何一种成分都可能是影响植物组织培养效果的关键因素,鉴于其价格低廉、易得的特点,寻找合适高效的组织培养有机添加物或其组合,有利于提高生产效率,降低组织培养育苗成本。
[1]孙宏莱,时得友,李丽丽,等.响应面法优化软枣猕猴桃枝条总三萜提取工艺及其体外抗炎活性分析[J].食品工业科技,2021,42(15):189-197.
[2]刘旸旸.软枣猕猴桃中生物碱的提取纯化及生物活性研究[D].沈阳:沈阳农业大学,2016.
[3]高原,郝悦君,安晓丽,等.软枣猕猴桃不定根不同溶剂提取物抗氧化活性比较分析[J].延边大学农学学报,2019,41(1):8-12.
[4]田佳鑫.软枣猕猴桃茎皮中槲皮素的提取纯化及抗氧化作用研究[D].沈阳:沈阳农业大学,2016.
[5]孙宏莱,毕云杰,时得友,等.软枣猕猴桃果品加工与贮藏保鲜研究进展[J].食品与发酵工业,2020,46(11):315-320.
[6]HAMEG R,ARTETA T A,LANDIN M,et al.Modeling and optimizing culture medium mineral composition forpropagation of[J].Frontiers in Plant Science,2020(11):554905.
[7]张喜春,吴绛云.软枣猕猴桃悬浮细胞系的建立及其影响因素[J].植物研究,1991(3):77-83.
[8]胡桂珍,杜令阁,岳沛华,等.软枣猕猴桃未成熟杂种培养再生植株[J].特产研究,1992(4):24-25.
[9]郑小华.软枣猕猴桃茎、叶离体培养与植株再生的研究[D].成都:四川农业大学,2008.
[10]郑小华,廖明安,李明章,等.不同培养条件对软枣猕猴桃试管苗玻璃化的影响[J].资源开发与市场,2008(5):394-396.
[11]李强.软枣猕猴桃组培快繁体系的建立[J].辽宁林业科技,2018(4):34-35,71.
[12]李汝婷,宫子惠,张英杰,等.不同有机添加物对蝴蝶兰原球茎增殖的影响[J].农业科学研究,2020,41(4):90-92.
[13]胡佳丽,戚正华,马美兰,等.铁皮石斛种子组织培养条件的优化[J].浙江农业学报,2015,27(8):1399-1402.
[14]李扬,凌永胜,林金秀.不同有机添加物对马铃薯组培苗生长的影响[J].福建热作科技,2020,45(2):5-7.
[15]张明文,陈力耕.银杏组织培养中控制褐化的研究[J].中国南方果蔬,2003,32(3):51-52.
10.3969/j.issn.2095-1205.2022.09.03
S663.4
A
2095-1205(2022)09-07-04
阿坝师范学院校级规划项目(ASB19-16);四川省教育厅2021—2023年高等教育人才培养质量和教学改革项目(JG2021- 118);阿坝师范学院2019年实践教学类综合改革项目(201904028)
王仕英(1989- ),女,汉族,山东临沂人,硕士研究生,研究方向为植物组织培养。

