超声激励bFGF纳米微泡靶向治疗对裸鼠瘢痕疙瘩及PTEN/PI3K/Akt通路的影响
陈珂 陈翠兰 周雪萍 任斯 黄娟
1武汉市第三医院超声科(武汉 430060);2武汉市肺科医院功能科(武汉 430030)
瘢痕疙瘩是一种皮肤纤维化疾病,其形成主要因细胞外基质的过度产生,而导致超出原始伤口边缘无组织的纤维增殖性胶原反应引起[1]。临床上主要通过手术切除、放射、冷冻、激光等方式对瘢痕疙瘩进行治疗[2],然而并不能彻底根除瘢痕疙瘩,因此急需开发一种安全、有效的瘢痕疙瘩治疗方法。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)可促进血管内皮细胞和平滑肌细胞的增殖,刺激血管再生[3]。研究表明bFGF 能够加速创面愈合,减轻瘢痕,在瘢痕疙瘩治疗中具有较好的应用前景[4-5]。而纳米粒是一种新型药物载体,不仅能够增加药物稳定性,还能够穿透组织,实现药物靶部位的缓释[6]。超声微泡是一种声学敏感空心微泡,低频超声能诱导微泡空化效应,增加细胞膜通透性,实现药物的缓释,还可以实现纳米粒在靶组织或靶器官的靶向释药[7]。因此,纳米超声微泡可作为bFGF 基因的靶向系统,充分发挥bFGF 在临床治疗中的作用。研究表明第10 号染色体同源缺失性磷酸酶-张力蛋白基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)/3-磷酸肌醇激酶(phosphatidylinositol 3-kinase,PI3K)/丝氨酸/苏氨酸激酶(protein kinase B,Akt)信号通路与瘢痕疙瘩的发生有关[8]。但是,阐明超声激励bFGF 纳米微泡对瘢痕疙瘩的治疗作用鲜有报道,其对PTEN/PI3K/Akt 通路的影响。基于此,本研究首次通过构建裸鼠瘢痕疙瘩模型,并进行超声激励bFGF纳米微泡靶向治疗,以期为瘢痕疙瘩的治疗提供新思路。
1 材料与方法
1.1 实验动物 SPF级雌性BALB/c裸鼠72只(16 ~18 g,5 ~6 周龄),购于广东省医学实验动物中心,生产许可证号SCXK(粤)2018-0002。裸鼠饲养于通风良好的SPF 环境(温度22 ~25 ℃,相对湿度50%~70%),适应性饲养1 周。该实验经伦理道德委员会批准(批号:2021-0302)。
1.2 药品及试剂 人瘢痕疙瘩成纤维细胞(human keloid fibroblasts,HKF),bFGF 纳米微泡,均为实验室前期制备;胎牛血清,胰蛋白酶,DMEM 培养液,美国HyClone 公司;肿瘤坏死因子α(TNF-α)、转化生长因子-β(TGF-β)酶联免疫吸附(ELISA)试剂盒,武汉云克隆生物科技有限公司;兔抗鼠半胱氨酸天冬氨酸蛋白酶3(caspase-3)、α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白(collagenⅠ)、PTEN、PI3K、Akt、GAPDH 一抗,山羊抗兔IgG H&L(ab150077),英国abcam 公司;苏木精-伊红(HE)染色试剂盒(C0105M)、一步法原位末端标记(TUNEL)细胞凋亡检测试剂盒(C1086),上海碧云天生物技术有限公司。DM2500 荧光显微镜,德国LEICA 公 司;Multiskan FC酶标仪,美国Thermo Fisher 公司;Gel-Doc 凝胶成像系统,美国Bio-Rad公司。
1.3 细胞培养 冻存的HKF 常规复苏,培养于含10 %胎牛血清的DMEM 培养基中,37 ℃,5% CO2培养箱中培养,每3 d 换一次培养液,细胞融合度达到90%时,进行传代。
1.4 细胞处理与接种 收集上述对数生长期的HKF,PBS 冲洗,胰蛋白酶消化,制备细胞悬液,离心弃上清,加DMEM 培养基制备单细胞悬液,计数,离心,弃上清,加Matrigel 胶,调整细胞浓度为5.0 × 107个/mL,于72 只裸鼠右侧腋窝皮下接种,每只接种0.1 mL。隔日观察裸鼠瘢痕疙瘩生长情况,记录裸鼠瘢痕疙瘩体积和体质量的变化。
1.5 动物分组及给药 裸鼠瘢痕疙瘩大小约为100 ~200 mm3时给药,将裸鼠随机分为6 组,对照组,bFGF 水溶液组,bFGF 纳米微泡组,超声空化组,超声+bFGF 水溶液组,超声+bFGF 纳米微泡组,每组12 只。bFGF 水溶液、bFGF 纳米微泡均为本实验室自行配置。bFGF 水溶液组、超声+bFGF水溶液组,给予裸鼠1 mL 含0.2 mg bFGF 生理盐水注射,超声空化组注射1 mL 脂质微泡溶液,bFGF纳米微泡组、超声+bFGF 纳米微泡组,给予1 mL 含0.2 mg bFGF 的纳米微泡溶液注射。注射方式为瘢痕疙瘩内局部注射,隔日给药,共10 次。根据本实验室前期摸索实验确定超声注射条件,超声空化组、超声+bFGF 微泡组、超声+bFGF 纳米微泡组给药后即刻在瘢痕疙瘩皮肤表面涂抹超声耦合剂并进行超声照射(频率3 MHz,功率2 W/cm2,刺激周期20%,超声60 s)。隔日观察裸鼠生存状态和瘢痕疙瘩生长状况,记录瘢痕疙瘩体积和重量,绘制瘢痕疙瘩体积增长曲线。
1.6 ELISA 法检测裸鼠血清炎症因子水平 末次给药结束后次日,腹主动脉取血1 mL,ELISA 法检测裸鼠血清TNF-α、TGF-β 水平,实验严格按照试剂盒说明书操作。
1.7 瘢痕疙瘩组织学和细胞凋亡观察 取血结束,尾椎静脉注射法处死裸鼠,剥离瘢痕疙瘩,每组随机选取6 只裸鼠瘢痕疙瘩,4 %中性甲醛固定,石蜡包埋,切片,HE 染色,显微镜下观察裸鼠瘢痕疙瘩组织形态;TUNEL 细胞凋亡检测试剂盒检测瘢痕疙瘩组织中细胞凋亡情况,严格按照试剂盒说明书进行实验操作,随机选取5 视野,荧光显微镜下观察计数凋亡细胞(绿色荧光标记)数目。
1.8 蛋白免疫印迹(Western blot)法检测裸鼠瘢痕疙瘩中蛋白表达 取剩余6 只裸鼠瘢痕疙瘩组织,蛋白提取试剂盒提取总蛋白,BCA 蛋白试剂盒检测蛋白浓度,严格按照试剂盒说明书进行实验操作。之后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后,转膜,封闭,分别加入兔抗鼠caspase-3、α-SMA、collagen I、PTEN、PI3K、Akt、GAPDH 一抗稀释液,4 ℃孵育过夜,TBST 洗膜,加入辣根过氧化物酶标记的山羊抗兔二抗稀释液(1∶1 000 稀释),室温孵育1 h,TBST 洗膜。蛋白凝胶成像系统成像,Image Pro Plus 6.0 图像软件分析蛋白条带灰度值。
1.9 统计学方法 采用SPSS 21.0 进行数据统计分析,计量资料采用平均数±标准差描述,多组间比较采用单因素方差分析,组间比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 bFGF 纳米微泡的理化性质测定 bFGF 纳米粒呈标准的圆球形,平均粒径为(126.54±1.45)nm,粒径的多分散指数(Polydispersion index,PI)为0.087,说明其分布均匀;Zeta 电位值的绝对值为15.78 mV,说明其稳定性好、不容易聚集。
2.2 各组裸鼠瘢痕疙瘩体积和重量比较 各组裸鼠均生活状态良好,活动、饮食、大小便正常,实验过程中均存活,可初步评估,bFGF 纳米微泡未对裸鼠的重要器官产生病理性危害,较为安全。对照组和超声空化组瘢痕疙瘩体积随时间的延长不断增大(P<0.05),bFGF 水溶液组和bFGF 纳米微泡组瘢痕疙瘩体积随时间的延长变化不大(P>0.05),超声+bFGF 水溶液组、超声+bFGF 纳米微泡组瘢痕疙瘩体积随时间的延长不断缩小(P<0.05,图1)。治疗结束后,与对照组比较,超声空化组裸鼠瘢痕疙瘩体积和重量比较差异无统计学意义(P>0.05),各bFGF 处理组裸鼠瘢痕疙瘩体积和重量均显著降低(P<0.05);与bFGF 水溶液组、bFGF 纳米微泡组比较,超声+bFGF 水溶液组、超声+bFGF 纳米微泡组裸鼠瘢痕疙瘩体积和重量均显著降低,超声+bFGF 纳米微泡组裸鼠瘢痕疙瘩体积和重量低于超声+bFGF 水溶液组(P<0.05,图2)。

图1 各组裸鼠瘢痕疙瘩生长曲线图Fig.1 The growth curve of keloids in nude mice in each group
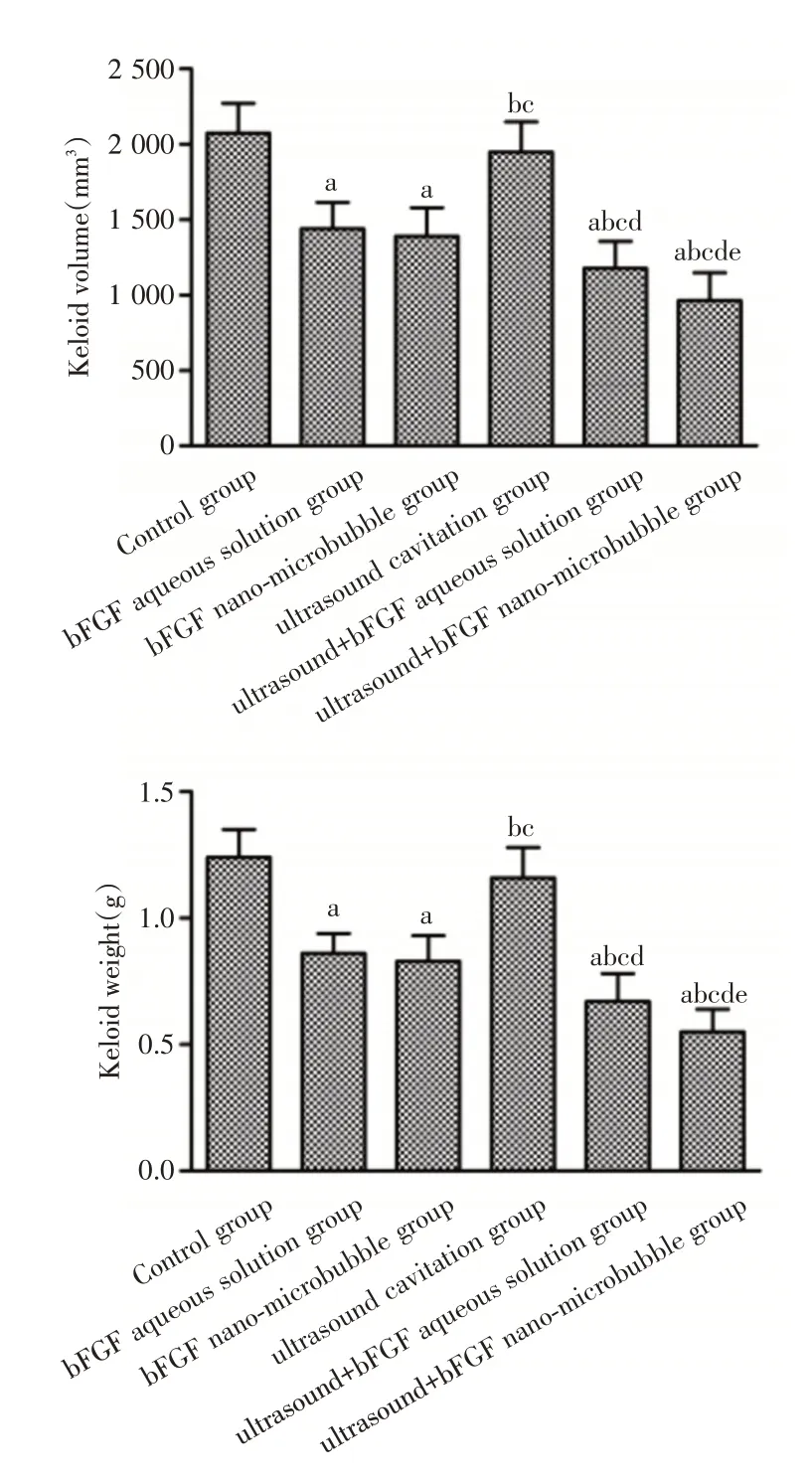
图2 各组裸鼠瘢痕疙瘩体积和重量比较Fig.2 Comparison of the volume and weight of keloids in each group of nude mice
2.3 各组裸鼠瘢痕疙瘩组织形态对比 HE 染色结果表明,对照组、超声空化组裸鼠瘢痕疙瘩组织中,胶原结构未见明显改变;bFGF 水溶液组、bFGF纳米微泡组裸鼠瘢痕疙瘩组织表皮萎缩明显,胶原结构松散;超声+bFGF 水溶液组、超声+bFGF 纳米微泡组表皮仅有少部分残留,胶原结构破坏,可见有较多血管形成(图3)。

图3 HE 染色检测裸鼠瘢痕疙瘩组织形态(×200)Fig.3 HE staining of keloid tissue morphology in nude mice(×200)
2.4 各组裸鼠瘢痕疙瘩组织细胞凋亡比较 与对照组比较,超声空化组裸鼠瘢痕疙瘩细胞凋亡数目、蛋白caspase-3 表达差异无统计学意义(P>0.05);各bFGF 处理组裸鼠瘢痕疙瘩细胞凋亡数目、蛋白caspase-3 表达显著升高(P<0.05);与bFGF 水溶液组、bFGF 纳米微泡组比较,超声+bFGF 水溶液组、超声+bFGF 纳米微泡组细胞凋亡数目、蛋白caspase-3 表达均显著升高,且超声+bFGF 纳米微泡组细胞凋亡数目、蛋白caspase-3 表达显著高于超声+bFGF 水溶液组(P<0.05,图4、5)。

图4 各组裸鼠瘢痕疙瘩组织细胞凋亡比较Fig.4 Comparison of cell apoptosis in keloid tissue of nude mice in each group
2.5 各组裸鼠血清中炎症因子TNF-α、TGF-β 水平比较 与对照组比较,超声空化组裸鼠血清炎症因子TNF-α、TGF-β 水平比较差异无统计学意义(P>0.05);各bFGF 处理组裸鼠血清炎症因子TNF-α、TGF-β 水平显著降低(P<0.05);与bFGF水溶液组、bFGF 纳米微泡组比较,超声+bFGF 水溶液组、超声+bFGF 纳米微泡组血清TNF-α、TGFβ 水平均显著降低,且超声+bFGF 纳米微泡组血清TNF-α、TGF-β 水平显著低于超声+bFGF 水溶液组(P<0.05,图6)。

图5 各组裸鼠瘢痕疙瘩组织caspase-3 表达情况Fig.5 The expression of caspase-3 in keloid tissues of nude mice in each group

图6 各组裸鼠血清中TNF-α、TGF-β 水平比较Fig.6 Comparison of serum TNF-α and TGF-β levels in nude mice in each group
2.6 各组裸鼠瘢痕疙瘩组织中α-SMA、collagen I水平比较 与对照组比较,超声空化组裸鼠瘢痕疙瘩组织中蛋白α-SMA、collagen I 水平差异无统计学意义(P>0.05);各bFGF 处理组裸鼠瘢痕疙瘩组织中蛋白α-SMA、collagen I 水平显著降低(P<0.05);与bFGF 水溶液组、bFGF 纳米微泡组比较,超声+bFGF 水溶液组、超声+bFGF 纳米微泡组蛋白α-SMA、collagen I 水平均显著降低,且超声+bFGF 纳米微泡组蛋白α-SMA、collagen I 水平低于bFGF 水溶液组(P<0.05,图7、8)。

图7 各组瘢痕疙瘩组织中α-SMA、collagenⅠ水平比较Fig.7 Comparison of α-SMA and collagen I levels in keloid tissues of each group

图8 Western blot检测各组瘢痕疙瘩组织中蛋白α-SMA、collagenⅠ表达Fig.8 Western blot detection of protein α-SMA and collagenⅠexpression in keloid tissues of each group
2.7 各组裸鼠瘢痕疙瘩组织中PTEN/PI3K/Akt通路蛋白表达比较 与对照组比较,超声空化组裸鼠瘢痕疙瘩组织中蛋白PTEN、PI3K、p-Akt 水平差异无统计学意义(P>0.05);各bFGF 处理组裸鼠瘢痕疙瘩组织中蛋白PTEN 水平显著升高,PI3K、p-Akt 水平显著降低(P<0.05);与bFGF 水溶液组、bFGF 纳米微泡组比较,超声+bFGF 水溶液组、超声+bFGF 纳米微泡组蛋白PTEN 水平升高,PI3K、p-Akt 水平均显著降低(P<0.05);与超声+bFGF 水溶液组比较,超声+bFGF 纳米微泡组蛋白PTEN水平升高,PI3K、p-Akt 水平显著降低(P<0.05,图9、10)。

图9 各组裸鼠瘢痕疙瘩组织中PTEN/PI3K/Akt 通路蛋白表达比较Fig.9 Comparison of PTEN/PI3K/Akt pathway protein expression in keloid tissues of nude mice in each group

图10 Western blot检测裸鼠瘢痕疙瘩组织中PTEN/PI3K/Akt 通路蛋白表达Fig.10 Western blot detection of PTEN/PI3K/Akt pathway protein expression in keloid tissue of nude mice
3 讨论
瘢痕疙瘩主要表现为瘢痕过度增长超出原损伤界限,向周围正常皮肤组织浸润,被认为是一种良性皮肤肿瘤[9]。瘢痕疙瘩主要组织学特征为成纤维细胞的持续性异常增殖及细胞外基质(ECM)的过度沉淀,胶原沉积是正常伤口愈合的必要部分,然而过度沉积会导致瘢痕疙瘩的形成,胶原合成和降解的不平衡是导致疤痕疙瘩形成的主要原因之一[10]。虽然瘢痕疙瘩不是恶性肿瘤,但是其过度生长而引起的疼痛和高复发率值得关注[11]。抑制成纤维细胞增殖,促进血管新生是瘢痕疙瘩治疗的主要机制,而bFGF 是一种重要的血管形成因子,可促进血管生成[12]。赫佳等[13]研究发现bFGF 对成纤维细胞的生长趋势和增殖活性有明显的促进作用,这在创伤愈合的早期起积极作用,但过量的bFGF 会导致病理性瘢痕的生成。纳米粒广泛应用于药物递送系统,其不仅能够递送蛋白、核酸、多肽等多种类型药物,还可穿透组织实现作用部位药物缓释,使药物作用时间更加持久,增加组织细胞对药物的摄取。低频超声结合微泡靶向技术一方面能够实现纳米粒的靶向施药,另一方面还能够促进靶组织细胞对药物的摄取,从而增加药物疗效[7]。本研究结果表明bFGF 水溶液、bFGF 纳米微泡能够抑制裸鼠瘢痕疙瘩的生长,提示bFGF 可能有助于瘢痕疙瘩的治疗。SHI 等[4]研究表明bFGF 治疗能够降低胶原密度、α-SMA、Ⅰ、Ⅲ型胶原蛋白的表达,促进成纤维细胞的凋亡,而不影响正常的皮肤成纤维细胞。TNF-α 能够将单核细胞和T 细胞募集到损伤部位,是一种重要的促炎因子。TGF-β 能够刺激ECM 的合成和沉淀,抑制胶原酶的产生,是成纤维细胞的趋化因子[14]。α-SMA是成纤维细胞的标志性产物,Ⅰ型胶原蛋白在创口愈合中具有重要作用。本研究结果表明,bFGF 水溶液、bFGF 纳米微泡能够抑制裸鼠炎症反应的发生,抑制胶原的过度沉积,促进瘢痕疙瘩细胞凋亡,提示bFGF 可能通过抑制瘢痕疙瘩胶原沉积,促进瘢痕疙瘩细胞的凋亡,从而抑制瘢痕疙瘩的进展。
微泡既可以作为药物载体,也可以作为基因载体[15]。超声作用于靶向给药部位,不仅能够击碎微泡释放基因或药物,还通过增加细胞膜的通透性,增加药物的递送效率[16-17]。SHENG 等[18]研究表明超声靶向bFGF 脂质体微泡能够抑制糖尿病肾病大鼠模型的炎症损伤和肾小管细胞凋亡,可能有助于早期糖尿病肾病的治疗。王梦蛟等[19]研究结果表明N-(4-羟基苯基)维甲酰胺(4-HRP)脂质微泡联合超声抑制成纤维细胞的增殖,促进成纤维细胞的凋亡,且效果优于4-HRP 溶液。本研究结果发现,超声后,bFGF 水溶液和bFGF 纳米微泡组对裸鼠瘢痕疙瘩生长和纤维化的抑制及对瘢痕疙瘩细胞的凋亡显著高于bFGF 水溶液组和bFGF 纳米微泡组,提示超声空化有助于bFGF 的释放,抑制瘢痕疙瘩的生长,抑制胶原沉积,可能是瘢痕疙瘩治疗的有效方法。
PTEN 是一个肿瘤抑制基因,可通过负调控PI3K/Akt 信号通路,抑制细胞的生长和存活[20]。研究表明TGF-β 通过激活PI3K/Akt 信号通路促进成纤维细胞的增殖、分化和侵袭[21]。TANG 等[8]研究表明成纤维细胞中PTEN 蛋白表达显著低于正常皮肤成纤维细胞,而PI3K、p-Akt 的表达显著升高。田小雨等[22]研究表明抑制PI3K/Akt 信号通路能够促进成纤维细胞的凋亡,抑制瘢痕疙瘩增生。本研究结果表明bFGF 处理组PTEN 蛋白表达高于对照组,而PI3K、p-Akt 表达降低,且超声+bFGF 处理组进一步增加PTEN 蛋白水平,抑制蛋白PI3K、p-Akt 的表达,提示超声+bFGF 纳米微泡促进PTEN/PI3K/Akt 信号通路的激活,可能是超声+bFGF 纳米微泡在瘢痕疙瘩治疗的潜在机制,具体作用机制有待进一步探讨。
综上所述,bFGF 处理能够抑制裸鼠瘢痕疙瘩的生长,超声激励bFGF 纳米微泡能够增强bFGF对瘢痕疙瘩生长的抑制,可能与PTEN/PI3K/Akt 信号通路的激活有关。然而本研究尚存在不足之处:未使用PTEN/PI3K/Akt 信号通路抑制剂进行回复试验,同时超声激励bFGF 纳米微泡对裸鼠瘢痕疙瘩生长的抑制作用可能还涉及其他信号通路,且后续仍需进行大样本,多中心的随机化临床研究验,继续深入研究。

