E2F转录因子7在甲状腺乳头状癌中的表达及生物学作用
范会利 赵如华 张赫 林旭 薛刚 吴靖芳
河北北方学院1形态学实验室,2耳鼻咽喉头颈外科教研室(河北张家口 075000)
甲状腺乳头状癌(papillarythyroidcarcinoma,PTC)是甲状腺癌最常见的病理类型。近30年甲状腺癌发病率增长迅速,与PTC 发病率增加密切相关[1-2]。研究发现甲状腺癌可从缓慢进展的惰性肿瘤发展为高度侵袭性肿瘤[3]。通过切除术和放射性碘等治疗PTC 达到一定的治疗效果,但是未能有效降低它的复发率,PTC 的发病机制尚未阐明[4-5]。因此,迫切需要深入研究PTC 发生发展的分子机制,降低PTC 复发和转移。
E2F 转录因子家族有E2F1- 8 八个成员,E2F1- 3 是转录活化因子,而E2F4- 8 作用相反。E2F 转录因子7(E2F7)作为非典型E2F 家族一员,在肿瘤中的作用存在争议。其在肺腺癌、神经胶质瘤、胆管癌等多种恶性肿瘤中上调,是一种促肿瘤的转录因子[6-8];但在皮肤鳞状细胞癌中作为保护因子,E2F7 通过对细胞周期基因的转录抑制来发挥保护作用[9]。然而,E2F7 在PTC 的临床意义及其作用机制尚不清楚。因此,进一步探究E2F7基因在PTC 中作用机制具有深远意义。
1 材料与方法
1.1 细胞、试剂和耗材 人甲状腺乳头状癌K1、TPC-1 和BCPAP 细胞系购自中国科学院上海细胞所,正常甲状腺滤泡上皮Nthy-ori 3-1 细胞购于北京北纳创联生物技术研究院;FBS、H-DMEM 和RMPI1640 培养基购自Gibco公司;shE2F7和shRNAC质粒由北京合生有限公司构建;Trizol 试剂购自Invitrogen 公司;RT-PCR 试剂盒购自天根生物科技(北京)有限公司;抗体购自Affinity 公司;PowerUpTMSYBR TM Green Master Mix 购自Thermo Fisher Scientific 公司;PTC 组织芯片(OD-CT EdThy03)购自上海芯超有限公司,该芯片已经通过伦理委员会批准。
1.2 方法
1.2.1 免疫组织化学实验 组织芯片经脱蜡、复水,枸橼酸抗原修复,内源性过氧化物酶阻断后,Ⅰ抗4 ℃孵育过夜(E2F7 工作浓度1∶100),Ⅱ抗(羊抗鼠lgG)37 ℃孵育30 min,用HRP 标记链霉卵白素37 ℃孵育30 min,DAB 显色,苏木素复染,脱水、透明、封片。用双盲法确定组织的阳性率,结果以胞质出现浅黄色至棕褐色者为阳性,染色强度评分标准为基本不着色、浅黄色、棕黄色、棕褐色依次记为0、1、2、3 分;阳性细胞所占比例评分标准为:0、1%~25%、26%~50%、51%~75%、76%~100%依次计为0、1、2、3、4 分。相乘两项指标评分,判定结果如下:阴性为0 ~3 分、阳性为4 ~12 分。
1.2.2 细胞培养及转染分组 Nthy-ori 3-1、K1、TPC-1 和BCPAP 细胞分别用含有10%FBS、1%青、链霉素双抗的H-DMEM、RMPI1640 培养液,置于37 ℃、5%CO2的孵箱中培养。1∶2 传代取对数生长期细胞用于实验。选出E2F7的表达水平最高的K1细胞株进行沉默效率的检测。将shE2F7 重组质粒、空载体和只含有等量转染试剂LipofectamineTM3000 的溶液分别转染K1 细胞,即为:基因沉默组(shE2F7)、空载体对照组shRNAC-K1(shRNAC)和空白对照组(K1 组)。
1.2.3 蛋白质印迹法 RIPA 裂解法提取细胞总蛋白,进行SDS-PAGE 和转膜,4 ℃孵育I 抗β-actin(1∶4 000)、E2F7(1∶1 000)、cyclinD1(1∶1 000)、cyclinE1(1∶800)、EIF4A3(1∶1 000)、CDK4(1∶1 200)、AKT,p-AKT(1∶1 500)过夜;Ⅱ抗(1∶4 000)孵育1 h,以β-actin 作为内参,ECL 发光液显影,应用Image J 1.48 图像分析软件分析蛋白相对表达量。
1.2.4 qRT-PCR Trizol 法分别提取3 组细胞的总RNA、定量后反转录为cDNA,以β-actin 为内参,反应体系和条件根据试剂盒说明进行。采用2-ΔΔCt方法计算相对表达量。引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.5 检测细胞增殖、迁移能力
1.2.5.1 生长曲线 将三组细胞制成1 × 107/L 细胞悬液接种于96 孔板,设3 个平行的复孔,放于机器IncuCyte ZOOM 进行培养。根据仪器摄片结果统计并绘制出生长曲线。
1.2.5.2 细胞克隆形成实验 三组细胞以每500个/孔的细胞密度接种于六孔板,各3 个复孔,培养至一周后终止培养,用4%多聚甲醛固定,Giemsa染色,流水冲洗,自然干燥。选取克隆细胞数大于50 的集落团计数。
1.2.5.3 细胞划痕 三组细胞以5 × 108/L 细胞悬液接种于6 孔板,用ZOOM40731 的96 孔划痕器(Wound Maker Tool)单向移动“一”字划痕。PBS洗,继续培养。3 个复孔,分别在0、12、24 h 进行摄片,计算划痕愈合率。应用Image J1.48 图像分析软件计算迁移面积分析。
1.2.6 检测细胞周期及细胞凋亡 将三组细胞消化离心,PBS 重悬细胞,储存于4 ℃75%乙醇4h 备用。离心去除酒精,PBS 清洗加入PI 溶液和RNase溶液,避光15 min ,流式细胞仪检测细胞周期。用1×Binding Buffer 重悬细胞,分别加入5 μL Annexin V-FITC 与PI,避光孵育10 min,加入PBS 至500 μL,流式细胞仪检测细胞凋亡率。
1.3 统计学方法 用SPSS 20.0统计学软件进行数据分析。计量资料表示为均值±标准差,两组间比较用t检验,多组间比较用方差分析;计数资料以例数和百分数表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 组织芯片验证PTC 中E2F7 的表达 PTC 患者组织E2F7 阳性率为88%(51/58),癌旁组织阳性率为12%(7/58),差异有统计学意义(P<0.01)。不同性别、年龄的PTC 患者E2F7 阳性率差异无统计学意义(P>0.05),不同肿瘤大小、肿瘤分期以及是否发生淋巴结转移的PTC 患者E2F7 阳性率差异有统计学意义(P<0.05)。见图1 和表1。

表1 PTC 中E2F7 的表达与临床病理参数的关系Tab.1 Relationship between E2F7 expression in PTC and clinicopathological parameters 例

图1 E2F7 在PTC 和癌旁正常织中的表达(免疫组织化学染色×100,Bar=50 μm)Fig.1 E2F7 in PTC and adjacent normal tissues(IHC×200,Bar=50 μm)
2.2 E2F7 在PTC 细胞系及正常甲状腺滤泡细胞中的表达 三株PTC 细胞系E2F7 蛋白表达水平高于Nthy-ori 3-1 细胞(P<0.01)。K1 细胞表达水平最高,故选择K1 细胞敲低E2F7 进一步验证E2F7 对PTC 细胞生物学行为的影响。见图2。

图2 滤泡上皮Nthy-ori 3-1 细胞及甲状腺乳头状癌K1、BCPAP、TPC-1 细胞和E2F7 蛋白表达Fig.2 E2F7 expression among Papillary thyroid carcinoma K1,TPC-1,BCPAP cells and thyroid follicular Nthy-ori3-1 epithelial cells
2.3 K1 细胞转染后E2F7 沉默效率 qRT-PCR 结果显示shE2F7 沉默效率为shRNAC 组的60.2%,为K1组的59.8%。WB显示与K1、shRNAC相比,shE2F7组E2F7 翻译水平分别降低了70%和60%左右,差异有统计学意义(P<0.01),见图3。

图3 沉默E2F7 对K1 细胞mRNA 及蛋白水平的影响Fig.3 Effects of Silencing E2F7 on mRNA and protein levels of K1 cells
2.4 沉默E2F7 对K1 细胞增殖、迁移能力的影响 shE2F7 细胞生长速度在第2、3 天明显慢于shRNAC 组和K1 组(P<0.01,图4A-B)。细胞克隆数与shRNAC组和K1组相比明显减少,克隆形成能力明显降低(P<0.01,图5C-D)。12 h和24 h细胞迁移速度慢于shRNAC组和K1组(P<0.01,图4E-F)。

图4 沉默E2F7 细胞增殖、克隆能力和迁移能力变化Fig.4 Changes of proliferation,cloning and migration ability after inhibition of E2F7 expression
2.5 干扰E2F7 对K1 细胞周期及凋亡的影响shE2F7组G0/G1期细胞比例为(65.13±4.25)%高于shRNAC 组的(37.65±3.09)%和K1组细胞的(40.06± 3.75)% ,而S 期细胞比例为(20.07 ± 0.94)%,明显低于shRNAC 组的(40.63 ± 3.89)%和K1 组的(40.06 ± 1.45)%,G2 期细胞比例也有所减少(P<0.01,图5A-B);说明shE2F7延长了K1细胞在G0/G1期滞留的时间,细胞周期受到阻滞。shE2F7 组细胞凋亡率比空载体组和K1 组显著增加,差异有统计学意义(P<0.01,图5C-D)。

图5 沉默shE2F7 对K1 细胞周期,凋亡的影响Fig.5 The effect of shE2F7on apoptosis of K1 cells
2.6 干扰E2F7 对K1 细胞周期相关蛋白及AKT信号通路的影响 敲低E2F7 后cyclin D1 和CDK4、cyclinE1、EIF4A3 mRNA和蛋白水平降低(P<0.01);Akt,pAkt 蛋白表达水平下调(P<0.05)。见图6。
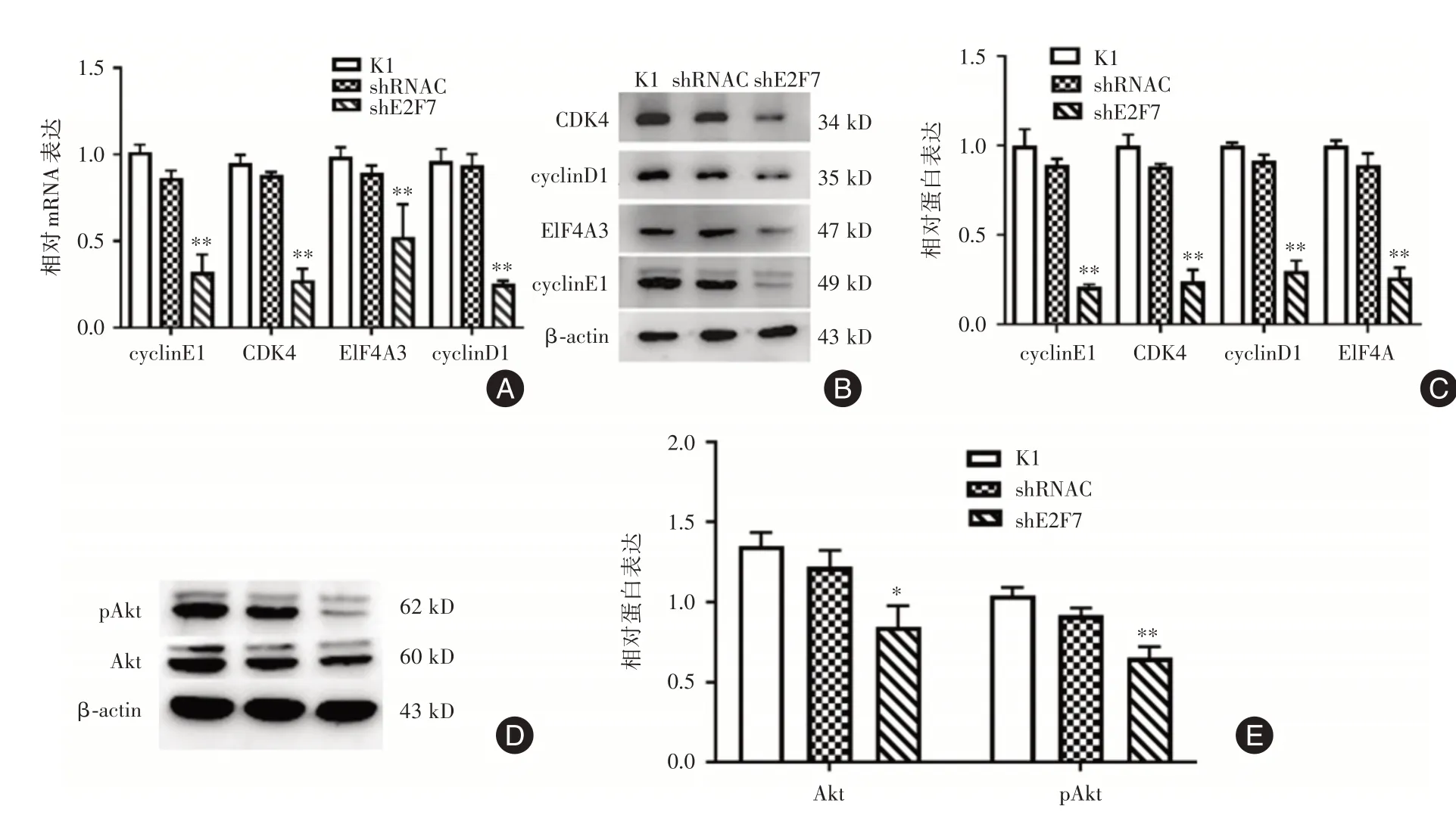
图6 E2F7 参与细胞周期和信号通路调控Fig.6 E2F7 is involved in regulating the cell cycle and signaling pathways
3 讨论
E2F 转录因子家族是细胞增殖的重要调节因子,细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)CDK-RB-E2F 轴构成了细胞周期进程的核心转录机制,CDK 的激活,RB 的磷酸化等均可导致E2F 活性升高,细胞增殖失控,致瘤性增强[8,10]。研究发现E2F7 作为一种潜在的致癌基因可导致胶质母细胞瘤细胞增殖,进而促进胶质母细胞瘤的进展,并作为一个有希望的抗胶质母细胞瘤治疗靶点[11]。
本研究分析了E2F7 在PTC 中高表达并验证了E2F7 在PTC 表达水平高于癌旁组织,并与肿瘤分期、淋巴结转移相关。为明确E2F7 在PTC 中的作用机制,选择三株PTC 细胞中E2F7 基因表达最高的K1 细胞进行E2F7 敲减,证明E2F7mRNA 及蛋白表达水平明显降低。K1 细胞迁移和克隆能力明显下降,增殖能力减弱。
为明确E2F7 促进K1 细胞增殖的机制,细胞周期实验显示shE2F7 组细胞大多停滞于G0/G1 期或S 期,细胞生长停滞。ZHAO 等[12]报道了肝细胞癌miR-424-5p 下调,靶基因E2F7 上调,促进G0/G1向S 转换促进细胞增殖。细胞周期的进展是由CDKs 与相应的周期蛋白结合控制的[13]。杨闪闪等[14]发现CCNL1 家族成员CyclinD1 能够抑制人绒毛膜滋养细胞的增殖并影响细胞周期分布。WB结果显示shE2F7 组G0/G1 关键周期蛋白cyclinD1/CDK4明显下调,G1期进入向S期的关键基因cyclin E1/CDK2 也下调,与流式细胞周期结果一致。凋亡实验结果显示shE2F7 组细胞凋亡率增加。真核生物起始因子4A-III(eIF4A3)是外显子连接复合物(exon junction complex,EJC)的核心解旋酶成分,作为EJC 的一种新成分,研究发现eIF4A3 存在于细胞核中。EIF4A3 可能直接与细胞周期调节基因CDK1、CDK2、CHEK1 和E2F1 等外显子区结合调节其表达[15]。Lnc casc11在肝癌中上调并与预后不良相关,证明Lnc casc11 通过招募eIF4A3 调节E2F1,影响肝癌细胞的增殖、细胞活动、凋亡和细胞代谢,促进肝癌的进展[16]。上述提示本研究沉默E2F7后可能通过eIF4A3下调抑制了cyclinD1,E/CDK4 等基因转录,引起细胞周期阻滞。
Akt在PI3K/Akt 信号通路中起主要作用。磷酸化的Akt(pAkt)参与调节凋亡、增殖和细胞运动[12]。WANG 等[17]研究发现黄芩素下调PI3K/AKT 通路蛋白可以抑制TC 细胞的生长和迁移,激活凋亡信号通路。本研究显示沉默E2F7 基因可以诱导K1细胞凋亡,PI3K/AKT 通路相关蛋白p-Akt/Akt 蛋白表达明显X 下调,提示PI3K/Akt 通路参与K1 细胞增殖。Ma 的研究显示microRNA-302a/d 通过靶向E2F7/Akt 轴抑制肝癌干细胞的自我更新能力促进AKT1-cyclin D1进入细胞周期[18]。Mir-129-5p 和si-E2F7 均能显著诱导直肠腺癌sw1463 细胞凋亡,上调E2F7 抑制凋亡[19]。有研究发现LINC00284 可作 为ceRNA 吸附miR-3127-5p 靶 向E2F7 发挥促进PTC 增殖。GUO 等[20]报道miR-30a 通过直接靶向E2F7 在PTC 中起肿瘤抑制作用,而miR-30a 可能是PTC 患者的新型治疗靶点。但是这两项研究均未在组织层面系统探索E2F7 和TPC 之间作用机制。本研究在组织水平、细胞层面对E2F7 促增殖机制进行了系统研究。表明沉默E2F7 可通过Akt信号通路抑制甲状腺乳头状癌K1 细胞增殖、促进凋亡。但尚有待对E2F7 在PTC 中上调机制及体内实验进行深入研究。

