急性放射性肠损伤发病机制及防治进展
王 盈 朱凤琴 韩 伟
肠道细胞尤其是上皮类细胞因其快速增殖和更新,对电离辐射表现出高敏感性。在腹盆腔及腹膜后肿瘤放射治疗中,放射性肠损伤是常见的并发症。根据其发病时间不同,可分为急性和慢性两类。急性放射性肠损伤常出现在放疗后3个月内,发病率80%~90%,表现为腹泻、腹痛、里急后重、便血等;慢性放射性肠损伤则出现在放疗后3个月~30年,其中2%~15%患者发展为严重的肠道疾病,表现为肠管缩窄、肠梗阻、肠穿孔等[1-2]。急性放射性肠损伤发病率高,影响放射治疗效果和患者生活质量。目前,其发病机制仍未完全明确,临床治疗效果欠佳,本文对急性放射性肠损伤的发病机制及防治进展进行回顾。
1 发病机制
肠上皮细胞、肠干细胞的高增殖率,使肠道成为易受到辐射损伤的器官之一。近年来,研究[3-4]认为,急性放射性肠损伤主要与肠道黏膜干细胞死亡、血管内皮损伤、肠道菌群失调及炎症因子表达异常有关。见图1。
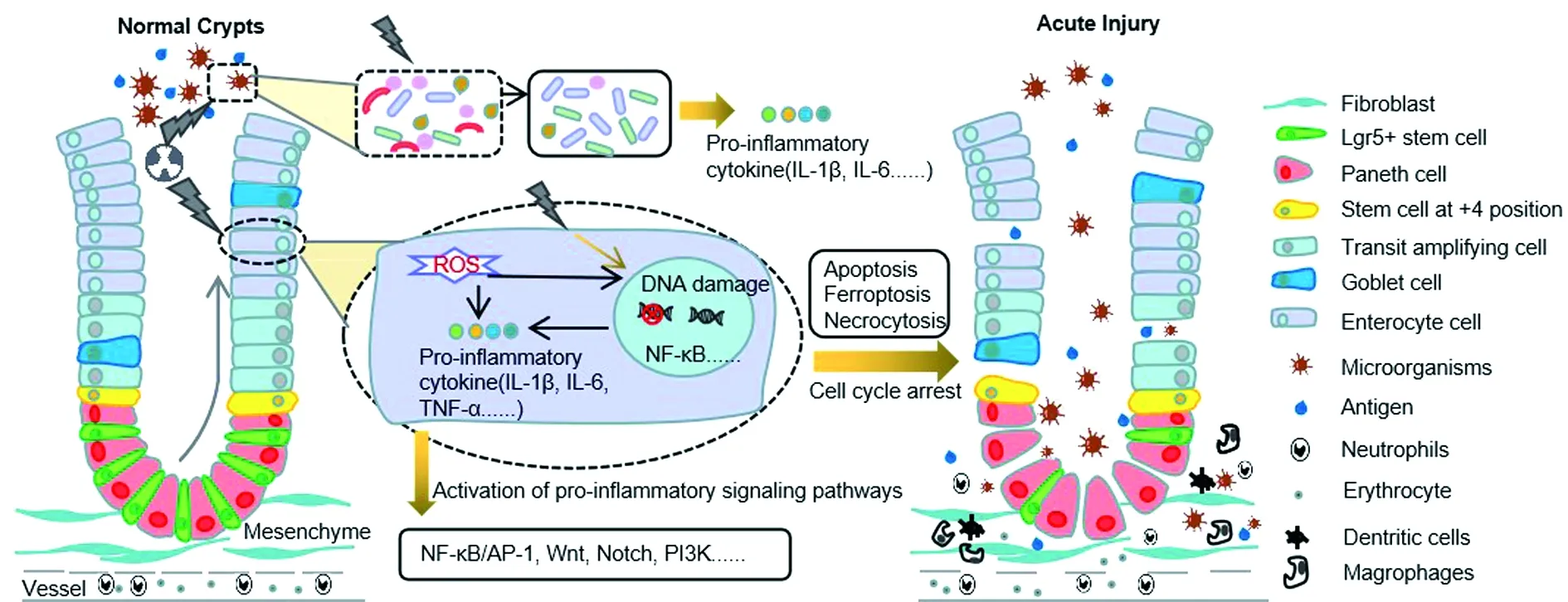
图1 急性放射性肠损伤发病机制
1.1 辐射损伤的病理生理机制 电离辐射可导致细胞DNA的直接和/或间接损伤。射线携带的能量破坏DNA结构,导致DNA单链和/或双链断裂,以及碱基损伤等[1]。辐射还可导致水分子电离,产生活性氧(reactive oxygen species,ROS)和活性氮自由基,引发线粒体“呼吸爆发”产生大量ROS[5]。活性基团可进一步导致DNA或RNA损伤、氨基酸氧化及脂质过氧化等[6],激活多种信号通路,造成细胞周期阻滞、细胞凋亡或坏死、炎性因子释放等病理改变。
1.2 肠道黏膜干细胞死亡 肠道黏膜是隔绝肠道组织和肠腔内容物的屏障,主要由肠上皮细胞组成,未分化的肠干细胞位于黏膜表面的隐窝内。辐射导致肠上皮细胞损伤,继而引起肠道屏障受损。研究[7]表明,Lgr5+肠干细胞死亡,无法及时补充受损的肠上皮细胞,是肠道黏膜持续损伤的关键。此外,急性放射性肠损伤时期,辐射引起血管内皮损伤,血管及组织交界处出现渗出、水肿,导致血管通透性增加,红细胞及中性粒细胞进入黏膜固有层。最终,肠上皮屏障完整性被破坏,微生物、电解质、大分子等抗原物质流入黏膜固有层,导致由巨噬细胞、树突状细胞和中性粒细胞共同参与的炎症发生[1,8]。此外,非传统型前折叠束RPB5交互因子(unconventional prefoldin RPB5 interactor,URI)也参与肠道黏膜干细胞的死亡。URI广泛参与生物体内转录调节、凋亡调控和保护DNA完整性[9]等生理学过程。最新研究[10]表明,URI表达水平降低可激活β-catenin-c-MYC信号通路,使缓慢分裂的干细胞样标记物细胞依赖性增殖,增加其对辐射的敏感性。该研究[10]发现,高剂量辐照后早期(24~48 h)小鼠肠隐窝中URI水平增加,再生期(辐射后72~96 h)内URI水平下降;过表达URI可显著缓解小鼠辐射后的胃肠道反应,而降低URI表达则导致肠道细胞辐射敏感性增高。
研究[11-12]发现,辐射敏感组织在辐射后显示出延长的p53信号激活,可导致凋亡信号通路激活,引起肠道干细胞凋亡;辐射耐受组织仅表现短暂的p53激活,且p53缺陷小鼠对凋亡产生抗性。有学者对实验小鼠,通过基因敲除或药物抑制组蛋白去乙酰化酶(sirtuin 1,SIRT1),给予致死剂量辐射,结果显示抑制SIRT1增加p53乙酰化,使得p53稳定,可促进Lgr5+肠干细胞的恢复和肠上皮细胞的生存[13]。Wnt/β-catenin信号通路也参与放射性肠损伤过程,激活Wnt/β-catenin信号通路,可降低放射后隐窝细胞的凋亡,促进辐射后肠道细胞再生[7]。黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)作为细胞内双链DNA识别器,可由辐射导致的胞质双链DNA活化,引发半胱氨酸天冬氨酸酶-1(caspase-1)介导的肠隐窝细胞焦亡,释放白介素1β(IL-1β)等炎性因子,导致放射性肠损伤的产生;而AIM2敲除鼠较野生鼠辐射肠损伤程度缓解,存活时间延长[14]。
1.3 肠道菌群失调 肠道微生物组是调节全身免疫反应的关键因素。肠道微生物群与肿瘤治疗的有效性和毒副作用紧密相关。辐射可导致肠道内微生物组的丰度和多样性发生显著变化,如拟杆菌(Bacteroides)和肠杆菌科(Enterobacteriaceae)增加,双歧杆菌(Bifdobacterium)、柔嫩梭菌群(Faecalibacterium prausnitzii)和梭菌簇XIVa(Clostridium)减少等[15]。Gerassy-Vainberg等[16]发现,辐射后6周肠道微生物组成变化最为显著,苏特氏菌属(Suterella spp)、维氏微孢子菌门(Verucomicrobia)和阿克曼菌属(Akkermansia spp)显示出显著的丰度变化;在肠炎小鼠模型中,阿克曼菌属、拟杆菌、吉氏副拟杆菌(Parabacteroides)、苏特氏菌属、尿酸杆菌(Turicibacter)等6个属的细菌数量增加;肠炎段微生物组增强了IL-1β和TNF-α表达,证实了肠道微生物与放射性炎症发展的密切关系。Guo等[17]发现,高剂量辐射幸存小鼠(存活至正常寿命)肠道微生物群改变显著,毛螺菌科和肠球菌科丰度显著上升,且随时间延长而增加。另外,辐射幸存小鼠中丰度最高的3种细菌(螺菌、粪肠球菌、脆弱拟杆菌)及鼠李糖乳杆菌(已报道有辐射防护作用),移植至GF级或SPF级小鼠,均可显著提高辐射存活率。腹盆腔放疗患者的肠道微生物群多样性也发生改变。英国一项临床研究[18]招募了早期组(放疗后随访1年,n= 32)、晚期组(放疗后随访2年,n= 87)、肠镜组(放射性肠病患者,n=9;健康对照组,n=6)的腹盆腔放疗患者,发现梭菌簇Ⅳ、罗氏菌属(Roseburia)和考拉杆菌属(Phascolarctobacterium)的高计数与放射性肠损伤显著相关。放射性肠损伤患者中IL-7、IL-12/IL-23 p40、IL-15、IL-16显著降低,这些细胞因子与肠道微生物调节和肠壁维持动态平衡相关。Mitra等[19]分析了35名接受同步放化疗的宫颈癌患者的肠道微生物组(基线和放疗第1、3、5周),发现肠道菌群多样性持续下降,在第5周下降幅度最大。
1.4 炎症因子表达异常 在放射性肠损伤急性期,由于肠道黏膜屏障破坏和上皮细胞死亡导致炎症,受损的血管内皮刺激细胞因子、趋化因子和生长因子的分泌以及黏附分子的表达,单核细胞的额外募集和常驻肥大细胞激活,导致促炎因子IL-1β、IL-6和TNF-α等水平升高,可激活NF-κB/AP-1、Wnt、Notch、PI3K等信号通路,引起级联反应,形成炎症的正反馈回路,放大炎症反应和增加炎症所致慢性损伤程度[20]。
NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体是固有免疫中关键的胞质内感受器,可激活caspase-1,促进IL-1β等炎性因子的分泌和细胞焦亡的发生[21]。线粒体氧化应激、生物能损伤和NLRP3炎性小体激活参与放射性肠损伤的过程[22]。Wu等[23]在放射性肠病小鼠模型中发现,NLRP3炎性小体激活参与了辐射诱导的肠道损伤,鞭毛素蛋白A N/C抑制辐射诱导的ROS生成,降低NLRP3活性,减少caspase-1依赖性焦亡的发生。Hu等[24]同样发现,在放射性肠损伤大鼠模型中,罗格列酮可抑制caspase-1、NLRP3、IL-1β和TNF-α的表达,缓解肠道损伤。体外实验发现,罗格列酮可降低NLRP3的表达,而NLRP3激活剂尿酸单钠可逆转罗格列酮对巨噬细胞中IL-1β和TNF-α的抑制,逆转罗格列酮对辐射致大鼠肠道损伤的保护作用。
模式识别受体Toll 样受体(Toll-like receptors,TLRs)可影响调节性T细胞(regulatory T cells,Treg)的增殖和免疫抑制功能,参与炎性因子表达。Yoshino等[25]研究发现,电离辐射通过ROS介导的c-jun氨基末端激酶(c-jun N-terminal kinase,JNK)激活,增加Toll 样受体2(Toll-like receptor 2,TLR2)和Toll 样受体4(Toll-like receptor 4,TLR4)的细胞表面表达。在培养细胞和动物试验中,TLR2、Toll 样受体5(Toll-like receptor 5,TLR5)或Toll 样受体9(Toll-like receptor 9,TLR9)激动剂均被证明可以抑制辐射诱导的细胞凋亡并促进细胞存活,如TLR5配体CBLB502可以减轻实验动物肠道损伤,TLR9配体对中空肠有保护作用[26]。
2 急性放射性肠损伤的危险因素及预防
肠道症状的严重程度呈剂量依赖性,急性放射性肠损伤相关的危险因素包括放疗总剂量、分割方式、靶区范围、肠道照射体积及肠道受照射量。Li等[27]回顾性研究100例妇科肿瘤术后放疗患者中辐照小肠体积与急性腹泻发展间的关系,发生2~3级腹泻的患者小肠受照射体积显著高于0~1级腹泻患者,小肠V25[(290.35±130.22)cm3,P= 0.001]是所有患者出现中重度腹泻的独立危险因素。充盈膀胱、排空直肠、使用腹板进行定位等方法均可减少小肠受照射体积。图像引导放疗使用成像来显示放射治疗靶区和解剖结构,可保证靶区精准,减少正常器官误照。
放疗技术的改良,有利于降低急性放射性肠损伤发病率。调强放疗技术可保证放疗靶区适形性,且较普放及三维适形放疗可减少40%的肠道辐射剂量[28]。Cucinotta等[29]利用新计算模型系统,反向验证人类小肠上皮细胞对分割照射的响应,结果显示,在相同的总剂量下,低分割放射治疗方案对人类正常小肠上皮的累积损伤效应小于传统分割放射治疗方案。FLASH放疗是一种超高剂量率超快辐射的先进放疗技术。Diffenderfer等[30]发现,FLASH放疗可减少全腹放疗或局灶性肠道放射治疗后的急性细胞损失和晚期纤维化。
急性放射性肠损伤其他的危险因素有吸烟、高血压、糖尿病、血管疾病、炎症性肠病、既往手术史、肥胖等,因此,在治疗前及治疗期间采取相应的预防措施可降低急性放射性肠损伤发病率,如吸烟患者绝对戒烟,高血压、糖尿病患者于放疗前进行良好的内科治疗等[31]。放疗联合其他肿瘤内科治疗或是危险因素之一。有文献[32]报道,盆腔放疗联合CDK4/6抑制剂哌柏西利治疗,表现出严重的肠炎症状。
3 急性放射性肠损伤治疗进展
急性放射性肠损伤常在放疗开始后较短时间内出现,临床常表现为便血、便急、便频、腹泻、粘液粪便、里急后重和肛门疼痛[33]。治疗上主要以营养支持、对症治疗为主,目前常用的治疗药物包括益生菌、抗氧化剂、抗炎类药物、抗生素等。
3.1 益生菌 肠道菌群失调与急性放射性肠损伤的发生发展相关。益生菌可维持肠道菌群平衡及肠道稳态,可改善放疗后腹痛腹泻的发生率和严重程度,降低止泻药使用率[34]。近年来,体内外试验均验证了益生菌对放射性肠损伤的疗效。Lu等[35]辐射前对小鼠进行藻蓝蛋白灌胃预处理连续1个月,发现藻蓝蛋白可改善肠道放射损伤程度,调节肠道微生物组成,增加有益菌比例,减少有害菌比例,从而降低脂多糖水平,抑制TLR4/Myd88/NF-κB通路的激活。临床研究中,有学者[36]发现,重组清酒乳酸菌是一种安全有效的肠道放射防护剂,可有效缓解放射性肠损伤症状,降低发病率。一项荟萃研究[37]纳入6项随机对照试验(共917名接受腹盆腔放疗患者),其中490例接受预防性益生菌(乳酸菌、双歧杆菌、链球菌)治疗,427例接受安慰剂治疗,结果显示益生菌组的腹泻发生率更低。
目前认为,肠道微生物通过其代谢产物保护肠道免受辐射损伤。在高剂量辐射幸存鼠(存活至正常寿命)粪便中发现,微生物衍生的丙酸和色氨酸代谢物浓度增加,可缓解辐射致胃肠道综合征严重程度[16]。吲哚- 3-丙酸(3-indolepropionic acid,IPA),是一种肠道微生物衍生的色氨酸脱氨产物,可通过增强上皮和黏液屏障,改善肠道屏障功能[38]。Xiao等[39]研究发现,对受辐射小鼠进行粪菌移植可提高其粪便中IPA水平,通过口服途径补充IPA也可有效缓解受辐射小鼠的造血系统和胃肠道损伤,且不会促进肿瘤生长。全佳等[40]利用丁酸钠对大鼠肠损伤模型进行干预,证实其可增加放射性肠损伤大鼠肠黏膜血流量,降低一氧化氮产生量,发挥保护肠黏膜作用。此外,粪球菌属、真杆菌属等肠道微生物短链脂肪酸代谢产物戊酸,也被证实有类似功效[41]。
3.2 抗氧化剂 电离辐射可诱导大量ROS产生,继而引起细胞损伤。抗氧化剂如还原性谷胱甘肽、维生素、谷氨酰胺等,在临床上使用较多。谷氨酰胺可为快速分裂细胞(如肠道干细胞、血管内皮细胞等)提供能源,能合成还原性谷胱甘肽,提高机体抗氧化能力。既往研究[42]认为,谷氨酰胺可以缓解发生在头颈、食管、胃肠部位与放化疗相关的黏膜溃疡。但近来一项Meta分析[43]提出不同结论,结果显示谷氨酰胺并不能改善放射性肠炎的严重程度和症状。
染料木黄酮(Genistein)具有较强的抗氧化性和蛋白酪氨酸酶激酶抑制活性,具有良好的抗辐射作用[44]。Zhang等[45]从苦参中提取染料木黄酮,证明染料木黄酮可通过上调Rassf1a和Ercc1基因表达水平减轻DNA辐照损伤,对小鼠放射性肠损伤具有保护作用。逄志骏等[46]研究发现,槐角中提取的低剂量染料木黄酮能促进小肠上皮细胞细胞增殖,提高辐照后细胞存活率,高剂量染料木黄酮则会抑制细胞增殖。动物研究[46]发现,槐角染料木黄酮可减少辐射小鼠的肠道结构破坏,使细胞凋亡程度得到缓解。
其他抗氧化剂,如:大黄多糖可上调Nrf2/HO-1水平,减少细胞凋亡,降低炎症因子水平,从而降低辐射诱导的肠道损伤[47];n-乙酰半胱氨酸可降低辐射所致小肠组织中丙二醛水平和caspase-3表达水平[48];香兰素衍生物VND3207可促进细胞增殖和抑制细胞凋亡,在体外保护辐射后的肠上皮细胞,并通过调节DNA-PKcs通路促进辐射损伤后肠道修复[49];核桃寡肽增强小鼠的抗氧化防御系统,也可限制炎症级联反应以及减少肠道上皮损伤、促进上皮完整性[50];牛磺酸可通过激活 Nrf2 /HO-1通路,降低细胞内ROS水平,对电离辐射引起的肠道损伤发挥保护作用[51]。但上述抗氧化剂的相关临床功效尚需证实。
3.3 抗炎类药物 炎性因子异常表达引起的级联炎症反应是放射性肠损伤的发生机制之一,多类抗炎药物已被尝试用于治疗,如5-氨基水杨酸的衍生物美沙拉嗪和柳氮吡啶。二者可减少自由基和抑制前列环素生物合成,通常用于炎症性肠病,治疗急性放射性肠损伤。一项多中心的随机对照Ⅲ期临床研究[52],纳入盆腔放疗患者87例,随机采用柳氮磺胺吡啶或安慰剂预防急性腹泻,在中期毒性分析中,柳氮磺胺吡啶组的3级腹泻发生率比安慰剂组明显升高(29% 比 11%,P=0.04),两组在主要研究终点(腹泻严重程度)方面差异无统计学意义。
类固醇类药物如泼尼松龙、倍他米松及氢化可的松等,对放射性肺炎、放射性皮炎具有一定疗效,但在放射性肠损伤中的具体疗效尚不明确。曾有学者对三维适形放疗的前列腺癌患者分组进行药物灌肠干预(美沙拉嗪组、氢化可的松组、硫糖铝组)研究[53],急性放射性直肠损伤发生率分别为(87.5±11.7)%、(52.4±6.2)%和(61.9±6.1)%,结果表明放射性直肠损伤局部使用美沙拉嗪并不获益,氢化可的松灌肠也并不优于硫糖铝。另有学者对28例盆腔放疗的患者进行临床研究,结果显示静脉注射曲安奈德治疗可有效预防急性放射性胃肠炎[54]。其他诸如黄芩苷[55]、大黄酸[20]、红景天红素[56]等中药成分,因其既往研究中体现的抗炎作用,也在动物模型研究中展示出治疗急性放射性肠损伤的功效。
3.4 其他治疗方案 中药组方的作用被国内学者重视。孙云川等[57]发现,安肠组方可改善急性放射性肠炎大鼠一般情况,有效缓解肠道放射损伤,其机制可能与降低肠组织ROS水平、减轻炎症,并抑制细胞凋亡、稳定肠黏膜机械屏障有关。谢梓沄等[58]对大鼠放射性肠损伤模型进行研究,发现肠和煎液可降低大鼠小肠组织TLR4、NF-κBP65表达及IL-1、IL-6、TNF-α含量,证实肠和煎液可降低辐射损伤,保护肠道黏膜。
抗生素是治疗急性放射性肠损伤的一种可选择手段,在动物试验中证实抗生素预处理可减轻小鼠放射性肠损伤发生率和提高存活率[59],在临床研究中可改善患者出血、腹泻症状。纳米炭悬浮液注射液作为一种临床获批的口服纳米碳粒,可通过保护小肠隐窝干细胞,维持肠道菌群平衡,起到防护作用[60]。其他纳米药物如包裹沙利度胺的纳米药物[61]、低分子量岩藻聚糖-壳聚糖纳米粒子[62]也在动物模型中展示出有效性。普伐他汀可通过调节血栓调节蛋白表达改善辐射诱导的内皮损伤,从而减轻放射性直肠炎症状[63]。其他关于放射性肠损伤治疗的研究则聚焦在抗肠道干细胞凋亡、阻滞急性放射性肠损伤产生的细胞信号通路等方面,多个药物及手段如褪黑素、生育三烯酚、间充质干细胞表现出对放射性肠损伤良好的功效,但均尚未进入临床研究阶段。
3.5 治疗展望 临床上目前惯用的治疗药物有抗氧化剂如谷氨酰胺、还原性谷胱甘肽,抗炎类药物如柳氮磺胺吡啶、美沙拉嗪,类固醇类药物如泼尼松、氢化可的松,以及抗生素等,但相关研究表明上述治疗并未有显著获益。
虽然目前放射性肠损伤的发生机制和治疗策略研究百花齐放,但进入临床应用尚有较长距离。基于现有的进展,未来放射性肠损伤治疗策略可能的突破点有:①针对放射性肠损伤中的代表性细胞死亡方式,如凋亡、铁死亡等,靶向死亡通路中的关键信号分子,降低细胞死亡率;②加快肠道上皮屏障重建,如促进隐窝干细胞增殖分化等;③通过有益肠道菌群移植,重构肠道菌群平衡;④针对放射性肠损伤发生中所激活的相关炎性通路,如NLRP3、AIM2通路关键靶点,进行特异性拮抗以降低炎症程度。
4 结语
急性放射性肠损伤的发病机制较为复杂,尚无统一定论。放射技术手段的改进及肠道组织的策略性保护,一定程度上减少了肠道辐射损伤的发生。治疗的药物种类和手段也趋于多样化,益生菌类展现出一定的治疗前景,但仍缺乏统一的、公认的治疗标准。进一步深入探讨急性放射性肠损伤的发病机制,进行防治相结合,对于降低其发病率有着重要意义。

