铜基单原子纳米酶结合酸碱诱导分散液液微萃取分光光度法测定地表水中挥发酚
闫 琨, 冯 晖, 祝 艳, 李秋兰, 杨德志, 杨亚玲*
(1.云南省生态环境厅驻昆明市生态环境监测站,云南昆明 650028; 2.昆明理工大学生命科学与技术学院,云南昆明 650500)
挥发酚一般是能与水蒸汽一起蒸发、沸点小于230 ℃的一元酚[1],它是现代工业产生的有机污染物,其进入到环境中会对人和动物体健康造成很大的危害[2 - 4]。水中挥发酚含量是我国饮用水和地表水必须检测的项目,检测方法主要按照(HJ503-2009)《水质挥发酚的测定4-氨基安替比林分光光度法》进行[5],通过分光光度法直接测定的检出限为0.01 mg/L,萃取之后再用分光光度法测定的检出限为0.3 μg/L。该方法用到了有毒的K3[Fe(CN)6]溶液作氧化剂,且萃取中用到大量的有机溶剂氯仿,对环境及检测人员可能会造成一定的危害。
2007年,研究者初次发现Fe3O4磁性纳米颗粒具有过氧化物酶活性,从此开创了纳米酶研究先河[6]。纳米酶是一种具有酶活性的纳米材料,拥有天然酶的特性和催化能力[7]。纳米酶在一定程度上克服了天然酶存在的固有缺点,具有容易制备和保存、适用条件更广等优势。现如今多种不同类型的纳米酶都实现了广泛的应用[8 - 11]。单原子纳米材料就是其中之一,在肿瘤治疗、抗菌、抗氧化及生物传感等领域均得到了广泛应用[12 - 17]。设计和制备性能优于天然酶的纳米酶已经成为科学研究的热点,其中单原子纳米材料对原子利用率的显著提升,使纳米酶活性得到了很大程度的改善。有研究者报道,单个铁原子具有优良的酶活性,其酶活大大超过了Fe3O4纳米酶[18 - 20]。在此,受配位设计策略的启发,鉴于叶绿素铜钠具备与天然叶绿素相同的金属卟啉结构(图1),我们以叶绿素铜钠为原料,将叶绿素中的氮作为铜原子的节点,防止金属原子的迁移和耦合,用盐模板法合成了一种在氮掺杂碳纳米片表面高浓度孤立Cu原子的单原子纳米酶(Cu SAzymes,Cu-N-C),所制备的Cu-N-C具有优越的过氧化物酶活性。Cu-N-C不仅能催化苯酚和4-氨基安替比林(4-AP)的偶联,还能催化氧化传统4-AP法中不能氧化和测定的硝基酚类物质。结合分散液液微萃取技术,研究基于纳米酶的催化氧化建立了挥发酚比色检测的方法。该测定方法操作简便、快捷、灵敏度高、选择性好,并能实现实时快检,对于建立现场分析技术具有借鉴和指导意义。

图1 叶绿素铜钠结构式Fig.1 Structure of sodium copper chlorophyll
1 实验部分
1.1 仪器与化学试剂
场发射透射电子显微镜(TEM,Tecnai G2 TF30,荷兰FEI公司);紫外-可见分光光度计(UV-2600,日本岛津公司);X射线衍射仪(XRD,德国Bruker公司);傅立叶变换红外光谱分析仪(FTIR,TENsoR27型,德国Bmker公司);X射线光电子能谱(XPS,ESCALAB 250Xi,赛默飞世尔(中国)公司);电子自旋共振光谱仪(ESR,ABrukerEMX,Billerica,MA);高速离心机(HC-3018R型,安徽中科中佳科学仪器有限公司);石英管式炉(SG-GS 1200,上海识捷电炉有限公司);精密酸度计(pHS-3B,德国赛多利);磁力加热搅拌器(78-1型,上海南汇电讯器材厂);电子分析天平(AB204-S,梅特勒-托利多)。
苯酚标准溶液(500 mg/L)和挥发酚标准样品购买自环境保护部标准样品研究所。邻苯二胺(OPD)、叶绿素铜钠(≥99%)、正庚酸(99%)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)和3,3′,5,5′-四甲基联苯胺(TMB)购自阿拉丁生化科技股份中国有限公司,4-氨基安替比林(4-AP,99%)、H2O2(30%)、KCl(AR)、H2SO4(98%)、HCl(36.5%)、NH3·H2O(28%)和薄荷醇(≥99%)购买自上海麦克林生化科技有限公司;实验用水为去离子水。
1.2 Cu-N-C的合成
将0.7 g叶绿素铜钠、10 mL甲醇与50 g KCl加到圆底烧瓶中,密封并室温搅拌10 h。然后将其放置到真空干燥箱中,80 ℃干燥24 h以除去甲醇。得到固体颗粒后,放置于管式炉中,氮气保护下750 ℃煅烧3 h,产物通过0.5 mol/L的H2SO4浸泡24 h,并用去离子水洗涤多次,即得到Cu-N-C。
1.3 Cu-N-C的表征
用场发射透射电子显微镜(TEM)对Cu-N-C的粒径和形貌进行测试;利用紫外-可见吸收光谱(UV-2600)和傅里叶红外光谱分析Cu-N-C的光谱学特性和基团等;在2θ为20°~100°的范围内通过X-射线衍射仪对纳米Cu-N-C进行物相鉴定;采用电子自旋共振光谱仪测试反应中自由基的产生。
1.4 过氧化酶活性测定
在25 μL Cu-N-C(35 μg/mL)和2 mL HAc-NaAc缓冲溶液(pH=4.0)中,通过加入不同浓度的H2O2和TMB,混匀并室温孵育30 min后,在波长654 nm处进行吸光度测定。利用经典的米氏方程模型,对Cu-N-C的酶活进行评估:1/v=(Km/Vmax)·(1/[S]+1/Km),式中v为反应速率,Km为米氏常数,Vmax为最大反应速率,[S]为底物TMB浓度。
1.5 挥发酚的测定
在50 mL具塞比色管中加入浓度范围在1.25~250 μg/L苯酚标准溶液,5 mL的柠檬酸-磷酸氢二钠缓冲溶液(pH=7.0),1.5 mL 4-AP,0.1 mL 35 μg/mL的Cu-N-C,0.2 mL 40 mmol/L的H2O2。用去离子水稀释至50 mL并混匀,于室温下放置5~10 min。然后加入2 mL低共熔溶剂作萃取剂,加入1 mL NH3·H2O作乳化剂,涡旋1~2 min形成均匀乳液。静置2 min后,加1 mL HCl,4 000 r/min下离心5 min分相。最后取上层低共溶溶剂萃取相,于波长508 nm处测定吸光度。
2 结果与讨论
2.1 Cu-N-C纳米酶的表征分析
Cu-N-C纳米酶的形貌特征用透射电镜(TEM)测试,结果如图2A所示。从图中可以看出合成的产物呈现纳米片状结构。Cu-N-C的X射线衍射(XRD)图谱在2θ=25.2°处的峰与碳材料的峰对应(图2B)。图2C为Cu-N-C的傅立叶变换红外(FTIR)光谱图,如图所示,3 417、3 236 cm-1位置的峰归因于O-H和N-H的伸缩振动,2 924 cm-1处的峰主要是由于C-H的伸缩振动,1 639 cm-1处的峰是C=O和C-N 的振动特征峰,1 224 cm-1处的峰归属于C-N的伸缩振动,1 072 cm-1位置的峰可能是Cu-N的伸缩振动引起[21]。图2D为Cu-N-C的X射线光电子能谱(XPS)谱图,从其特征谱图中可以看到5个不同的特征峰,分别为C 1s,N 1s,O 1s,Cu LMM和Cu 2p,表明该材料存在C、N、O和Cu元素,这与红外光谱的检测结果相一致。
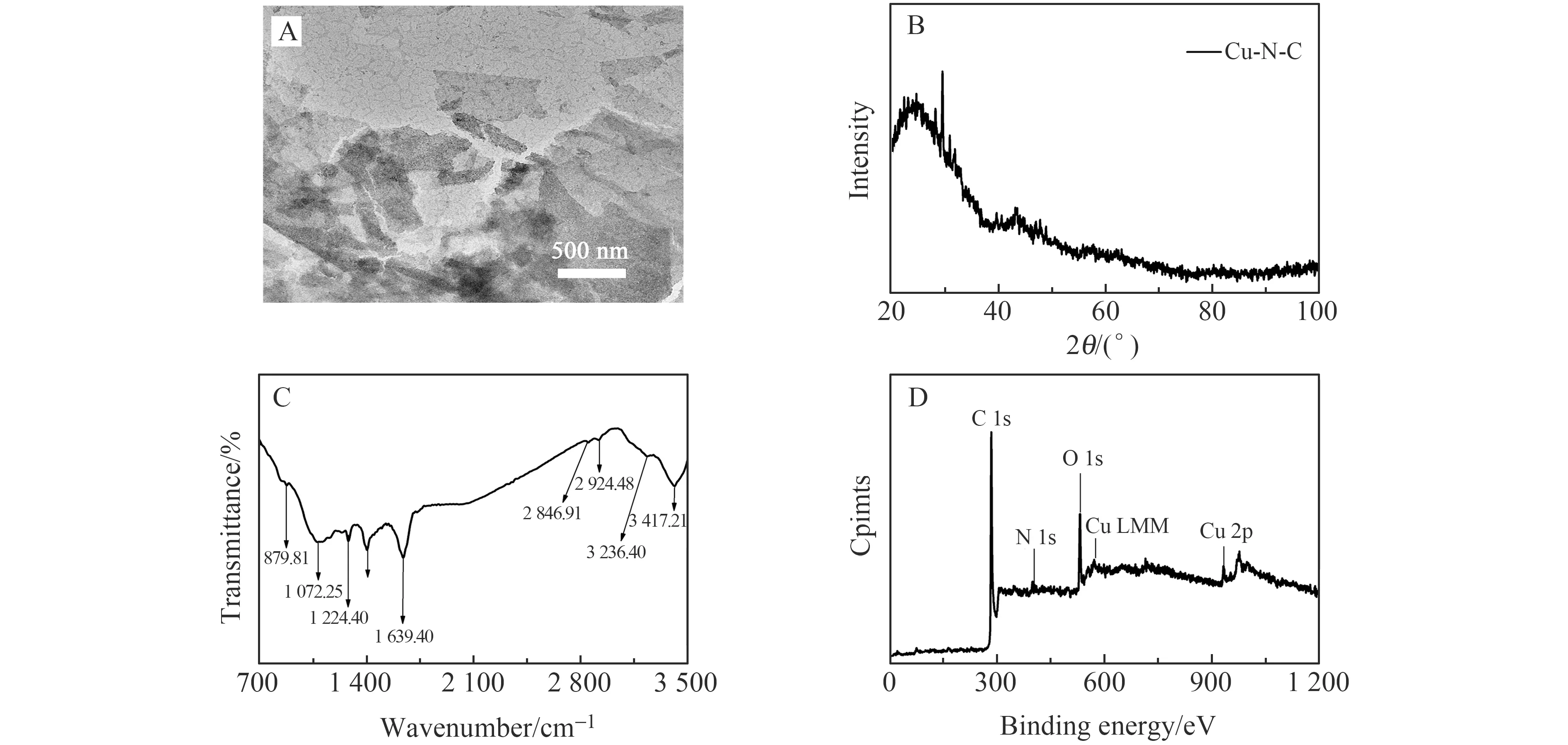
图2 Cu-N-C的TEM图(A),XRD谱图(B),FTIR谱图(C)和XPS谱图(D)Fig.2 TEM image (A),XRD spectrum (B),FTIR spectrum (C),and XPS spectrum (D) of Cu-N-C
2.2 Cu-N-C纳米酶的酶活分析
在H2O2存在下,对一些典型的致色底物,包括TMB、OPD、ABTS、4-AP/Phenol(图3),Cu-N-C均可催化这些底物变色,表明所制备的Cu-N-C单原子纳米酶催化性能优异。考察了TMB作为底物时,Cu-N-C和辣根过氧化物酶(HRP)的酶促反应动力学。由图4A可知,在合适的条件下,Cu-N-C催化底物H2O2-TMB反应的动力学特征与典型的米氏动力学方程相符合,催化反应的速度随着TMB底物浓度的增加明显增加,表明Cu-N-C可能先与底物H2O2反应产生·OH,进一步氧化底物TMB生成蓝色氧化oxTMB。米氏常数Km和最大反应速率Vmax相关数据列于表1中。结果表明:Cu-N-C对TMB,其动力学参数Km比HRP的低,表明其对TMB的亲和力高于HRP,而Vmax比HRP高,展示了更高的催化反应速度。

图3 Cu-N-C氧化不同底物的紫外-可见光谱图Fig.3 UV-vis spectra of reaction systems treated with different substrates
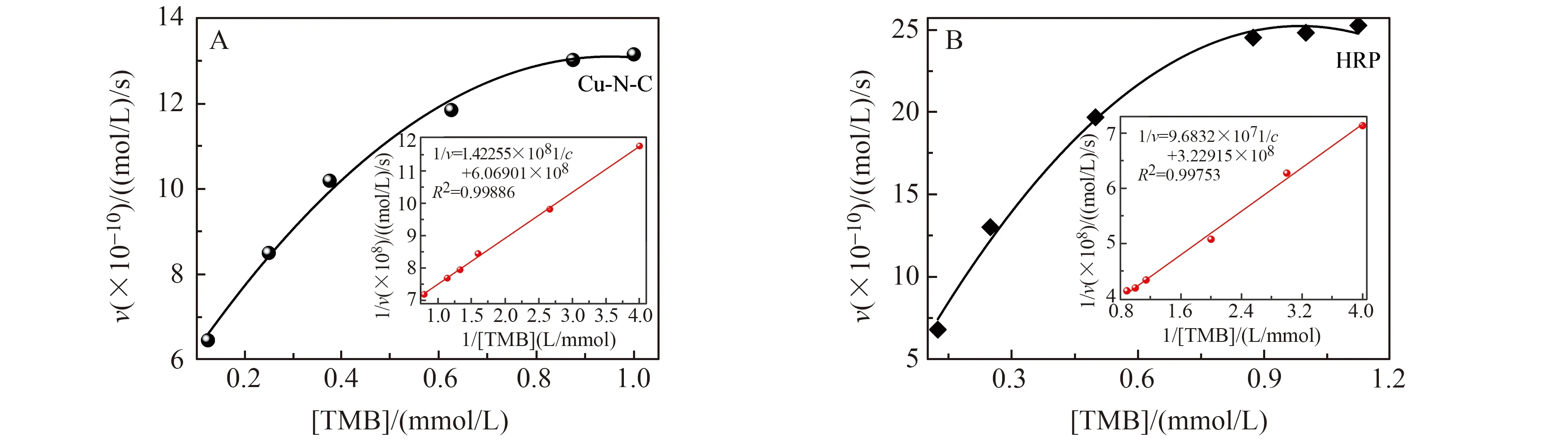
图4 H2O2浓度不变Cu-N-C (A)和HRP (B)存在下TMB浓度变化的动力学实验Fig.4 Kinetic assay with the variation of TMB concentration at constant H2O2 concentration in the presence of (A) Cu-N-C and (B) HRP

表1 以TMB为底物的米氏常数(Km)和最大反应速率(Vmax)的比较Table 1 Comparison of the Michaelis-Menten constant (Km) and maximum reaction rate (Vmax) for TMB as substrate
2.3 过氧化物酶活性的机理研究

图5 Cu-N-C-H2O2体系的电子自旋共振(ESR)谱图Fig.5 ESR spectra of the Cu-N-C-H2O2 system
2.4 酸碱诱导的低共熔溶剂微萃取水质中挥发酚
2.4.1 微萃取条件优化Cu-N-C纳米酶表现出的优异过氧化酶催化活性,通过其催化氧化酚类化合物和4-AP的显色反应,建立挥发酚的测定方法。挥发酚类化合物在水中存在的浓度非常低,且环境水样基质较为复杂,因此在测定之前一般需要预富集和净化。本研究利用环保绿色的低共熔溶剂(DES)作萃取剂进行Cu-N-C-H2O2-苯酚-4-AP体系的萃取,结果表明,以正庚酸与薄荷醇摩尔比为1∶1的DES为萃取剂,用NH3·H2O作为乳化剂促进DES萃取剂的分散。之后再利用HCl作为破乳剂实现DES萃取剂的分相,最后,通过离心手段分离后,取上层萃取相进行光度测定。整个实验流程如图6所示,通过酸碱诱导结合DES萃取剂,可以达到非常好的萃取分离效果。经过条件试验优化之后,发现在总体积为50 mL的溶液中,以0.2 mL摩尔比为1∶1的正庚酸-薄荷醇的DES作为萃取剂,加入1 mL NH3·H2O乳化和1 mL HCl破乳时,萃取效果最佳。
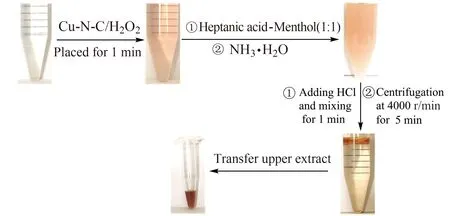
图6 酸碱诱导的低共熔溶剂微萃取示意图Fig.6 Schematic illustration of acid-base induced DES extraction
2.4.2 Cu-N-C纳米酶检测体系优化在H2O2或者O2参与下,以苯酚为模型底物,利用纳米酶的过氧化酶活性与4-AP反应生成红色产物[22]。如图7所示,在没有H2O2存在下,Cu-N-C也能催化4-AP和酚的偶联显色,但H2O2存在下,其颜色将更深,表明该纳米酶具有氧化酶和过氧化物酶双重酶活。通过测定不同pH值(用柠檬酸-磷酸氢二钠缓冲溶液调节)下Cu-N-C的催化活性,如图8A所示极酸条件下Cu-N-C的催化活性几乎为零,pH=7.0时催化活性最高,pH高于7之后,活性逐渐降低,表明酶对极端条件(极酸、极碱)较敏感。推测H2O2在Cu-N-C催化作用下,能产生·OH,自由基的产生加速了催化反应速度,使红色物质得以快速生成。因此,H2O2的浓度对Cu-N-C的过氧化物酶活性有着良好的催化能力。
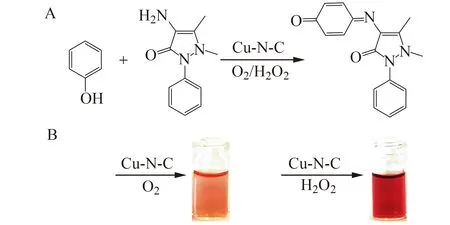
图7 Cu-N-C-H2O2氧化苯酚体系Fig.7 Phenol oxidation system of Cu-N-C-H2O2
在Cu-N-C/H2O2/苯酚/4-AP体系中,苯酚浓度在1.25~250 μg/L范围内与氧化产物的吸光度呈现良好的线性关系,因此该方法可用于挥发酚的检测(图8B)。同时,在3个不同加标浓度(5,100和200 μg/L)条件下,方法的加标回收率均在96.8%以上(表2)。

图8 pH的影响(A);苯酚检测线性范围(B)Fig.8 (A)Effect of pH;(B)Linear range of phenol detection (B)
3 结论
本研究建立了一种铜基单原子纳米酶结合酸碱诱导分散液液微萃取技术的分光光度法测定地表水中挥发酚的方法。研究以盐模板法合成了具有双重酶活(过氧化物酶和氧化酶活性)的铜基单原子纳米酶(Cu-N-C)。利用Cu-N-C的过氧化物酶活性,催化H2O2产生·OH,促进酚与4-AP偶联显色,结合低共熔溶剂酸碱诱导分散液液微萃取,实现水质中挥发酚的快速、高灵敏检测,方法检出限为0.5 μg/L,且成功用于实际地表水样中挥发酚的检测。该方法在实际检测应用中具备一定的可信度和可能性。

