双柱净化-高效液相色谱-串联质谱法测定猪肉中7种头孢菌素残留量
杨旺火, 陈铭洋, 林一敏, 黄海斌, 谢佳怡
(1.厦门泓益检测有限公司 肉食品安全生产技术国家重点实验室,福建厦门 361000; 2.厦门华厦学院环境与公共健康学院,福建厦门 361024)
头孢菌素类抗生素是一类具有β-内酰胺环的半合成抗生素,目前已经发展到第五代。由于其具有抗菌谱广、毒副作用小、过敏反应少等特点,被广泛应用于人和动物的疾病治疗[1]。在家畜的饲养过程中,倘若头孢菌素被滥用,容易在动物体内积蓄而引起残留,通过食物链传导后,会对人们的健康造成危害,同时头孢抗生素的滥用有可能造成“超级细菌”的产生,导致药物治疗失效[2 - 4]。因此,头孢类药物在动物源性食品中的残留问题已引起了各国重视,中国、日本、美国和欧盟等都已规定了动物源性食品中头孢菌素类药物残留的最大残留限量。我国国家标准(GB 31650-2019)《食品安全国家标准 食品中兽药最大残留限量》中对头孢菌素药物的限值也做了规定,其中头孢氨苄在牛肉中最高残留限量值为0.2 mg/kg,头孢喹肟在猪、牛肉中限量值为0.05 mg/kg、头孢噻呋为1.0 mg/kg。然而,该标准中只规定了三种头孢药物的限量值,其余项目均未进行规定,具有潜在的风险。因此,建立一种高效、准确、灵敏度高的猪肉中多种头孢菌素的检测方法具有重要的意义。
目前,头孢菌素的检测方法主要有高效液相色谱法[5,6]、液相色谱-串联质谱法[7 - 13]、毛细管电泳法[14]、电化学法[15]和流动注射化学发光法[16 - 18]等,其中液相色谱-串联质谱法以其高灵敏度、高通量以及高定性准确度而被广泛采用。已有的文献报道[7 - 13]和标准方法[19 - 23]主要集中在牛奶、牛肉、水产品和蜂蜜等基质的样品分析。崔风云等[9]建立了一种分散固相萃取结合液相色谱-串联质谱测定牛肉中7种头孢菌素残留,金晓峰等[13]采用80%乙腈水溶液提取液肌肉中头孢拉定,经PRIME HLB柱净化后液相色谱-串联质谱测定,定量限为1 μg/kg。而目前现行国家标准方法涉及的检测项目偏少,同时也存在检测限偏高等不足[19 - 23]。本方法针对猪肉基质,采用双固相萃取柱进行净化,高效液相色谱-串联质谱(HPLC-MS/MS)对猪肉中7种头孢菌素类药物残留进行检测,该方法灵敏度高,回收率好,能有效去除基质效应,实现准确定量,可应用于实际猪肉样品中头孢菌素的分析检测。
1 实验部分
1.1 仪器与试剂
UltiMate3000高效液相色谱-串联TSQ QUANTUM ACCESS三重四极杆质谱仪(美国,Thermo Fisher Scientific公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);LXJ-IIB离心机(上海安亭科学仪器厂);BSA224S-CW分析天平(赛多利斯科学仪器(北京)有限公司);Unique-R10超纯水机(锐思捷科学仪器有限公司)。
头孢克肟(Cefixime,纯度99.8%)、头孢匹林(Cefapirin,纯度92.2%)、头孢唑林(Cefazolin,纯度98.6%)、头孢噻呋(Ceftiofur,纯度96.7%)、头孢氨苄(Cephalexin,纯度99.7%)、头孢洛宁(Cephalonium,纯度98.2%)均购自北京墨坛质检科技有限公司;头孢喹肟(Cefquinome,纯度95.2%)购自北京曼哈格生物科技有限公司;甲醇、乙腈、甲酸(色谱纯,瑞典Oceanpak公司)。HLB、MAX固相萃取小柱,规格均为60 mg/3 mL,购自上海安谱实验科技股份有限公司。
1.2 标准溶液的配制
分别准确称取适量的标准物质,其中头孢克肟用50%甲醇水溶液溶解定容至10 mL,头孢噻呋先用N,N-二甲基甲酰胺溶解后,用水定容至10 mL,其余标准物质均用50%乙腈水溶液溶解定容至10 mL,制得浓度约为1 mg/mL的标准储备液,置于冰箱-18 ℃下保存,有效期6个月。分别准确移取适量上述标准储备溶液于10 mL容量中混合,用50%乙腈水溶液定容至刻度,制成浓度均为1.0 μg/mL的混合标准中间液,置于冰箱2~8 ℃下保存,有效期3周。
1.3 样品前处理
1.3.1 提取准确称取2 g试样,加入85%乙腈水溶液10 mL,涡旋混匀1 min,超声提取30 min,然后在10 000 r/min下离心5 min。准确取上清液5 mL于刻度管中,加入3 mL乙腈饱和正己烷,涡旋混合 30 s,静置分层后,弃去上层正己烷,下层溶液于45 ℃水浴中氮吹浓缩至约1 mL后,用3 mL纯水复溶,充分混匀后,待净化。
1.3.2 净化取HLB和MAX固相萃取小柱进行串接,HLB柱在上,MAX柱在下,串接的小柱经3 mL甲醇和3 mL水活化后,将上述复溶液上样净化。待样液完全流出MAX柱后,用3 mL纯水淋洗串接小柱,弃去流出液,放入刻度管,用3 mL甲醇洗脱串接小柱,接收流出液。待流出液完全流出HLB柱后,弃去HLB柱,再用3 mL 5%的酸化甲醇洗脱MAX柱,接收流出液,合并两次的流出液。于45 ℃水浴中氮吹浓缩至近干后,残渣用1 mL纯水复溶,经0.22 μm有机微孔滤膜过滤,进液-质联用仪分析测定。
1.4 仪器条件
1.4.1 液相色谱条件Waters BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相A为0.1%甲酸水,B为乙腈。梯度洗脱条件:0~4.0 min,2%~70%B;4.0~4.5 min,70%B; 4.51~7.0 min,2%B。流速:0.3 mL/min;进样量:5 μL;柱温:35 ℃。
1.4.2 质谱条件采用电喷雾离子源电离正离子源(ESI+);多反应监测(MRM)模式检测;喷雾电压:4 000 V;鞘气流量:45 L/min;辅助气流量:15 L/min;毛细管温度:320 ℃;辅助气加热温度350 ℃。7种头孢菌素的质谱条件参数见表1。
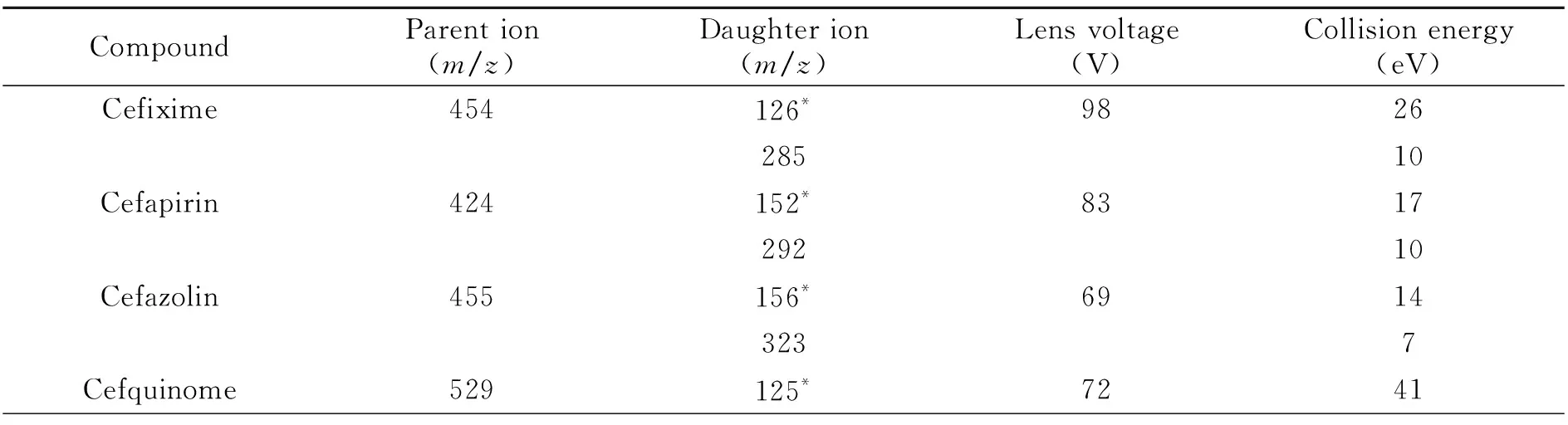
表1 7种头孢菌素的质谱检测参数Table 1 Mass spectrometric parameters for 7 cephalosporins

(续表1)
2 结果与讨论
2.1 质谱条件优化
首先,采用0.1%甲酸水-乙腈为50∶50的比例作为流动相,0.1 mL/min的流速条件下,将浓度为1.0 μg/mL的7种头孢菌素混合标准工作溶液,采用针泵注射方式分别注入离子源进行参数优化,选择7种化合物的最佳质谱条件。在酸性条件下,各个化合物进入一级质谱后,均可产生稳定的[M+H]+离子,因此选则正离子模式进行电离,得到目标物的母离子质荷比;其次,采用产物离子扫描模式,得到目标物碎片离子丰度最大和次大的碎片离子作为定量离子对和定性离子对;最后,采用MRM模式,对所选取的两对离子对进行源内碎裂电压和碰撞能量等条件进行优化。最终得到各物质的质谱检测条件如表1所示。
2.2 色谱条件优化
通常液相色谱-串联质谱在正离子分析模式下,为了提高目标物的离子化效率,改善峰形,在流动相中添加少量的挥发性酸,如甲酸,乙酸等。本实验比较了0.1%甲酸水-乙腈、水-乙腈、和0.1%甲酸水-甲醇三种体系作为流动相,结果表明,当采用水-乙腈作为流动相时,头孢克肟、头孢喹肟两种化合物的峰形和响应较差;当采用0.1%甲酸水-乙腈作为流动相时,头孢克肟和头孢喹肟两者的峰形和响应得到较大改善,其余的化合物的峰面积响应值也均变大。说明在正离子模式下,甲酸的加入提高了化合物的离子化效率,且改善了峰形。同时比较了0.1%甲酸水-乙腈和0.1%甲酸水-甲醇两者的分离效果和响应值,发现,采用乙腈作为流动相中有机相时,7种化合物的分离度和响应值均略好于用甲醇作为有机相,此外采用甲醇在梯度洗脱过程中需要更长的平衡时间和产生更大的系统压力。为了提高分析效率和防止长期高压导致液相系统泄漏,本实验选择用0.1%甲酸水-乙腈作为流动相。优化后的7种头孢菌素的提取离子色谱图见图1。

图1 7种头孢菌素药物的提取离子色谱图Fig.1 Selected ion chromatograms of 7 cephalosporins
2.3 前处理条件优化
2.3.1 提取溶剂的选择头孢菌素药物一般以乙腈和水的混合溶液作为提取溶液,一方面由于大部分头孢菌素类药物易溶于水,而乙腈在提取过程中可以起到沉淀蛋白质的作用。本实验以阴性猪肉样品添加10 μg/kg的标准混合溶液,对比了80%乙腈水溶液、85%乙腈水溶液、90%乙腈水溶液、95%乙腈水溶液和纯乙腈5种提取溶液的提取效果,结果如图2所示。从图中可以看出,5种提取液中头孢喹肟和头孢洛宁两种化合物均存在基质增强效应,回收率均大于100%,而当采用乙腈作为提取溶液时,头孢克肟和头孢匹林二者无回收,随着提取液中水相比例的不断增大两者的回收率也不断增大,当水相比例达到15%时二者的回收率达到最大值,其余3种化合物的回收率则比较稳定。因此本实验采用85%乙腈水溶液作为提取溶液。
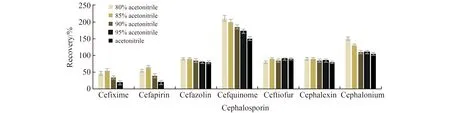
图2 不同溶剂提取效果的比较(n=3)Fig.2 Comparison of extraction efficiencies of cephalosporins using different solvents(n=3)
2.3.2 净化方式的选择本实验首先采用乙腈饱和正己烷对提取液进行液-液萃取初步除脂,然后考察了HLB、C18、WAX、MCX和MAX 5种固相萃取小柱对头孢菌素的保留效果,结果如表2所示。从表中可以看出,C18以及MCX小柱对大部分的头孢菌素保留均不理想,HLB除了头孢克肟和头孢匹林外,其余组分保留效果较好,与之互补的是WAX和MAX小柱,二者的头孢克肟保留效果均较好,且MAX柱的头孢匹林保留效果要好于WAX柱。综合考虑,本实验选择采用HLB串联MAX小柱的双柱进行样品溶液的净化。
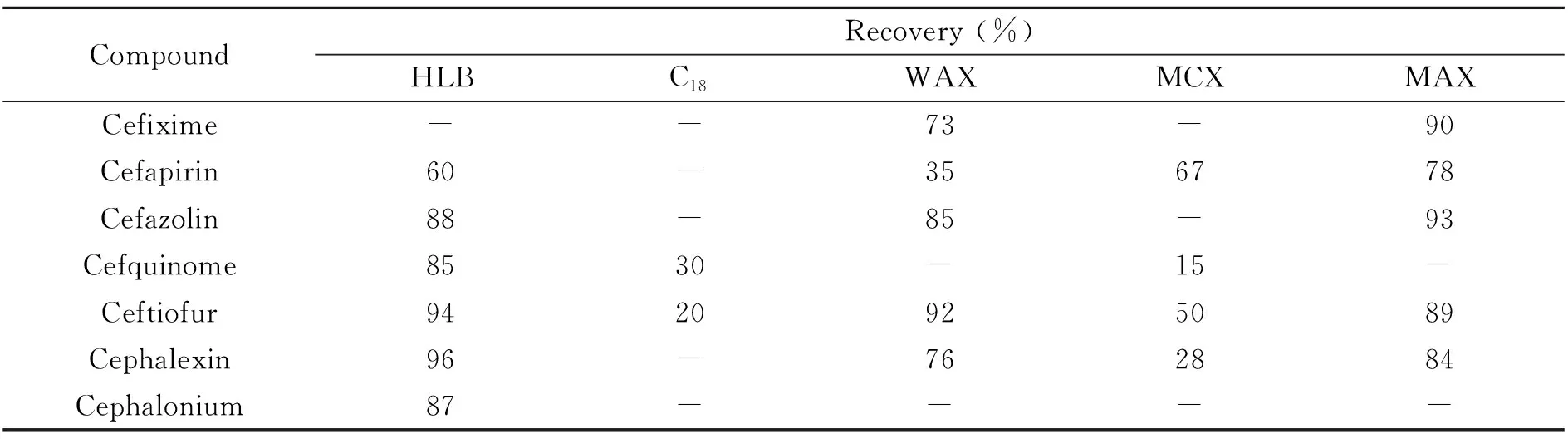
表2 5种固相萃取小柱的回收率(n=3)Table 2 Recoveries of 5 kinds of solid phase extraction columns(n=3)
2.4 方法学验证
2.4.1 线性范围与检测限将配制好的质量浓度为2、5、10、20、50和100 ng/mL的系列标准工作溶液,在优化条件下进行测定,以峰面积(Y)为纵坐标,对应的质量浓度(X)为横坐标,绘制标准曲线。结果表明,各组分在2~100 ng/mL范围内线性关系良好,决定系数(r2)均大于0.99。以特征定量离子对色谱峰的信噪比(S/N)=3为检出限,信噪比(S/N)=10为定量限,得到7种化合物的检出限为0.08~0.2 μg/kg,定量限为0.2~0.6 μg/kg。具体结果见表3。
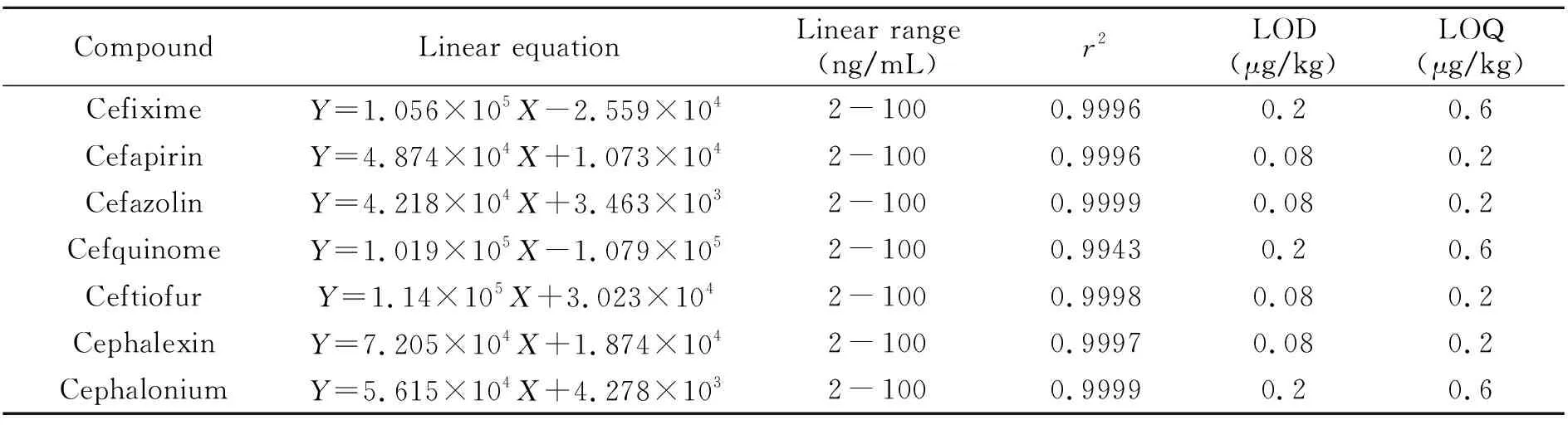
表3 7种头孢类药物的线性方程、线性范围、线性相关系数、检出限(LOD)及定量限(LOQs)Table 3 Linear equations,linear ranges,correlation coefficients(r2),LODs and LOQs of 7 cephalosporins
2.4.2 回收率及精密度采用猪肉阴性样品进行加标回收和精密度试验。向猪肉阴性样品中添加5、10、20 μg/kg共3个水平的混合标准工作溶液,进行加标回收试验,每个水平平行测试6个样本,结果见表4。在5~20 μg/kg添加范围内,平均回收率为80.7%~112%,相对标准偏差(RSD)为2.5%~8.6%。

表4 7种头孢类药物的平均加标回收率及相对标准偏差(n=6)Table 4 Average spiked recoveries and relative standard deviations(RSDs) of 7 cephalosporins(n=6)
2.5 实际样品的检测
用本方法对市售的20份猪肉样品进行检测,同时作加标回收质控实验。结果显示,所有的样品均未检出上述7种头孢菌素化合物,且质控样品中7种头孢菌素的回收率均大于80%,根据国家标准(GB/T 27404-2008)《实验室质量控制规范 食品理化检测》附录F.1中的规定,当被测组分含量小于0.1 mg/kg时,回收率应在60%~120%之间,本次质控回收率均能达到实验室质控分析要求,结果准确可靠。
3 结论
本文建立了液相色谱-串联质谱检测猪肉中7种头孢菌素类药物残留的方法。采用乙腈水溶液作为提取液,正己烷脱脂后,采用HLB和MAX双固相萃取小柱对样品进行净化,方法的回收率和精密度均能满足实验要求,方法具有检测限低,定量准确等特点,适用于猪肉中头孢菌素类药物的残留检测。

